Mikroorganismen des Zahnbelags
Maschinenübersetzung
Der Originalartikel ist in RU Sprache (Link zum Lesen) geschrieben.
Heutzutage haben Mikrobiologen erhebliche Fortschritte beim Studium der Rolle der bakteriellen Flora des Zahnbelags in der Entwicklung von Parodontalerkrankungen gemacht.
Über die Untersuchung der Mikroflora der Mundhöhle im Webinar Kariesologie: Diagnose, Risikobewertung, nicht-invasive und minimal-invasive Behandlung in der Kinderzahnheilkunde.
Zahnbelag
Einige Stunden nach gründlichem Zähneputzen beginnt sich der Zahnbelag aufgrund bestimmter physikalisch-chemischer Prozesse zwischen der Emailoberfläche und den Speichelkomponenten erneut zu bilden, was zur Bildung eines dünnen Films, der Pellikula, führt.
Der Bildungsprozess durchläuft die folgenden Stadien:
- Bakterienmigration,
- Adhäsion,
- Anhaftung,
- Kolonisierung.
Mikrobielle Assoziationen wachsen ständig aufgrund mangelnder hygienischer Pflege. Nach 36 Stunden wird bei der klinischen Untersuchung visuell Zahnbelag festgestellt, der eine strukturierte, weiche, am Zahn haftende Bildung darstellt, die nicht mit Wasser abgespült werden kann.
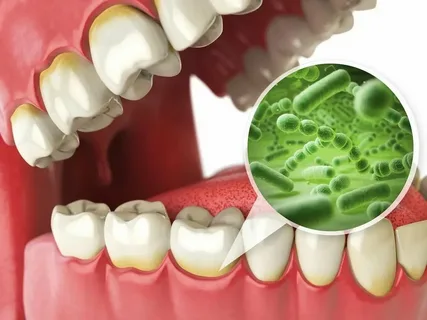
Abbildung 1. Mikroorganismen des Zahnbelags.
Die Intensität der Bildung von Zahnbelag wird durch eine Reihe von Faktoren bestimmt, zu denen man zählen kann:
- tägliche Gewohnheiten (Häufigkeit der Nahrungsaufnahme, Rauchen, Qualität der Hygiene, Verwendung von Fluoriden, antibakteriellen Medikamenten),
- biochemische und biophysikalische Indikatoren der Mundflüssigkeit,
- besondere Merkmale der Zahnstruktur,
- Retentionfaktoren,
- Besonderheiten des Bisses.
Zahnbelag, der längere Zeit auf der Zahnoberfläche verbleibt, mineralisiert allmählich und bildet Zahnstein. Die Kalzifizierung ist das Ergebnis der komplexen Wirkung von bakteriellen, biologischen und physikochemischen Faktoren. Als Ergebnis der Penetration von Calciumphosphatkristallen aus dem Speichel beginnen diese in Form von Mineralsalzen auf einer kolloidalen Basis abzulagern. Dies geschieht im supragingivalen Belag, während im subgingivalen Belag die Mineralien aus dem Blutserum stammen. Die Mineralisierung des Zahnbelags kann innerhalb von 12 Tagen erfolgen. Der Zahnstein bildet sich vollständig nach einem Monat.
Das Wachstum von Zahnstein auf der Zahnoberfläche erfolgt durch die Ansammlung einer Schicht von Zahnbelag. Zahnstein, mit seiner rauen Oberfläche, begünstigt die Adhäsion von Mikroorganismen. Mit zunehmender Dicke des Belags ändert sich seine mikrobiologische Zusammensetzung.
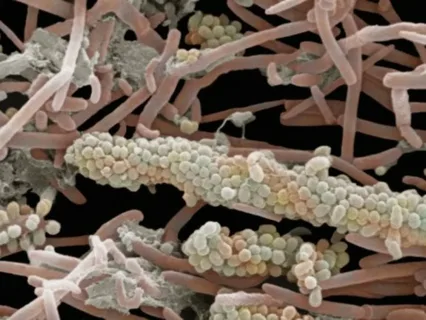
Abbildung 2. Zahnbelag unter dem Mikroskop.
Es wurden etwa 600 Arten von Bakterien identifiziert, die im supra- und subgingivalen Belag leben. Am zweiten bis dritten Tag besteht der Belag vorwiegend aus grampositiven Aeroben, hauptsächlich Streptokokken und Aktinomyzeten.
Der Verbrauch von Sauerstoff durch aerobe Mikroorganismen verringert das lokale Redoxpotenzial, was die Voraussetzungen für das Auftreten von gramnegativen Anaerobiern am dritten bis vierten Tag schafft.
Zusammen mit den Veränderungen in der Mikroflora gibt es eine komplexe Interaktion zwischen verschiedenen Arten. Zum Beispiel führen St. Actinomyces die Fermentation von Zuckern durch, was die Konzentration von Milchsäure erhöht, die für das Leben der anaeroben gramnegativen Kokken Veillonella notwendig ist, und deren Stoffwechselprodukt – Menadion ist notwendig für das Leben von Prevotella intermedia und Porphyramonas gingivalis.
Die Stoffwechselprodukte der gramnegativen Anaerobier schaffen günstige Bedingungen für die weitere Aktivierung der anaeroben Kolonisierung. Fusobacterium nucleatum verursacht die Akkumulation von Ammoniumkationen; Vertreter der Gattung Capnocytophaga produzieren den Anion der Bernsteinsäure; Campylobacter – ein organisches rotes Pigment, das Eisen enthält. Die beschriebenen Metaboliten unterstützen das Leben anderer aggressiverer Bakterien, die von Wissenschaftlern als potenziell parodontopathogen eingestuft wurden. Diese Tatsache unterstreicht ihre wesentliche Rolle in der Pathogenese der Parodontitis, der Bildung von parodontalen Taschen, der Resorption des Alveolarknochens und der Zerstörung des Bindegewebes.

Abbildung 3. Mikrobieller Biofilm.
Für die Bestimmung der in der parodontalen Region lebenden Mikroorganismen wurden folgende Kriterien vorgeschlagen:
- Assoziation mit der Krankheit – die Anzahl des Stammes nimmt am Ort der Läsion mit dem Fortschreiten der Krankheit zu;
- die Anzahl des Stammes nimmt im Bereich der Läsion bei Durchführung einer wirksamen Behandlung ab;
- Invasion von Vertretern der Art in das Gewebe des Parodonts löst eine humorale und zelluläre Immunantwort aus;
- Vorhandensein von Virulenzmechanismen, die in der Lage sind, das Gewebe des Parodonts zu zerstören;
- Fähigkeit des Stammes, ein ätiologischer Faktor der Parodontalerkrankung zu werden.
Virulenz von Bakterien in Zahnbelag
Virulenz ist die Fähigkeit eines Mikroorganismus, einen bestimmten Organismus zu infizieren. Sie sollte nicht mit Pathogenität verwechselt werden – der Fähigkeit, die Entwicklung einer Krankheit zu verursachen, da der infektiöse Agent nach der Infektion ein Symbiont des Wirts werden kann. Die Virulenz hängt von den Eigenschaften des infektiösen Agenten selbst ab – dies sind Virulenzfaktoren und von der Empfänglichkeit, der Sensibilität des Wirtsorganismus.
Die Virulenzfaktoren von Mikroorganismen im Zahnbelag werden in zwei große Gruppen unterteilt:
- Faktoren, die es Bakterien ermöglichen, sich in den Geweben der Mundhöhle zu kolonisieren und tiefer einzudringen (Anhaftung, Kolonisierung, Invasivität);
- Faktoren, die es Mikroorganismen ermöglichen, indirekt oder direkt die Zerstörung von Wirtsgeweben zu verursachen (Antigenität, Toxigenität, Unsichtbarkeit für das Immunsystem).
Adhäsion und Kolonisierung
Die Fähigkeit eines infektiösen Agenten, sich in der parodontalen Umgebung anzulagern, ist ein Virulenzfaktor. Die parodontale Tasche, wie auch die gingivale Rinne, enthalten gingivale Flüssigkeit, die sich von der Basis der Tasche oder Rinne nach außen bewegt. Vertreter der Bakterien, die diesen Bereich kolonisieren, haften an den umgebenden Oberflächen (Zahnwurzel oder -krone, bestehender Belag, Weichgewebe), um ein Wegspülen durch den Flüssigkeitsstrom zu vermeiden.

Abbildung 4. Kolonisierung der Zahnoberfläche.
Die ersten, die sich an der auf der Zahnoberfläche befindlichen Pellikel anheften, sind Streptococcus sanguis, oralis, mitis, die über Oberflächenrezeptoren verfügen, die das Anhaften anderer Bakterienarten erleichtern (Koaggregation). In der Literatur ist die am vollständigsten beschriebene Wechselwirkung dieser Art die Anheftung von Actinomyces viscosus an die Oberflächenfimbrien von Streptococcus sanguis durch die Polysaccharidrezeptoren der letzteren. Porphyromonas gingivalis heftet sich mit Hilfe von Fimbrien an Fibroblasten und Epithelzellen. P. gingivalis hat die Fähigkeit, sich mit anderen Bakterien, Epithelzellen und Strukturen des Bindegewebes zu verbinden, was ein Virulenzfaktor dieses Mikroorganismus ist.
Die Grundlage der bakteriellen Kolonisierung beruht auf der Fähigkeit der Bakterien, sich an das Gewebe der Mundhöhle zu binden und effektiv miteinander zu interagieren, was als der erste Schritt eines erfolgreichen bakteriellen Eindringens angesehen wird.
Invasivität
Die in der Literatur beschriebenen histologischen Studien bestätigen das Vorhandensein von Mikroorganismen in den parodontalen Geweben von Patienten mit fortschreitender Parodontitis und ulzerativer Gingivitis. In diesen Studien werden grampositive und gramnegative Bakterien, einschließlich Kokken, Stäbchen, Spirochäten und Filamente, im Zahnfleischgewebe sowie in unmittelbarer Nähe des Knochengewebes gefunden. Die Fähigkeit der Bakterien, tief in das Gewebe einzudringen, wird durch bestimmte bakterielle Enzyme ermöglicht, die eine erhöhte Aktivität und vielfältige Wirkung haben, darunter:
- Hyaluronidase,
- Neuraminidase,
- Kollagenase,
- Lecithinase.
Mikroorganismen dringen durch Geschwürstellen in der Anhaftungsepithel in den Wirtskörper ein und werden im interzellulären Raum des Zahnfleisches beobachtet. Eine andere Art des Eindringens ist das direkte Eindringen des infektiösen Agens in die epithelialen Zellen des Wirts oder die Bindegewebszellen. Die zweite Eindringmethode ist charakteristisch für folgende Mikroorganismen: P. gingivalis, A. actinomycetemcomitans, Treponema denticola und F. nucleatum.
Bild 5. Entfernung von Zahnbelag.
Forscher glauben, dass die Verschärfung der chronischen Entzündung des Parodontalgewebes direkt von der nächsten Phase der bakteriellen Penetration des Parodontalgewebes abhängt. Die parodontale Tasche stellt ein Reservoir von Mikroorganismen dar, deren Rekolonisierung einen plötzlichen Anstieg der Krankheitsaktivität auslöst. Diese Hypothese wurde klinisch bestätigt. Im Behandlungsprozess von Patienten mit diagnostizierter fortschreitender Parodontitis reicht eine mechanische Reinigung der parodontalen Tasche nicht aus, um den Entzündungsprozess zu stabilisieren. In den betroffenen Bereichen gelingt es nicht, die Kolonisierung von A. Actinomycetemcomitans zu reduzieren, zusätzlich wird die Einnahme von systemischen Antibiotika verschrieben, oft in Kombination mit chirurgischer Behandlung.
Mikrobielle Mechanismen des Eindringens in das Gewebe des Wirts umfassen direkte Gewebezerstörung, sowie indirekte, verursacht durch die Wirkung biologischer Mediatoren aufgrund des Entzündungsprozesses im Parodontalgewebe.
Über wichtige anatomische Aspekte des Parodontalgewebes im Webinar Fortgeschrittene Behandlung von Parodontalerkrankungen.
