Zusätzliche Schritte zur Desinfektion des Wurzelkanalsystems der mandibulären Molaren: Ein korrelativer bakteriologischer, mikro-Computertomographie- und Kryopulverisierungsansatz
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Einleitung: Diese Studie bewertete die Desinfektionsfähigkeit der chemomechanischen Aufbereitung mit rotierenden Nickel-Titan-Instrumenten, gefolgt von 2 verschiedenen ergänzenden Verfahren in den Wurzelkanälen extrahierter mandibularer Molaren mittels eines korrelativen analytischen Ansatzes.
Methoden: Zweiundzwanzig extrahierte mandibularische Molaren wurden ausgewählt und anatomisch zwischen den Gruppen auf der Grundlage einer mikro-Computertomographie-Analyse zugeordnet. In der ersten Phase des Experiments wurden die Wurzelkanäle mit Enterococcus faecalis kontaminiert und einer chemomechanischen Aufbereitung mit BT RaCe-Instrumenten und 2,5% NaOCl-Spülung unterzogen. Anschließend wurde entweder das XP-Endo Finisher-Instrument oder die passive ultraschallgestützte Spülung zur Ergänzung der Desinfektion verwendet. Die mikro-Computertomographie wurde verwendet, um zu zeigen, ob der Prozentsatz der unvorbereiteten Bereiche mit den Bakterienzahlen korrelierte. In der zweiten Phase wurden die gleichen Zähne erneut kontaminiert, und die ergänzenden Verfahren wurden angewendet. Proben aus dem Isthmusbereich der mesialen Wurzeln und dem apikalen 5-mm-Fragment der distalen Wurzeln wurden durch Kryopulverisation entnommen. Proben, die vor und nach den Behandlungsschritten in beiden Phasen entnommen wurden, wurden mittels quantitativer Polymerase-Kettenreaktion bewertet und statistisch analysiert.
Ergebnisse: In Phase 1 führte die Vorbereitung in beiden Gruppen zu einem erheblichen Rückgang der Bakterienzahlen (P < .001). Die ergänzenden Ansätze führten zu einer weiteren kleinen Bakterienreduktion, die für XP-Endo Finisher signifikant war (P < .05). Es wurden keine signifikanten Unterschiede zwischen den Gruppen hinsichtlich der verbleibenden Bakterienzahlen beobachtet. Die korrelative Analyse ergab keine statistisch signifikante Beziehung zwischen der Bakterienreduktion und dem Prozentsatz der unvorbereiteten Bereiche (P > .05). In Phase 2 hatten beide Methoden signifikante antibakterielle Effekte im Hauptkanal, aber keine von ihnen konnte die Isthmus-/Nischenbereiche vorhersehbar desinfizieren.
Schlussfolgerungen: Sowohl XP-Endo Finisher als auch passive ultraschallgestützte Spülung zeigten antibakterielle Wirksamkeit, aber nur erstere führte zu einer signifikanten Reduktion der Bakterienzahlen nach chemomechanischer Vorbereitung. Keine von ihnen war effektiv in der vorhersehbaren Desinfektion der Isthmus-/Nischenbereiche. (J Endod 2016;42:1667–1672).
Unabhängig von den Instrumentierungstechniken, Instrumenten und Spüllösungen wurde eine gründliche Reinigung, Desinfektion und Formgebung des Wurzelkanals insbesondere bei Zähnen mit gekrümmten Kanälen oder ungewöhnlichen Anatomien nicht häufig erreicht. Studien, die hochauflösende mikro-Computertomographie-Bildgebungstechnologie (Mikro-CT) verwendeten, haben gezeigt, dass 11%–48% der Hauptwurzelkanalbereiche nach der Instrumentierung unberührt bleiben. Diese Bereiche können von Biofilmen kolonisiert werden, die das Potenzial haben, unbeeinflusst zu bleiben und das Behandlungsergebnis zu gefährden. Darüber hinaus werden bestimmte anatomische Komplexitäten des Wurzelkanalsystems, wie Verzweigungen, Vertiefungen und Isthmus, von Instrumenten und Spüllösungen nicht häufig erreicht. Bakterien, die sich in diesen Bereichen befinden, können persistieren und zu persistierender apikaler Parodontitis führen. Tatsächlich haben klinische bakteriologische Studien gezeigt, dass Bakterien in etwa 30%–60% der Kanäle nach chemomechanischer Vorbereitung weiterhin nachgewiesen werden. Bakterien, die im Kanal persistieren, sind der wichtigste Risikofaktor für posttherapeutische apikale Parodontitis. Es wurden Anstrengungen unternommen, um ergänzende Ansätze zur Verbesserung der Wurzelkanaldesinfektion zu entwickeln. Dies umfasst Ansätze, die Spüllösungen in schwer erreichbare Bereiche treiben oder es dem Instrument ermöglichen, unbeeinflusste Regionen zu erreichen und mechanisch zu reinigen. Einer dieser ergänzenden Ansätze ist die passive ultrasonische Irrigation (PUI), die die ultrasonische Aktivierung einer Spüllösung umfasst. Daten aus in vitro und in vivo Studien, die die Vorteile in Bezug auf die antibakteriellen Effekte des ergänzenden PUI-Ansatzes mit NaOCl bewerten, waren nicht schlüssig.
Das XP-Endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Schweiz) Instrument wurde kürzlich mit dem Versprechen eingeführt, die Reinigung und Desinfektion von Wurzelkanälen zu verbessern. Dies ist ein nicht konisches Instrument der Größe 25, das aus einer Nickel-Titan-Legierung (NiTi) MaxWire (Martensit-Austenit Elektropolier FleX) besteht. Bei Raumtemperatur ist das Instrument in seiner Martensit-Phase gerade, aber bei Körpertemperatur wechselt es in die Austenit-Phase und entwickelt eine Löffel-Form; wenn es gedreht und auf und ab im Kanal bewegt wird, lässt diese Form das Instrument sich ausdehnen und zusammenziehen, um die Kanalwände zu berühren und die Spüllösung zu schütteln. Eine aktuelle Studie zeigte, dass XP-Endo Finisher und PUI das mesiale Wurzelkanalsystem mit signifikant niedrigeren Mengen an Hartgewebetrümmern im Vergleich zur herkömmlichen Spülung und einem modifizierten Selbstjustierenden Datei-Protokoll erfolgreich reinigten. Bisher hat nur eine Studie die antibakteriellen Vorteile der Verwendung von XP-Endo Finisher untersucht und bessere Ergebnisse als bei der herkömmlichen Spülung berichtet. Keine Studie hat die antibakteriellen Effekte dieses Instruments nach chemomechanischen Verfahren bewertet.
Die vorliegende Studie sollte die desinfizierende und formende Fähigkeit der chemomechanischen Aufbereitung mit rotierenden NiTi-Instrumenten bewerten, gefolgt von 2 unterschiedlichen ergänzenden Ansätzen in den Wurzelkanälen extrahierter mandibularer Molaren mittels einer korrelativen bakteriologischen und Mikro-CT-Analyse. Ein Kryopulverisierungsansatz wurde verwendet, um die bakteriologischen Bedingungen der Isthmus- und Recess-Bereiche nach der Verwendung entweder des XP-Endo Finisher-Instruments oder PUI ergänzender Verfahren zu bewerten.
Materialien und Methoden
Zahnwahl und Vorbereitung
Das Studienprotokoll wurde vom Ethikkomitee der Estácio de Sá Universität, Rio de Janeiro, RJ, Brasilien, genehmigt. Zweiundzwanzig extrahierte mandibulare Molaren mit 2 unabhängigen Kanälen, die apikal durch einen Isthmus im mesialen Wurzelbereich (Vertucci-Typ II) verbunden sind, und einem einzelnen distalen Kanal (Vertucci-Typ I) wurden aus einer Sammlung von 185 mandibularen Molaren auf der Grundlage von Röntgenaufnahmen in buccolingualer und mesiodistaler Richtung, Erkundung mit kleinen Feilen nach der Zugangsvorbereitung und Mikro-CT-Bildgebung mit einem SkyScan 1174v2-Scanner (Bruker-microCT, Kontich, Belgien) ausgewählt, der mit 50 Kv, 800 mA, isotropischer Auflösung von 19,86 mm und 180◦ Drehung um die vertikale Achse mit einem Drehschritt von 1,0 unter Verwendung eines 0,5 mm dicken Aluminiumfilters betrieben wurde.
Die Bilder jedes Exemplars wurden mit einer Ringartefaktkorrektur von 5, einer Strahlenhärtungskorrektur von 15 % und einer Glättung von 5 rekonstruiert (NRecon v.1.6.9.16; Bruker-microCT). Die Software CTAn v.1.14.4 (Bruker-microCT) wurde für die 3-dimensionale (3D) Auswertung des Wurzelkanals hinsichtlich Volumen und Oberfläche verwendet, und die Software CTVol v.2.2.1 (Bruker-microCT) wurde für die Visualisierung und qualitative Bewertung der Konfiguration des Wurzelkanalsystems eingesetzt. Die Exemplare wurden paarweise basierend auf den morphologischen und anatomischen Aspekten der mesialen und distalen Wurzelkanalsysteme, die durch Mikro-CT bewertet wurden, zugeordnet, und 1 Exemplar aus jedem Paar wurde zufällig einer der 2 Versuchsgruppen zugewiesen.
Die Wurzelkanäle wurden mit #15 Hand-K-Dateien erkundet, bis die Instrumentenspitze das apikale Foramen erreichte, wie durch ein Stereomikroskop visualisiert. Diese Maßnahme wurde als Durchgängigkeit gemessen, und die Kanäle wurden zunächst bis zu diesem Punkt mit dem BioRaCe BR2 (25/04) Instrument (FKG Dentaire) betrieben im VDW Gold Motor (VDW, München, Deutschland) bei 300 U/min, 1,5 N • cm, erweitert, um den anfänglichen Kanaldurchmesser zu standardisieren und Platz für bakterielle Kontamination zu schaffen. Die Schmierschicht wurde durch die Verwendung von 17 % EDTA und 2,5 % NaOCl-Spülung entfernt. NaOCl wurde mit 5 % Natriumthiosulfat inaktiviert. Die Zähne wurden erneut in Mikro-CT gescannt, wobei die zuvor genannten Parameter verwendet wurden, und die erhaltenen Datensätze wurden als Basislinie für den Vergleich mit den Bildern nach der Vorbereitung verwendet.
Phase 1
Für die Kontamination wurden die Wurzelkanäle mit Trypticase-Soja-Brühe (Difco, Detroit, MI) gefüllt, indem Navitip (Ultradent Products Inc, South Jordan, UT) Nadeln verwendet wurden, bis die Brühe durch das apikale Foramen floss. Die Zähne wurden in einem Kolben mit 50 ml Trypticase-Soja-Brühe platziert und 1 Minute lang ultrasoniziert, um eingeschlossene Luft freizusetzen und das Eindringen des Kulturmediums in die Unregelmäßigkeiten des Wurzelkanals zu ermöglichen. Anschließend wurden die Zähne in einem Autoklaven sterilisiert. Eine frische Kultur von Enterococcus faecalis ATCC 29212, die 24 Stunden bei 37◦C gezüchtet wurde, wurde als Inokulum für die Kontamination des Wurzelkanals verwendet. Die Zähne wurden 30 Tage lang bei 37◦C unter sanftem Schütteln inkubiert, und das Kulturmedium wurde wöchentlich aufgefrischt. Später wurde bei allen kontaminierten Zähnen das überschüssige Kulturmedium abtropfen gelassen, und die äußeren Wurzeloberflächen wurden mit steriler Gaze abgewischt. Zwei Zähne wurden in 10% gepufferter Formalin fixiert und für die Rasterelektronenmikroskopie (REM) verarbeitet, um die bakterielle Kolonisation zu bestätigen, wie an anderer Stelle beschrieben.
Die apikalen Foramina jeder Wurzel wurden mit Topdam (FGM, Joinville, SC, Brasilien) versiegelt, um apikalen bakteriellen Leckagen vorzubeugen und ein geschlossenes System zu schaffen. Vor der Wurzelkanalaufbereitung wurden die äußeren Wurzeloberflächen mit 3% Wasserstoffperoxid gereinigt und mit 2,5% NaOCl desinfiziert, gefolgt von der Inaktivierung letzterer mit 5% Natriumthiosulfat. Die Zähne wurden bis zur zervikalen Region vertikal in Blöcke aus Silikonabformmaterial (President Jet; Coltène AG, Cuyahoga Falls, OH) montiert. Die Zahnkrone, einschließlich der Wände der Pulpenkammer, und die Silikonoberfläche wurden mit 2,5% NaOCl desinfiziert, gefolgt von der Inaktivierung dieser Substanz mit 5% Natriumthiosulfat. Proben wurden aus dem Wurzelkanal entnommen, indem Papierpunkte vor (P1S1) und nach der chemomechanischen Aufbereitung (P1S2) und nach dem ergänzenden Ansatz (P1S3) verwendet wurden (Abb. 1A). Der Wurzelkanal wurde mit 1 ml steriler 0,85%iger Kochsalzlösung gespült, um nicht angeheftete Zellen zu entfernen, und 3–5 sterile Papierpunkte wurden nacheinander auf der Arbeitslänge (WL) verwendet, die auf 0,5 mm der Durchgängigkeit festgelegt wurde. Jeder Papierpunkt blieb 1 Minute im Kanal. Papierpunkte wurden in Röhrchen mit 1 ml Tris-EDTA-Puffer (10 mmol/L Tris-HCl, 1 mmol/L EDTA, pH 7,6) transferiert und bei –20◦C eingefroren. Im mesialen Wurzel wurden Proben aus jedem Kanal entnommen, aber sie wurden für weitere bakteriologische Analysen zusammengefasst, da die 2 Kanäle im apikalen Bereich zu 1 zusammenflossen. Die Kanäle wurden auf der WL mit dem BT RaCe-System (FKG Dentaire) vorbereitet, das im VDW Gold-Motor bei 600 U/min, 1,5 N • cm, bis zum BT3-Instrument betrieben wurde. Die Spülung erfolgte mit 2,5% NaOCl, das mit Navitip-Nadeln bis zu 2 mm vor der WL eingebracht wurde (Abb. 1A). Während der Instrumentierung der mesialen Kanäle wurde die Öffnung des distalen Kanals mit Topdam versiegelt (und umgekehrt), um das Auslaufen von Spüllösungen zu vermeiden. Nach der apikalen Aufbereitung wurde der Kanal mit NaOCl, EDTA (zur Entfernung der Schmierschicht) und dann erneut mit NaOCl gespült (Abb. 1A). Nach der Inaktivierung von NaOCl mit 5% Natriumthiosulfat wurde die P1S2-Probe wie oben beschrieben entnommen, und die Zähne jeder Gruppe wurden entweder PUI oder XP-Endo Finisher ergänzenden Verfahren unterzogen, wie folgt.
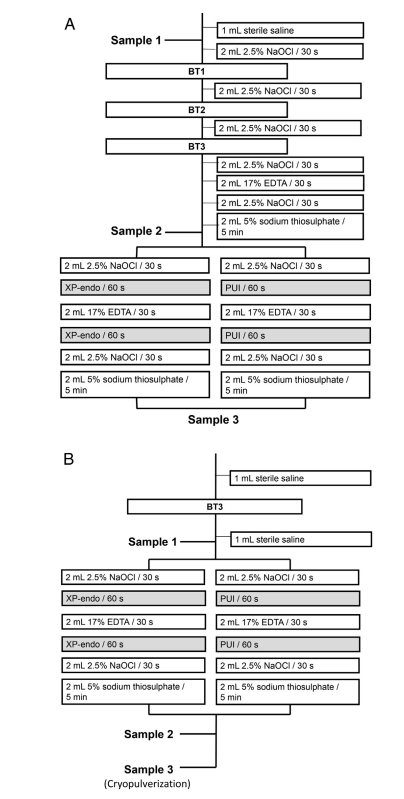
PUI.
Wurzelkanäle wurden mit 2 mL 2,5% NaOCl gespült, das im Kanal 1 Minute lang ultrasonisch aktiviert wurde, indem das EndoUltra-Gerät (Vista Dental Products, Racine, WI) verwendet wurde, wobei die Sondenspitze 1 mm vor dem WL platziert wurde. Die Kanäle wurden mit 2 mL EDTA gespült, das auf die gleiche Weise wie oben ultrasonisch aktiviert wurde, gefolgt von einer abschließenden Spülung mit 2,5% NaOCl. Schließlich wurde NaOCl mit 2 mL 5% Natriumthiosulfat inaktiviert, und die P1S3-Probe wurde entnommen.
XP-Endo Finisher Instrument.
XP-Endo Finisher wurde bis zur WL für 1 Minute nach der Spülung mit 2 mL 2,5% NaOCl betrieben. Das Instrument wurde mit dem VDW Gold Motor bei 800 U/min, 1 N • cm, mit langsamen Auf- und Abwärtsbewegungen von 7 bis 8 mm Länge gekoppelt. Die Wurzelkanäle wurden dann mit 17% EDTA gespült, und XP-Endo wurde erneut verwendet. Nach den abschließenden Spülungen mit 2,5% NaOCl und Natriumthiosulfat wurde eine P1S3 Probe entnommen.
Das gleiche Endvolumen an Spüllösungen wurde pro Gruppe verwendet, mit 14 mL NaOCl pro Kanal. In beiden Gruppen wurden die Spüllösungen auf 37◦C für die intrakanalären Verfahren vorgeheizt, die bei 37◦C in einem Schrank mit einem Heizgerät (800-Heater; PlasLabs, Lansing, MI) durchgeführt wurden.
Die Proben wurden autoklaviert und einem neuen Mikro-CT-Scan unterzogen, wobei die oben genannten Parameter verwendet wurden. Präoperative und postoperative farbcodierte 3D-Modelle der mesialen Kanäle wurden erstellt (CTVol v.2.2.1; Bruker-microCT) und mit ihren jeweiligen präoperativen Datensätzen (grün und rot zeigen präoperative und postoperative Kanaloberflächen an) unter Verwendung des starren Registrierungsmoduls der 3D Slicer 4.3.1 Software (verfügbar unter http://www.slicer.org) mit einer Genauigkeit von mehr als 1 Voxel co-registriert. Anschließend wurden die übereinstimmenden Bilder untersucht, um das Volumen (mm3) und die Oberfläche (mm2) des mesialen Wurzelkanalsystems vor und nach der Präparation mit der CTAn v.1.14.4 Software (Bruker micro-CT) zu berechnen. Die Fläche der unberührten Kanaloberfläche wurde bestimmt, indem die Anzahl der statischen Voxel berechnet und als Prozentsatz der Gesamtzahl der auf der Kanaloberfläche vorhandenen Voxel ausgedrückt wurde.
Phase 2
Die gleichen Zahnproben aus Phase 1 wurden in der zweiten Phase des Experiments verwendet. Achtzehn Zähne waren noch verfügbar. Diese zweite Phase wurde durchgeführt, um die Anzahl der Zähne mit Kanälen, die positiv auf Bakterien getestet wurden, vor der Anwendung der ergänzenden Ansätze zu erhöhen, was einen robusteren statistischen Vergleich ermöglichte. Darüber hinaus war es möglich, beide Ansätze gegen kontrolliertere anfängliche bakterielle Lasten zu testen. Schließlich wurde die Bewertung der Auswirkungen des isolierten ergänzenden Ansatzes auf die Isthmusbereiche in dieses zweite Experiment einbezogen.
Die Zähne wurden im Autoklaven sterilisiert, kontaminiert und wie in Phase 1 beschrieben montiert. Anschließend wurden die Wurzelkanäle mit 1 mL Kochsalzlösung gespült und erneut mit einem BT3-Instrument instrumentiert, um die anfängliche bakterielle Last leicht zu reduzieren. P2S1 wurde wie in Phase 1 entnommen. Jeder Kanal wurde mit 2 mL 2,5% NaOCl irrigiert, und entweder das XP-Endo Finisher-Instrument oder PUI wurde wie zuvor beschrieben verwendet (Abb. 1B). Nach der Spülung mit EDTA wurden die ergänzenden Ansätze erneut durchgeführt, und dann wurde der Kanal mit NaOCl und Natriumthiosulfat irrigiert. Die P2S2-Probe wurde entnommen.
Auf der Grundlage der Mikro-CT-Bilder des Querschnitts des Wurzelkanals wurde die Position des Isthmus im mesialen Wurzelbereich festgestellt, und die Proben wurden mit sterilen doppelseitigen Diamantscheiben abgeschnitten, um Wurzelstücke mit Isthmus für die Analyse zu erzeugen. Die distalen Wurzeln hatten einen einzigen flachen Kanal mit Vertiefungen und wurden 5 mm vom Apex entfernt sectioniert. Die Wurzelstücke, die dem Isthmusbereich der mesialen Wurzel und dem apikalen Teil der distalen Wurzel entsprachen, hatten ihre äußeren Oberflächen mit 3% Wasserstoffperoxid gereinigt und mit 2,5% NaOCl desinfiziert, das anschließend mit Natriumthiosulfat inaktiviert wurde. In der Folge wurden die äußeren Wurzeloberflächen mit einem #80 sterilen Papierpunkt, der mit Tris-EDTA-Puffer befeuchtet war, entnommen. Diese Probe diente als Sterilitätskontrolle und wurde mittels einer quantitativen Echtzeit-Polymerase-Kettenreaktion (qPCR) bewertet. Diese Desinfektions- und Kontrollentnahmeverfahren wurden unter einem Operationsmikroskop durchgeführt. Ein 6750-Freimahlwerk (Spex, Metuchen, NJ), das bei flüssigem Stickstofftemperatur betrieben wurde, wurde verwendet, um jedes Wurzelstück kryogen zu mahlen, wie an anderer Stelle beschrieben. Nach dem Mahlen wurden apikale Wurzelpulverproben (P2S3) in Tris-EDTA-Puffer suspendiert und bei –20◦C gelagert.
DNA-Extraktion und qPCR-Assay
DNA wurde aus den Proben beider experimenteller Phasen extrahiert und als Vorlage zur Quantifizierung von E. faecalis-Zellen mittels eines 16S rRNA-Gen-gezielten qPCR-Assays verwendet. Die Schritte zur DNA-Extraktion und qPCR, Kontrollen und Bedingungen wurden wie zuvor beschrieben durchgeführt. Alle Messungen wurden dreifach durchgeführt.
Statistische Analyse
Der Wilcoxon-Test für gepaarte Stichproben wurde verwendet, um die intragruppenspezifische Reduktion der Bakterienzahlen von P1S1/P2S1 zu P1S2/P2S2, von P1S1/P2S1 zu P1S3/P2S3 und von P1S2/P2S2 zu P1S3/P2S3 zu vergleichen. Die Ausgangsproben (P1S1/P2S1) wurden zwischen den Gruppen mit dem nichtparametrischen Mann-Whitney U-Test verglichen, der keinen signifikanten Unterschied zwischen ihnen ergab (P> .05). Daher wurde derselbe Test verwendet, um die Zählungen in den Proben P1S2/P2S2 und P1S3/P2S3 zwischen den Gruppen zu vergleichen. Zunächst wurden die Analysen für mesiale und distale Wurzeln separat durchgeführt. Da es keine signifikanten Unterschiede zwischen mesialen und distalen Kanälen gab, wurden die Daten auch gesammelt, um die Robustheit der statistischen Analyse zu erhöhen. Die Pearson-Korrelationsanalyse wurde verwendet, um die Beziehungen zwischen der bakteriellen Reduktion und dem Prozentsatz der unvorbereiteten Bereiche zu überprüfen. Statistische Analysen wurden mit STATISTICA Version 8 (StatSoft, Tulsa, OK) durchgeführt, wobei das Signifikanzniveau auf 5 % festgelegt wurde.
Ergebnisse
Die SEM-Analyse ergab, dass E. faecalis die Wände des Wurzelkanals kolonisierte und im Allgemeinen biofilmähnliche Strukturen bildete (Daten nicht gezeigt). Die Kolonisation des Wurzelkanals wurde durch positive qPCR-Ergebnisse in den P1S1/P2S1-Proben aller Zähne weiter bestätigt.
Phase 1
Tabelle 1 zeigt die Mittelwerte, Mediane und Bereiche der beobachteten E. faecalis Zahlen für die Testgruppen. In der XP-Endo Finisher-Gruppe wurden die E. faecalis Zahlen von P1S1 auf P1S2 erheblich reduziert (P < .001). Nach der Verwendung des XP-Endo-Instruments (P1S3) gab es eine zusätzliche signifikante Reduktion (P < .05). Alle 20 Proben waren in P1S1 positiv für E. faecalis , 6 in P1S2 und 6 in P1S3. In der PUI-Gruppe waren die anfänglichen bakteriellen Zählungen (P1S1) ebenfalls signifikant nach der Vorbereitung (P1S2) reduziert (P < .001). Obwohl die bakteriellen Zählungen in P1S3 weiter reduziert wurden, waren sie nicht signifikant unterschiedlich von P1S2 (P > .05). Alle 20 Proben waren in P1S1 positiv, 10 in P1S2 und 7 in P1S3. Es wurden keine signifikanten Unterschiede festgestellt, als P1S3 der XP-Endo- und PUI-Gruppen verglichen wurde (P > .05).

Die statistische Analyse der mesialen und distalen Daten zeigte separat für alle Vergleiche zwischen P1S2 und P1S3 keine signifikante Abweichung (P > .05), mit Ausnahme der mesialen Kanäle in der XP-Endo Finisher-Gruppe (P < .05). Die Daten der mesialen und distalen Wurzeln sind separat in der ergänzenden Tabelle S1 dargestellt.
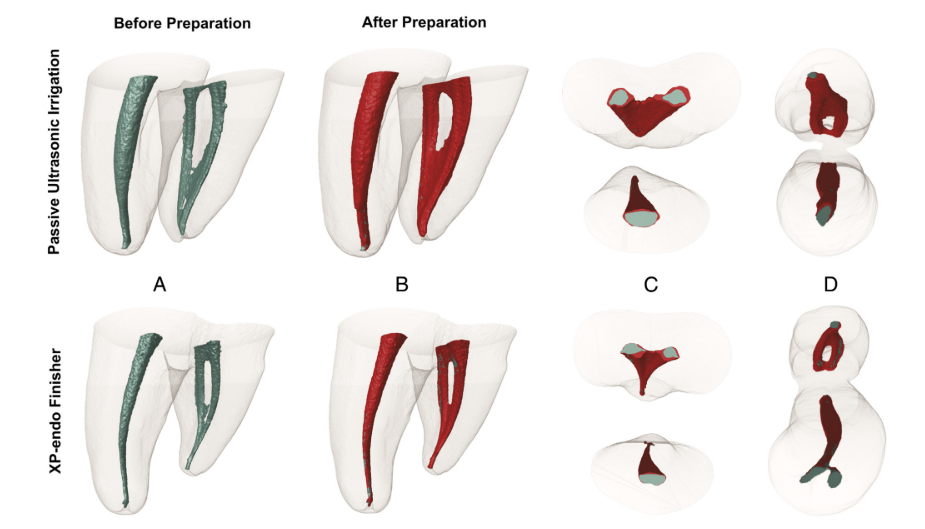
Die Mikro-CT-Analyse zeigte keine signifikanten Unterschiede in den anfänglichen Kanalvolumina zwischen den Gruppen (P > .05). Was die unvorbereiteten Bereiche betrifft, wurde ein durchschnittlicher Prozentsatz von statischen Voxel von 4,5 % (Median, 4,3 %) für die XP-Endo Finisher-Gruppe und 4,3 % (Median, 5,4 %) für die PUI-Gruppe beobachtet (P > .05) (Abb. 2). Die korrelative Analyse ergab keine statistisch signifikante Beziehung zwischen der bakteriellen Reduktion und dem Prozentsatz der unvorbereiteten Bereiche (P > .05).
Phase 2
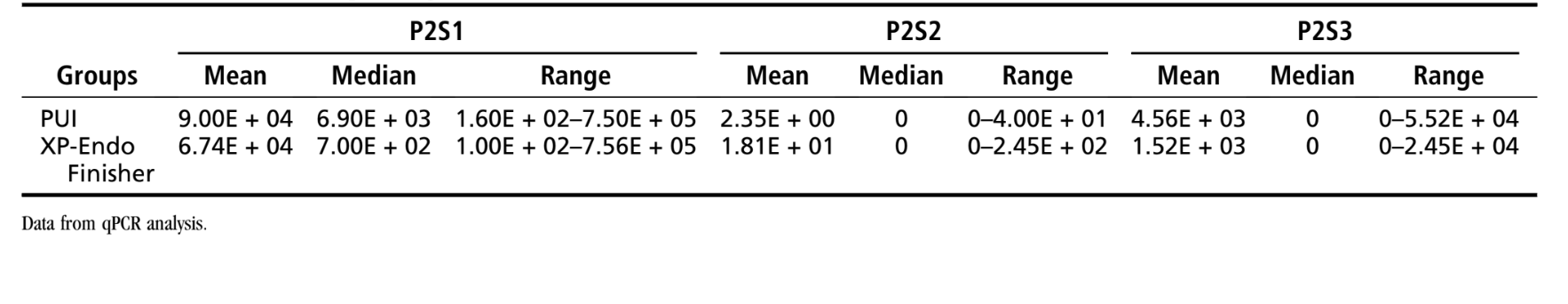
Tabelle 2 zeigt die quantitativen Daten aus Phase 2. In der XP-Endo Finisher-Gruppe wurden die E. faecalis-Zahlen in P2S1 nach Verwendung dieses Instruments signifikant reduziert (P< .001). Alle 18 Proben waren in P2S1 positiv auf Bakterien, 2 in P2S2 und 4 in P2S3 (pulverisierte Proben). Das PUI-Verfahren war ebenfalls sehr effektiv bei der Reduzierung der Bakterienzahlen im Hauptkanal (P< .001). Alle 18 Proben waren in P2S1 positiv auf Bakterien, 1 in P2S2 und 6 in P2S3 (pulverisierte Proben). Es wurden keine signifikanten Unterschiede beobachtet, als die Effekte von XP-Endo und PUI in P2S2 (Hauptkanäle) oder P2S3 (Isthmus/Recessus) verglichen wurden (P> .05). Die statistische Analyse der mesialen und distalen Daten separat zeigte ebenfalls keine signifikanten Unterschiede zwischen den Gruppen (P> .05) (Zusätzliche Tabelle S2).
Diskussion
Diese Studie korrelierte verschiedene analytische Werkzeuge, um in 2 experimentellen Phasen die antibakteriellen Effekte von ergänzenden Ansätzen im Wurzelkanalsystem der mandibulären Molaren zu bewerten. In der ersten Phase wurden die Effekte der 2 Verfahren, die unmittelbar nach der chemomechanischen Aufbereitung mit rotierender NiTi-Instrumentierung und NaOCl-Spülung angewendet wurden, bewertet. Diese Analyse beschränkte sich auf die antibakteriellen Effekte im Hauptwurzelkanal, wie durch Papierpunktentnahme bestimmt. Da 50 % (PUI-Gruppe) und 70 % (XP-Endo Finisher-Gruppe) der Fälle negative Ergebnisse für Bakterien in P1S2 zeigten, wurde die Stichprobengröße für die intergruppale Analyse von P1S3 reduziert, und eine zweite Phase wurde entworfen, um die Anzahl der Kanäle, die beiden Ansätzen unterzogen wurden, zu erhöhen und die Analyse ihrer Effekte nicht nur in den Hauptkanälen, sondern auch in den Isthmus- und Recess-Bereichen durch kryogenes Schleifen der Wurzel zur Probenentnahme einzuschließen.
In der ersten Phase förderte die chemomechanische Instrumentierung mit BT RaCe und NaOCl-Spülung eine erhebliche bakterielle Eliminierung in beiden Gruppen, was mit früheren Studien übereinstimmt. Während der zusätzliche Verfahrensschritt mit PUI nicht erfolgreich war, die Bakterienzahlen signifikant weiter zu reduzieren, waren die intrakanal E. faecalis-Zahlen nach der Anwendung des XP-Endo Finishers signifikant niedriger als die unmittelbar nach der Aufbereitung erhaltenen. Die signifikant besseren Ergebnisse für XP-Endo traten in den mesialen Wurzeln auf. In der zweiten Phase bestanden die anfänglichen Proben aus einer anfänglich niedrigeren bakteriellen Belastung, um den Vergleich beider Ansätze mit bakteriellen Zahlen zu ermöglichen, die mit dem, was die ergänzenden Verfahren in der klinischen Situation erwarten müssen, kompatibel sind. In dieser Phase waren die Ansätze PUI und XP-Endo Finisher ähnlich und hochwirksam bei der Reduzierung der Bakterienzahlen im Hauptkanal.
Was die Isthmus-/Rezessbereiche betrifft, erlaubte die destruktive Natur des Kryopulverisierungsansatzes keine longitudinale Analyse. Daher ist es nicht möglich zu schließen, ob negative Ergebnisse auf die Auswirkungen der ergänzenden Ansätze oder auf eine erfolglose bakterielle Kontamination in diesen Bereichen zurückzuführen sind. Es gab jedoch keine signifikanten Unterschiede in den bakteriellen Zählungen zwischen den Gruppen. Die Zählungen im Isthmusbereich (P2S3) waren tatsächlich höher als im Hauptkanal (P2S2), was darauf hindeutet, dass die Auswirkungen von PUI und XP-Endo Finisher in diesem Bereich nicht vorhersehbar sind. Dies zusammen mit den Ergebnissen mehrerer Zähne mit kanal-negativen und isthmus-positiven Proben hebt die Einschränkung des Papierpunktansatzes bei der Probenahme des Wurzelkanalsystems hervor.
Die Gesamtergebnisse für das XP-Endo Finisher-Instrument waren ermutigend, da es im Allgemeinen vergleichbar mit PUI, einem weithin empfohlenen ergänzenden Ansatz, abschnitt. In einer aktuellen Studie war das XP-Endo Finisher-Instrument effizienter als andere Techniken bei der Desinfektion des Hauptkanalraums. Das Design und die helikale Bewegung des Instruments könnten es ihm ermöglicht haben, zuvor unberührte Bereiche zu erreichen und bakterielle Biofilme zu verdrängen. Der Anstieg der berührten Bereiche wurde aufgrund der minimalen, wenn überhaupt, Schneidfähigkeit des XP-Endo Finisher-Instruments nicht durch Mikro-CT bewertet.
Unsere Ergebnisse mit PUI stimmen mit mehreren Studien überein, die keinen signifikanten Verbesserungen der Desinfektion nach der Präparation berichteten. Die antibakteriellen Effekte von PUI werden als mit Kavitation, akustischem Streaming und Erwärmung des Spülmittels verbunden angesehen, aber wenn diese Phänomene tatsächlich im Wurzelkanal auftreten, scheinen sie nicht auszureichen, um die bakterielle Eliminierung signifikant zu verbessern.
Es gab keine Korrelation zwischen dem Prozentsatz der unpräparierten Bereiche und den bakteriellen Werten in P1S3, was mit einer früheren Studie übereinstimmt. Es besteht die Möglichkeit, dass in einigen Proben die unberührten Bereiche des Hauptkanals möglicherweise nicht von Bakterien kolonisiert wurden. Darüber hinaus ist es möglich, dass uninstrumentierte Bereiche tatsächlich durch NaOCl-Spülung desinfiziert wurden. Einschränkungen des Stichprobenverfahrens der Studie könnten ebenfalls für diesen Mangel an Korrelation verantwortlich sein.
Das vorliegende experimentelle Design weist einige bemerkenswerte Aspekte auf. Mikrotom-CT-Scans wurden verwendet, um die Zähne nach anatomischen Ähnlichkeiten auszuwählen und abzugleichen, bevor sie zwischen den Gruppen verteilt wurden, um Variablen, die der Anatomie innewohnen, zu minimieren. Darüber hinaus wurden während der gesamten Experimente erhitzte Spülmittel verwendet. Dies musste geschehen, da das XP-Endo Finisher-Instrument bei Körpertemperatur eine Phasentransformation durchläuft. Daher entschieden wir uns, in allen Phasen des Experiments erwärmte Lösungen einzubeziehen, das auch in einem Schrank mit einer Temperatur von 37◦C durchgeführt wurde. Die meisten früheren Studien an extrahierten Zähnen wurden bei Raumtemperatur durchgeführt. Da die Temperatur die antibakterielle Aktivität von NaOCl beeinflussen kann, ist es ratsam, antibakterielle Tests unter einer Temperatur durchzuführen, die der Körpertemperatur ähnlich ist. Ein weiterer Vorteil dieser Studie war die Verwendung von qPCR zur quantitativen Bestimmung von Bakterien. Dieser Ansatz ist sehr empfindlich und könnte zuverlässig in kryopulverisierten Proben verwendet werden (Pilotstudien, die Kultur verwendeten, zeigten einen Verlust der bakteriellen Zählungen aufgrund des Mahlansatzes). Die Verwendung von Kryopulverisation war wiederum entscheidend, um die Analyse der antibakteriellen Effekte der getesteten Ansätze in Bereichen wie Isthmus und Vertiefungen zu ermöglichen, die möglicherweise nicht ordnungsgemäß mit Papierpunkten beprobt werden können.
Obwohl diese Studie innovativ ist, da sie verschiedene analytische Ansätze kombiniert, hat sie auch Einschränkungen. Die Probenentnahme mit Papierpunkten ist normalerweise auf den Hauptkanal beschränkt, und einige Bereiche wie Unregelmäßigkeiten, Isthmus und Vertiefungen können möglicherweise nicht beprobt werden. Die Einschränkung der Papierpunkttechnik war in Phase 2 offensichtlich, als mehr Kanäle in P2S3 positiv auf Bakterien waren als in P2S2; auch höhere durchschnittliche Zählungen wurden für P2S3 gezeigt. Darüber hinaus bleibt unklar, in welchem Teil des Hauptkanals Bakterien verblieben, da die Probenentnahme mit Papierpunkten das Segment des Hauptkanals nicht unterscheidet. Die Kryopulverisation kann diese Einschränkungen umgehen, ist jedoch eine destruktive Methode und kann nur für die Querschnittsanalyse verwendet werden. Eine weitere Einschränkung könnte sich auf die Verwendung von qPCR zur bakteriellen Detektion beziehen. Es besteht die Sorge, dass DNA von Zellen, die kürzlich infolge einer antibakteriellen Behandlung gestorben sind, ebenfalls mit dieser Methode nachgewiesen werden kann. Dennoch zeigte eine frühere Studie, die ein ähnliches in vitro Protokoll verwendete, keinen signifikanten Unterschied bei den bakteriellen Zählungen zwischen Kultur und qPCR in Nachbehandlungsproben. Dies, zusammen mit der hohen Häufigkeit negativer qPCR-Ergebnisse in Nachbehandlungsproben, deutet stark darauf hin, dass DNA von toten Zellen in der vorliegenden Studie möglicherweise kein signifikantes Problem darstellte. Freie DNA kann durch NaOCl abgebaut oder während der Spülung weggespült worden sein.
Zusammenfassend hat diese Studie gezeigt, dass beide ergänzenden Ansätze eine geringe Reduktion der Bakterienzahlen nach chemomechanischer Aufbereitung bewirkten, die nur für den XP-Endo Finisher signifikant war. Weder XP-Endo noch PUI waren effektiv darin, die Isthmus-/Rezessbereiche der mandibulären Molaren vorhersehbar zu desinfizieren.
Autoren: Flavio R.F. Alves, Carlos V. Andrade-Junior, Marília F. Marceliano-Alves, Alejandro R. Perez, Isabela N. Rôças, Marco A. Versiani, Manoel D. Sousa-Neto, Jose C. Provenzano, Jose F. Siqueira
Referenzen:
- Siqueira JF Jr, Araujo MC, Garcia PF, et al. Histologische Bewertung der Effektivität von fünf Instrumentierungstechniken zur Reinigung des apikalen Drittels von Wurzelkanälen. J Endod 1997;23:499–502.
- Peters OA, Schönenberger K, Laib A. Auswirkungen von vier Ni-Ti-Präparationstechniken auf die Geometrie von Wurzelkanälen, bewertet durch Mikro-Computertomographie. Int Endod J 2001;34: 221–30.
- Vera J, Siqueira JF Jr, Ricucci D, et al. Ein- versus Zweitbesuch endodontische Behandlung von Zähnen mit apikaler Parodontitis: eine histobakteriologische Studie. J Endod 2012;38: 1040–52.
- Paqué F, Zehnder M, De-Deus G. Mikrotomographie-basierter Vergleich der reziproken Einzelfile F2 ProTaper-Technik versus rotierender Vollsequenz. J Endod 2011; 37:1394–7.
- Markvart M, Darvann TA, Larsen P, et al. Mikro-CT-Analysen der apikalen Erweiterung und der Komplexität von Wurzelkanälen bei Molaren. Int Endod J 2012;45:273–81.
- Siqueira JF Jr, Alves FR, Versiani MA, et al. Korrelation zwischen bakteriologischer und mikro-Computertomographie-Analyse der mesialen Kanäle mandibulärer Molaren, die mit selbstjustierenden Feilen, Reciproc- und Twisted-File-Systemen aufbereitet wurden. J Endod 2013;39:1044–50.
- Peters OA, Arias A, Paque F. Eine mikro-Computertomographie-Bewertung der Wurzelkanalpräparation mit einem neuartigen Instrument, TRUShape, in mesialen Wurzeln von mandibulären Molaren. J Endod 2015;41:1545–50.
- Ricucci D, Siqueira JF Jr. Biofilme und apikale Parodontitis: Studie zur Prävalenz und Assoziation mit klinischen und histopathologischen Befunden. J Endod 2010;36:1277–88.
- Ricucci D, Siqueira JF Jr, Bate AL, Pitt Ford TR. Histologische Untersuchung von Wurzelkanal-behandelten Zähnen mit apikaler Parodontitis: eine retrospektive Studie von vierundzwanzig Patienten. J Endod 2009;35:493–502.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Ergänzung der antimikrobiellen Effekte der chemomechanischen Debridement mit entweder passiver ultraschallgestützter Bewässerung oder einer abschließenden Spülung mit Chlorhexidin: eine klinische Studie. J Endod 2012;38:1202–6.
- Byström A. Bewertung der endodontischen Behandlung von Zähnen mit apikaler Parodontitis [odontologische Dissertation Nr. 27]. Umea, Schweden: Universität Umea; 1986.
- Vianna ME, Horz HP, Gomes BP, Conrads G. In-vivo-Bewertung der mikrobiellen Reduktion nach chemo-mechanischer Aufbereitung von menschlichen Wurzelkanälen mit nekrotischem Pulpa-Gewebe. Int Endod J 2006;39:484–92.
- Sjögren U. Erfolg und Misserfolg in der Endodontie [odontologische Dissertation Nr. 60]. Umea, Schweden: Universität Umea; 1996.
- Neves MA, Provenzano JC, Rôças IN, Siqueira JF Jr. Klinische antibakterielle Effektivität der Wurzelkanalpräparation mit reziprokem Einzelinstrument oder kontinuierlich rotierenden Multi-Instrumenten-Systemen. J Endod 2016;42:25–9.
- Siqueira JF Jr, Rôças IN. Klinische Implikationen und Mikrobiologie der bakteriellen Persistenz nach Behandlungsverfahren. J Endod 2008;34:1291–13013.
- Siqueira JF Jr, Rôças IN. Optimierung der Desinfektion bei einmaligem Besuch mit ergänzenden Ansätzen: eine Suche nach Vorhersehbarkeit. Aust Endod J 2011;37:92–8.
- Alves FR, Almeida BM, Neves MA, et al. Desinfektion ovaler Wurzelkanäle: Effektivität verschiedener ergänzender Ansätze. J Endod 2011;37:496–501.
- Tardivo D, Pommel L, La Scola B, et al. Antibakterielle Effizienz der passiven Ultraschall- versus Schallbewässerung: Ultraschall-Wurzelkanalbewässerung. Odontostomatol Trop 2010;33:29–35.
- Carver K, Nusstein J, Reader A, Beck M. In-vivo-antibakterielle Wirksamkeit von Ultraschall nach Hand- und Rotationsinstrumentierung in menschlichen mandibulären Molaren. J Endod 2007; 33:1038–43.
- Paiva SS, Siqueira JF Jr, Rôças IN, et al. Molekularmikrobiologische Bewertung der passiven ultraschallgestützten Aktivierung als ergänzenden Desinfektionsschritt: eine klinische Studie. J Endod 2013;39:190–4.
- Debelian G, Trope M. Reinigung der dritten Dimension. Endodontic Practice 2015;8: 22–4.
- Leoni GB, Versiani MA, Silva-Sousa YT, et al. Ex-vivo-Bewertung von vier abschließenden Bewässerungsprotokollen zur Entfernung von Hartgewebetrümmern aus dem mesialen Wurzelkanalsystem von mandibulären ersten Molaren. Int Endod J 2016 Mar 18. http://dx.doi.org/ 10.1111/iej.12630. [Epub ahead of print].
- Azim AA, Aksel H, Zhuang T, et al. Wirksamkeit von 4 Bewässerungsprotokollen zur Abtötung von Bakterien, die in dentinalen Tubuli kolonisiert sind, untersucht durch eine neuartige konfokale Laserscanning-Mikroskopanalyse. J Endod 2016;42:928–34.
- Siqueira JF Jr, Alves FR, Almeida BM, et al. Fähigkeit der chemomechanischen Aufbereitung mit entweder rotierenden Instrumenten oder selbstjustierenden Feilen, ovale Wurzelkanäle zu desinfizieren. J Endod 2010;36:1860–5.
- Alves FR, Siqueira JF Jr, Carmo FL, et al. Profiling der bakteriellen Gemeinschaft von kryogenisch gemahlenen Proben aus den apikalen und koronalen Wurzelsegmenten von Zähnen mit apikaler Parodontitis. J Endod 2009;35:486–92.
- Antunes HS, Rôças IN, Alves FR, Siqueira JF Jr. Gesamt- und spezifische Bakterienniveaus im apikalen Wurzelkanalsystem von Zähnen mit postbehandelter apikaler Parodontitis. J Endod 2015;41:1037–42.
- Alves FR, Rôças IN, Almeida BM, et al. Quantitative molekulare und kulturbasierte Analysen der bakteriellen Eliminierung in ovalen Wurzelkanälen durch eine Einzelfile-Instrumentierungstechnik. Int Endod J 2012;45:871–7.
- van der Sluis LW, Versluis M, Wu MK, Wesselink PR. Passive ultraschallgestützte Bewässerung des Wurzelkanals: eine Literaturübersicht. Int Endod J 2007;40:415–26.
- Martin H. Ultraschall-Desinfektion des Wurzelkanals. Oral Surg Oral Med Oral Pathol 1976;42:92–9.
- Ahmad M, Pitt Ford TR, Crum LA. Ultraschall-Debridement von Wurzelkanälen: ein Einblick in die beteiligten Mechanismen. J Endod 1987;13:93–101.
- Sirtes G, Waltimo T, Schaetzle M, Zehnder M. Die Auswirkungen der Temperatur auf die kurzzeitige Stabilität von Natriumhypochlorit, die Fähigkeit zur Pulpaauflösung und die antimikrobielle Wirksamkeit. J Endod 2005;31:669–71.
- Siqueira JF Jr, Rôças IN. Ausnutzung molekularer Methoden zur Erforschung endodontischer Infektionen: Teil 1—aktuelle molekulare Technologien für die mikrobiologische Diagnose. J Endod 2005;31:411–23.
- McCarty SC, Atlas RM. Einfluss der Amplicon-Größe auf die PCR-Detektion von Bakterien, die Chlor ausgesetzt sind. PCR Methods Appl 1993;3:181–5.
- Fouad AF, Barry J. Der Einfluss von Antibiotika und endodontischen Antimikrobiotika auf die Polymerase-Kettenreaktion. J Endod 2005;31:510–3.
/social-network-service/media/default/6758/89a8282e.png)