Mikro-Computertomographische Analyse der mesialen Wurzel von mandibularen ersten Molaren mit bifidem Apex
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziele: Das Ziel der vorliegenden Studie war es, den Einfluss von bifiden und nicht-bifiden Konfigurationen der mesialen Wurzel der mandibularen ersten Molaren auf die Kanal-Anatomie mittels Mikro-Computertomographie (Mikro-CT) zu bewerten.
Design: Dreißig mesiale Wurzeln mit bifidem Apex wurden mittels Mikro-CT mit 30 nicht-bifiden Wurzeln paarweise verglichen. Bifide und nicht-bifide mesiale Wurzeln wurden hinsichtlich morphologischer Aspekte im apikalen Drittel, Dentin-Dicke und das Vorhandensein von Isthmus und mittlerem mesialen Kanal (MMC) verglichen. Die Daten wurden mit dem Chi-Quadrat-Test und dem Student’s t-Test bei einem signifikanten Niveau von 5 % analysiert.
Ergebnisse: Der Hauptforamen der mesiobuccalen (MB) und mesiolingualen (ML) Kanäle befand sich innerhalb von 2,5 mm vom anatomischen Apex, und der Ursprung sowie der Ausgang der zusätzlichen Kanäle wurden überwiegend zwischen 1,0 und 2,0 mm vom Apex in den Gruppen beobachtet. Trotz dass kein statistischer Unterschied zwischen bifiden und nicht-bifiden Wurzeln hinsichtlich der Anzahl der Kanalöffnungen (p > 0,05) festgestellt wurde, war die Häufigkeit zusätzlicher Kanäle in bifiden Wurzeln signifikant höher (p < 0,05). Bezüglich der Dentin-Dicke wurde ein statistisch signifikanter Unterschied zwischen bifiden und nicht-bifiden Wurzeln auf der Furkationshöhe beobachtet (p < 0,05). Nur 3 mesiale Wurzeln mit bifidem Apex (10 %) hatten Isthmus, überwiegend im koronalen Drittel, während eine hohe Inzidenz von MMC in dieser Gruppe beobachtet wurde (n = 10, 33,3 %).
Fazit: Das Vorhandensein eines bifiden Apex im mesialen Wurzelbereich der mandibulären ersten Molaren könnte ein prädiktiver Faktor für eine komplexe Kanalanatomie im apikalen Drittel mit einer zunehmenden Anzahl von Accessorkanälen sein.
Einleitung
Mandibuläre erste Molaren sind die am häufigsten endodontisch behandelten Zähne (Wayman, Patten, & Dazey, 1994). Dieser Zahn hat normalerweise zwei Wurzeln, eine mesiale und eine distale, die an der Spitze weit voneinander getrennt sind. Die mesiale Wurzel weist häufig eine komplexe Kanalstruktur auf, mit Isthmusverbindungen, Verzweigungen, Vertiefungen und Accessorkanälen (Villas-Bôas et al., 2011). Diese Komplexität hat sich als problematisch für die chemomechanischen Protokolle zur Desinfektion des Wurzelkanals erwiesen, da Instrumente und antibakterielle Lösungen nicht in der Lage sind, unzugängliche Bereiche des Wurzelkanalsystems zu erreichen (Alves et al., 2016). Folglich muss in infizierten Kanälen die mikrobiologische Belastung in zusätzlichen Anatomien während der Vorbereitungsverfahren ordnungsgemäß reduziert werden, da persistierende Bakterien das Behandlungsergebnis gefährden können (Costa et al., 2019).
Im Jahr 1981 schlug Turner vor, dass die multiple Wurzelanzahl der maxillären ersten Prämolaren auf der Grundlage der Wurzelbifurkation definiert werden könnte, und verwendete den Begriff „bifid-spitz“, um ein beginnendes zweiwurzeliges Erscheinungsbild zu beschreiben, das in dieser Gruppe von Zähnen beobachtet wurde (Turner, 1981). Laut ihm hatte diese neue Nomenklatur eine erhebliche biologische Bedeutung, da mehr anatomische Variationen im Bereich zwischen der Spitze und dem nächsten Drittel des Zahns beobachtet werden konnten als über das erste Drittel des Zahns von der Spitze aus. Später beschrieben Kupczik und Hublin (2010) in einer anthropologischen Studie von Homo sapiens aus Nordwestafrika das Vorhandensein von bifid-spitzen mesialen Wurzeln in mandibularen Molaren. Die Autoren erklärten, dass Unterschiede in der externen Wurzelmorphologie dieser Gruppe von Zähnen mit unterschiedlichen okklusalen Belastungsregimen in Verbindung gebracht wurden und dass Variationen in ihrer internen Wurzelstruktur bisher noch nicht präzise quantifiziert wurden (Kupczik & Hublin, 2010). Kürzlich zeigte eine mikro-computertomographische (Mikro-CT) Studie, dass die apikale Form der mesiobuccalen Wurzel der maxillären ersten Molaren einen erheblichen Einfluss auf die Komplexität des Wurzelkanalsystems hatte (Ordinola-Zapata, Martins, Niemczyk, & Bramante, 2019). Obwohl die Anatomie der mesialen Wurzel der mandibularen ersten Molaren in der Literatur eingehend untersucht wurde (Keleş & Keskin, 2017a, 2018, Villas-Bôas et al., 2011), hat bis heute keine Studie verschiedene morphologische Aspekte dieser Wurzel mit ihrer internen Anatomie korreliert. Daher war das Ziel dieser Studie, den Einfluss von bifid und nicht-bifid apikalen Konfigurationen der mesialen Wurzel der mandibularen ersten Molaren auf die Kanal-Anatomie unter Verwendung eines Mikro-CT-Bildgebungssystems zu bewerten.
Materialien und Methoden
Auswahl der Proben und Bildgebung
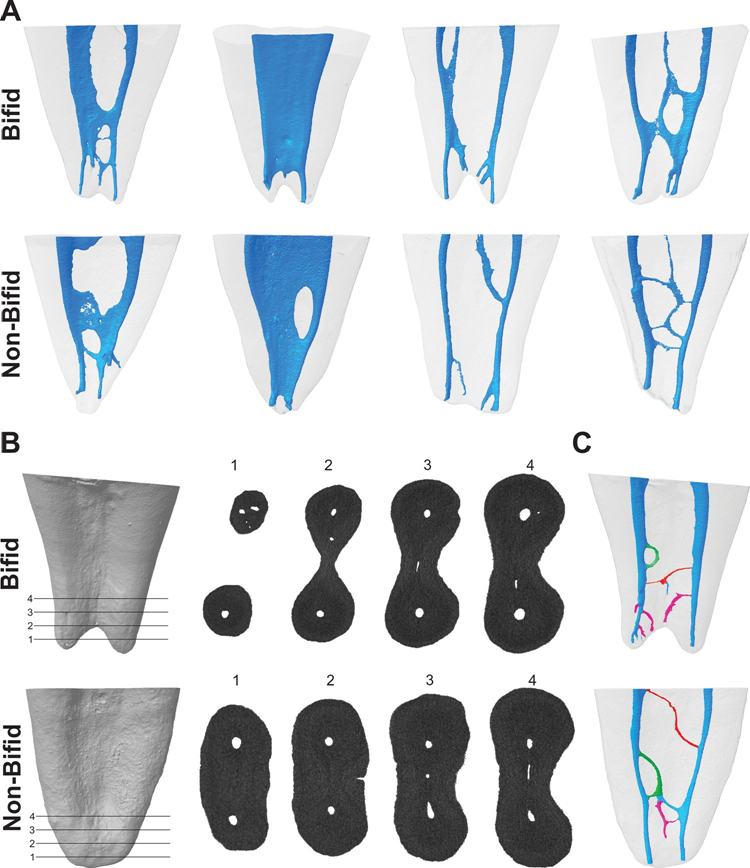
Nach Genehmigung durch das lokale Ethikkomitee (Protokoll 2013/145) wurden 250 zweirootige mandibuläre erste Molaren ohne Restauration, Karies, Frakturen oder unreife Wurzeln aus der türkischen Bevölkerung gesammelt und mit einem Mikro-CT-Scanner (SkyScan 1172; Bruker-microCT, Kontich, Belgien) bei 100 μA, 100 kV, 180° Rotation mit einem Schritt von 0,4°, einem Rahmenmittelwert von 3 und einer Belichtungsdauer von 1400 Millisekunden bildlich erfasst (Pixelgröße von 10 μm). Die Daten wurden mit NRecon v. 1.7.4.2 Software (Bruker-microCT) rekonstruiert, wobei Ringartefakte (5), Strahlhärtung (45 %) und Glättung (2) Korrekturen unter Verwendung eines Dämpfungskoeffizienten von 0 bis 0,06 angewendet wurden. Dreidimensionale Modelle des mesialen Wurzelkanalsystems wurden mit CTAn v.1.18.8 Software (Bruker-microCT) erstellt und qualitativ mit CTVol v. 2.3.2.0 Software (Bruker-microCT) bewertet. Entsprechend der Wurzelänge und dem Typ der Kanalstruktur wurden dreißig Proben mit bifid-spitzen mesialen Wurzeln ausgewählt und paarweise mit 30 nicht-bifid (einspitzig mit stumpfer oder konischer Form) mesialen Wurzeln verglichen (Abb. 1A). Die Stichprobengröße für diese Studie wurde anhand der Effektstärkeberechnung der Ergebnisse einer vorherigen Studie (0,66) geschätzt (Keleş & Keskin, 2017b). Nach der t-Test-Familie und dem Unterschied zwischen zwei unabhängigen Mittelwerten mit einem Alpha-Fehler von 0,05 und einer Beta-Power von 0,80 (G*Power 3.1 für Macintosh; Heinrich Heine, Universität Düsseldorf, Düsseldorf, Deutschland) wurden 29 Proben als die minimale ideale Größe pro Gruppe angegeben. Anschließend wurden bifid und nicht-bifid mesiale Wurzeln hinsichtlich folgender Punkte verglichen:
Hauptapikale Foramen
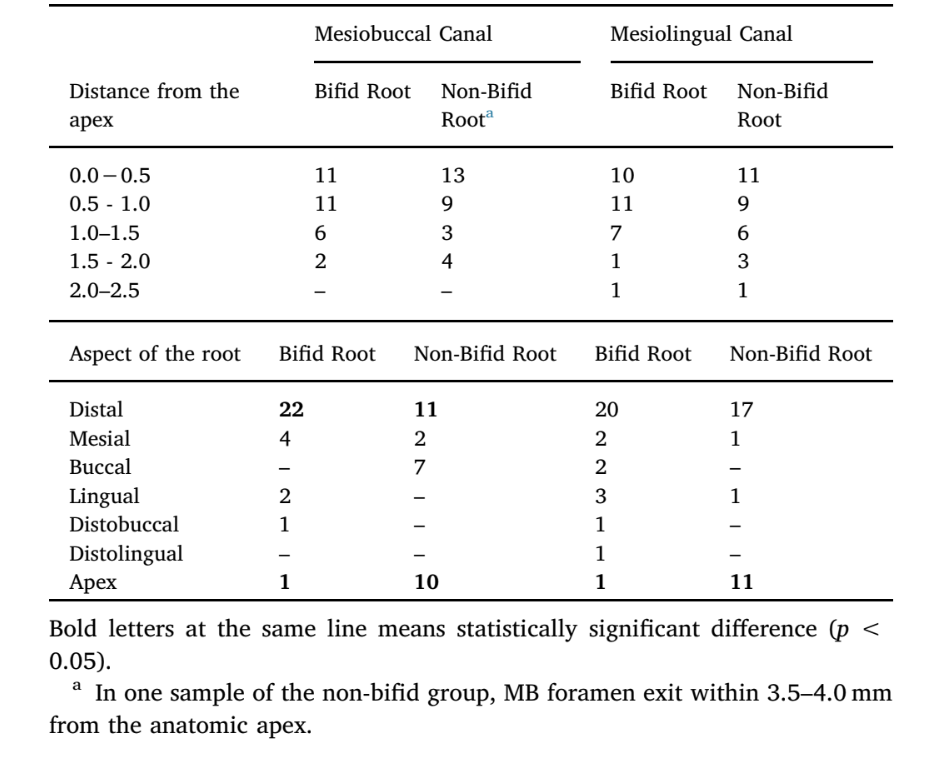
Das apikale Foramen der mesiobuccalen (MB) und mesiolingualen (ML) Kanäle wurde hinsichtlich seiner Position und vertikalen Entfernung vom anatomischen Apex mit der Software DataViewer v.1.5.6 (Bruker-microCT) bewertet. Die vertikale Entfernung wurde bestimmt, indem die Entfernung von einer horizontalen Ebene, die senkrecht zur langen Achse der Wurzel verläuft und den anatomischen Apex kreuzt, zu einer zweiten horizontalen Ebene gemessen wurde, die das Zentrum des Foramen kreuzt und parallel zur langen Achse der Wurzel verläuft.
Foramen-ähnliche Öffnungen
Die Anzahl der foramen-ähnlichen Öffnungen im resezierten Wurzel wurde gemäß Ordinola-Zapata et al. (2019) untersucht. Die Öffnungen wurden in 1,0-mm-Abständen für bifide und nicht-bifide Wurzeln vom Niveau des Hauptforamen bis zu 4 mm in koronal Richtung mit der Software Data-Viewer v.1.5.6 (Bruker-microCT) bewertet (Abb. 1B).
Apikale Foramina und accessory Kanäle
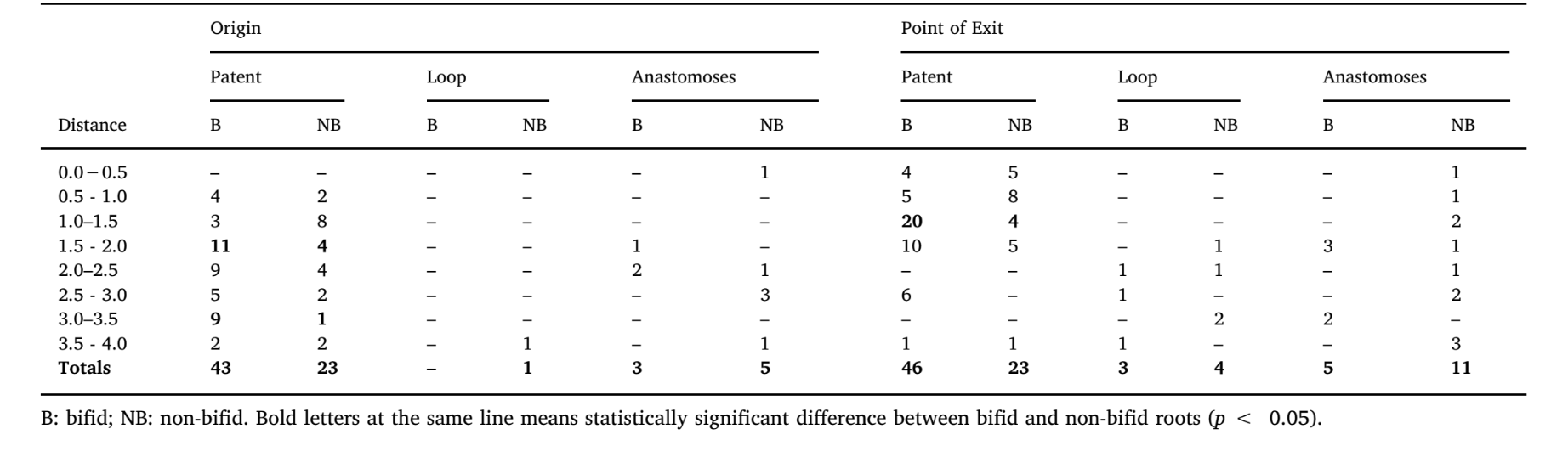
Die Anzahl der apikalen Foramina (haupt- und accessory Foramina) wurde für jedes Präparat mit der Software CTVol v. 2.3.2.0 (Bruker-microCT) berechnet. Die Anzahl und Art (patent, Schleife und Anastomosen) sowie Ursprung und Austrittspunkte der accessory Kanäle wurden gemäß Ordinola-Zapata et al. (2019) bewertet, wobei die Software CTVol v. 2.3.2.0 (Bruker-microCT) und DataViewer v.1.5.6 (Bruker-microCT) verwendet wurde. Ein patentierter accessory Kanal wurde definiert als jeder Zweig, der den Hauptkanal verlässt und mit der äußeren Oberfläche der Wurzel kommuniziert, der Schleifen-accessory Kanal verließ und verband denselben Kanal (rekurrent), während die Anastomosen zwei verschiedene Kanäle verbanden (inter-kanal Zweig) (Abb. 1C). Die Ursprungsposition der accessory Kanäle wurde bestimmt, indem der vertikale Abstand parallel zur Längsachse der mesialen Wurzel von einer horizontalen Ebene, die senkrecht zur Längsachse der Wurzel verläuft und den anatomischen Apex kreuzt, zu einer zweiten horizontalen Ebene gemessen wurde, die die koronale Basis des accessory Kanals kreuzt. Der Austrittspunkt der accessory Kanäle (d.h. accessory Foramen) wurde bestimmt, indem der vertikale Abstand parallel zur Längsachse der mesialen Wurzel von einer horizontalen Ebene, die senkrecht zur Längsachse der Wurzel verläuft und den anatomischen Apex kreuzt, zu einer zweiten horizontalen Ebene gemessen wurde, die das Zentrum des Foramen kreuzt. Bei accessory Kanälen, die als Schleifen und Anastomosen kategorisiert sind, wurde die Verschmelzposition als Endpunkt der Kanäle betrachtet (Ordinola-Zapata et al., 2019).
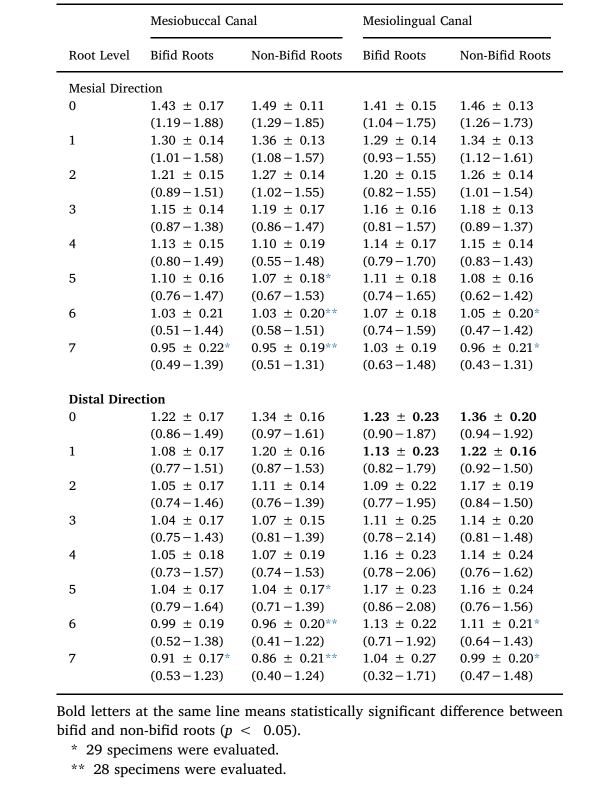
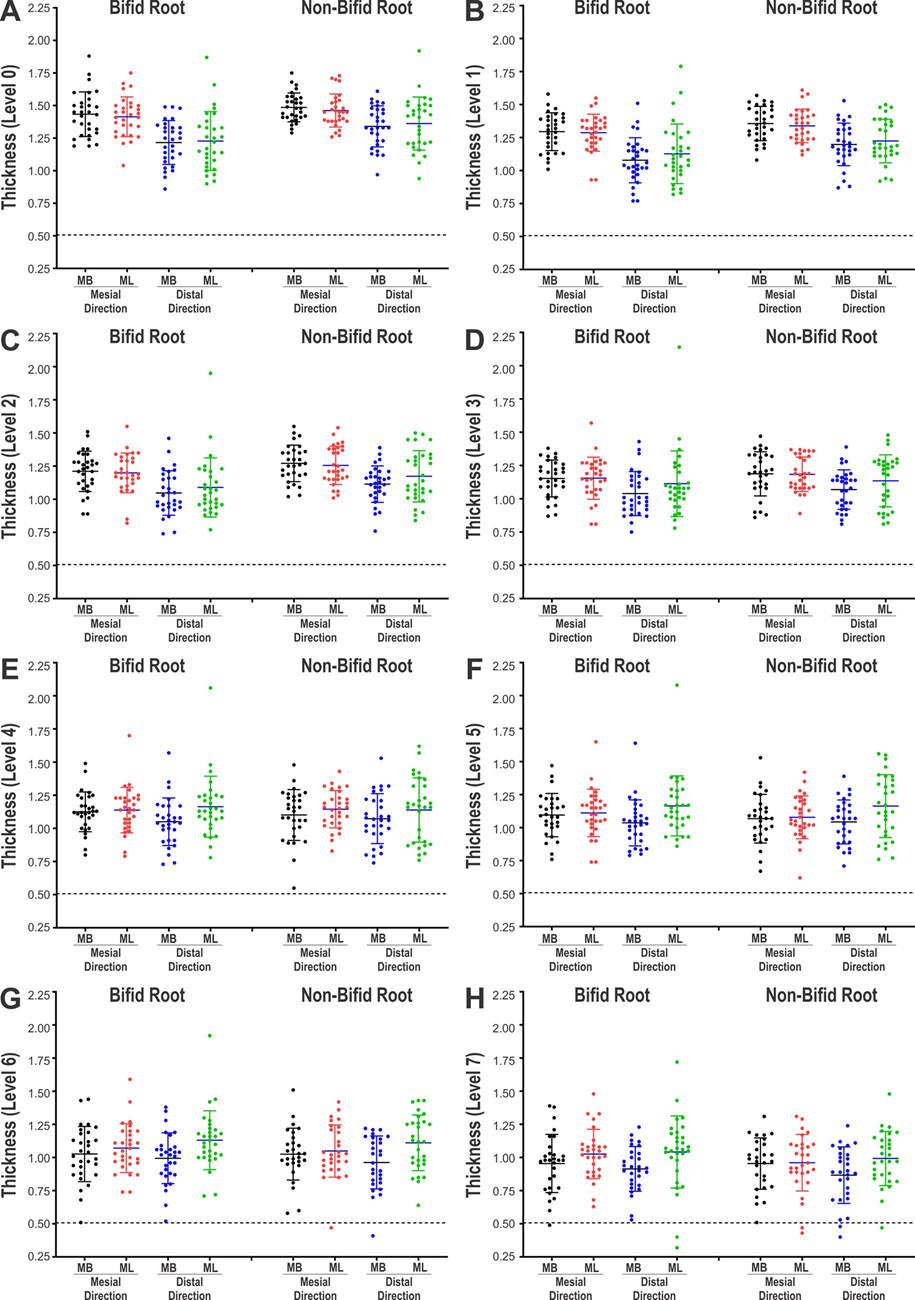
Dentin-Dicke
Eine dreidimensionale Karte der Dentin-Dicke wurde mit der CTAn v.1.18.8 Software (Bruker-microCT) erstellt (De-Deus et al., 2019) und farbcodierte Querschnitte wurden verwendet, um die kleinste Dentin-Dicke in beiden Aspekten der Wurzel, die mit jedem Wurzelkanal in einem Abstand von 1,0 mm vom Furkationsniveau (Niveau 0) bis zu 7 mm (Niveaus 1–7) zur Spitze in Beziehung steht, zu identifizieren (CTVox v.3.3.0; Bruker-microCT) und zu messen (CTAn v.1.18.8, Bruker-microCT).
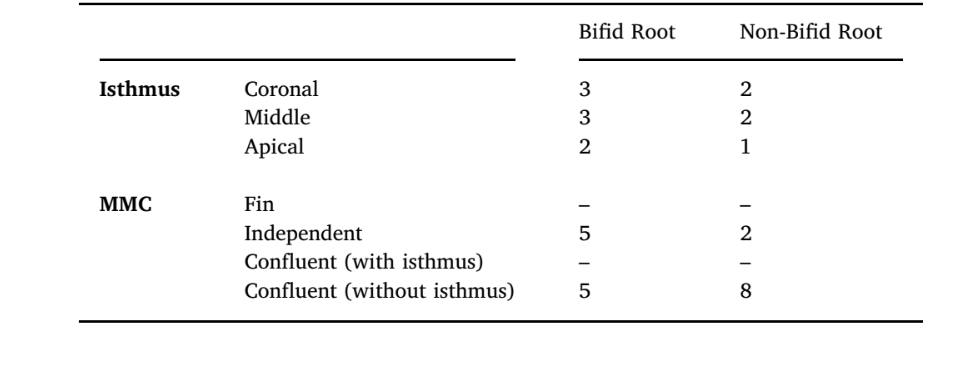
Isthmus und mittlere mesiale Kanäle
Der Isthmus, definiert als vollständige oder teilweise enge Verbindung zwischen MB- und ML-Kanälen (AAE, 2020), wurde als vorhanden oder nicht vorhanden klassifiziert, während das Vorhandensein und der Typ des mittleren mesialen Kanals gemäß einer früheren Studie (Pomeranz, Eidelman, & Goldberg, 1981) kategorisiert wurden.
Statistische Analyse
Morphologische Vergleiche zwischen bifiden und paarweise abgestimmten nicht-bifiden mesialen Wurzeln wurden unter Verwendung des Chi-Quadrat-Tests (Position des apikalen Foramen, Anzahl der zusätzlichen Foramina und Typ der zusätzlichen Kanäle) und des Student's t-Tests (Wurzel-Länge und Dentin-Dicke) durchgeführt. Die Bonferroni-Korrektur wurde angewendet, wenn mehrere paarweise Tests durchgeführt wurden und ein statistischer Unterschied zwischen den Gruppen festgestellt wurde (SPSS v.21.0 Software; SPSS Inc., Chicago, IL, USA).
Ergebnisse
Insgesamt betrug die Inzidenz von mesialen Wurzeln mit bifidem Apex in dieser Studie 13,6 % (30 von 250 mandibularen ersten Molaren). Der Grad der Homogenität zwischen bifiden und nicht-bifiden Gruppen wurde durch den Vergleich der Wurzelkanalkonfiguration und der Wurzelänge der Proben bestätigt (p > 0,05).
Hauptapikales Foramen
Tabelle 1 zeigt die Position des Hauptforamen der MB- und ML-Kanäle von bifiden und nicht-bifiden mesialen Wurzeln der mandibularen ersten Molaren. Insgesamt wurde kein statistischer Unterschied bezüglich der Entfernung des Hauptforamen zum Apex zwischen bifiden und nicht-bifiden Wurzeln für sowohl MB- als auch ML-Kanäle beobachtet (p > 0,05). In MB- und ML-Kanälen von nicht-bifiden Wurzeln tritt eine signifikante Anzahl von Foramina am Apex aus (p < 0,05), während im MB-Kanal von bifiden Wurzeln die meisten Hauptforamina distal abweichen (p < 0,05).
Foramen-ähnliche Öffnungen
Tabelle 2 zeigt die Anzahl der Kanalöffnungen, die im apikalen Drittel von bifiden und nicht-bifiden mesialen Wurzeln beobachtet wurden, und Abb. 1B veranschaulicht die Öffnungen in 4 verschiedenen Ebenen von 2 repräsentativen Proben. Insgesamt wurde im apikalen Drittel von bifiden und nicht-bifiden Wurzeln hinsichtlich der Anzahl der Öffnungen in verschiedenen Ebenen kein statistischer Unterschied beobachtet (p > 0,05). Ein statistischer Unterschied wurde nur 2 mm vom anatomischen Apex beobachtet (p < 0,05). Die Querschnittsanalyse des apikalen Drittels zeigte, dass die meisten Proben 2–4 Öffnungen im apikalen Drittel hatten, aber auch die Anwesenheit von mehr als 4 Öffnungen in einigen Proben wurde beobachtet (Tabelle 2).

Apikale Foramina und accessory Kanäle
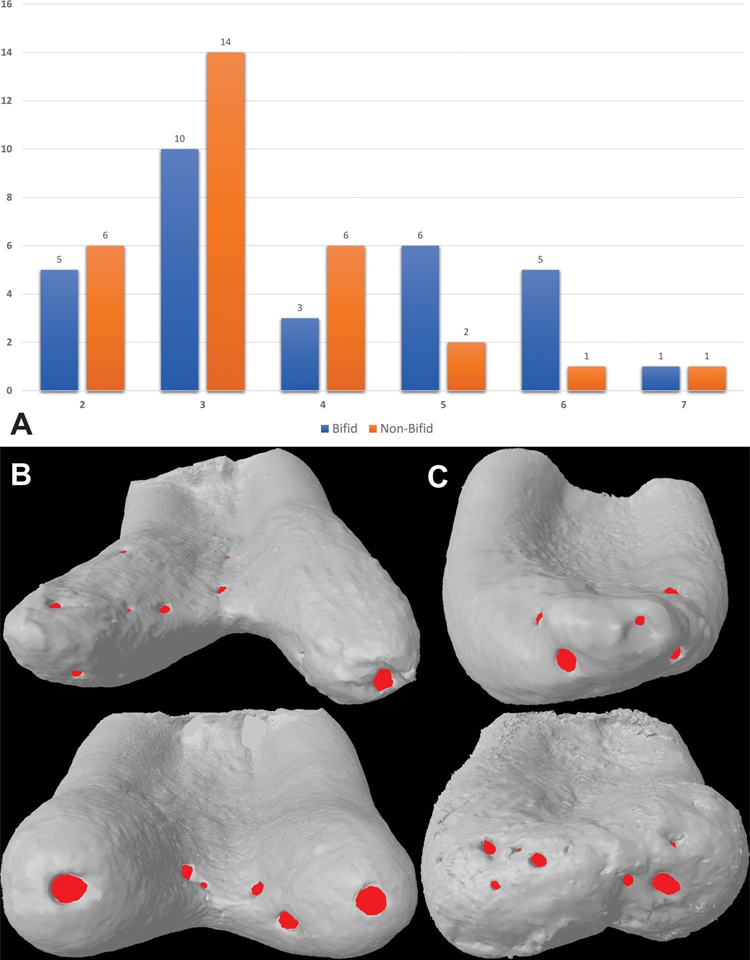
Tabelle 3 zeigt die Verteilung der Typen von accessory Kanälen im apikalen Drittel von bifiden und nicht-bifiden mesialen Wurzeln entsprechend der Position ihres Ursprungs und der Austrittspunkte, während Abb. 1C die patentierten, Schleifen- und Anastomosen-accessory Kanäle veranschaulicht. Die Häufigkeit von accessory Kanälen auf jeder Ebene über die apikalen 4 mm der mesialen Wurzeln war signifikant höher in bifiden Wurzeln (p < 0,05); jedoch gab es eine höhere Anzahl von patentierten Kanälen im Vergleich zu Schleifen- und Anastomosen-accessory Typen in allen Proben (p < 0,05). Insgesamt wurden Ursprung und Austritt der patentierten Kanäle hauptsächlich zwischen 1,0 und 2,0 mm vom Apex beobachtet (p < 0,05). Bifide und nicht-bifide Wurzeln wiesen insgesamt 119 bzw. 101 apikale Foramina auf (Abb. 2A). Mehrere Foramina (> 4) wurden in 41,7 % der Wurzeln (n = 25) beobachtet (Abb. 2B und C).
Dentin-Dicke
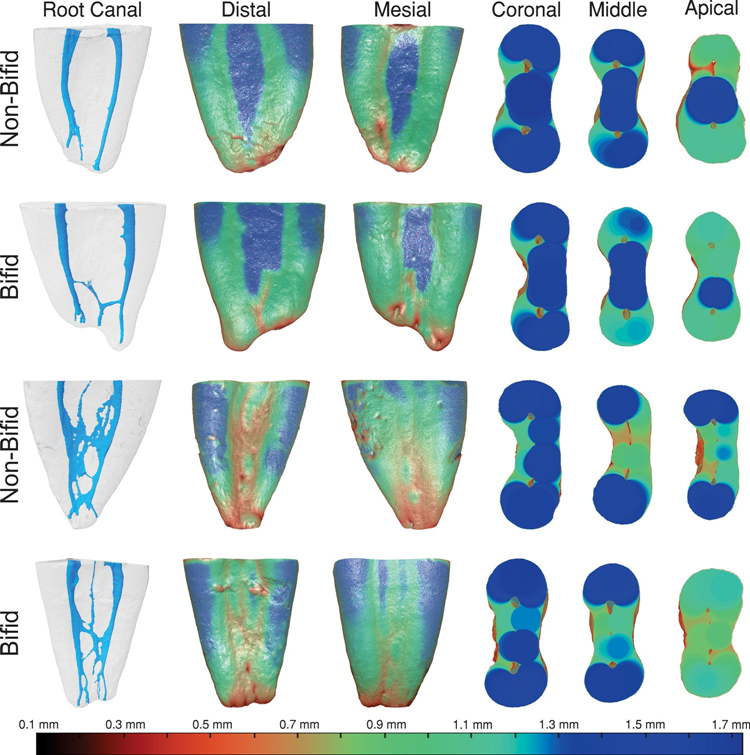
Tabelle 4 und Abb. 3 zeigen die Dentin-Dickenwerte der MB- und ML-Kanäle von bifiden und nicht-bifiden mesialen Wurzeln in mesialen oder distalen Richtungen in Intervallen von 1,0 mm vom Furkationsniveau bis zu 7 mm in apikal Richtung. Abb. 4 zeigt repräsentative paarweise abgestimmte farbcodierte Modelle von bifiden und nicht-bifiden mesialen Wurzeln mit unterschiedlichen Kanal-Konfigurationen. Während in mesialer Richtung die Dentin-Dicke von 0,49 bis 1,88 mm (bifide Wurzeln) und von 0,43 bis 1,85 mm (nicht-bifide Wurzeln) variierte, variierte sie in distaler Richtung von 0,32 bis 2,14 mm (bifide Wurzeln) und von 0,40 bis 1,92 mm (nicht-bifide Wurzeln). Ein signifikanter Unterschied zwischen bifiden und nicht-bifiden Wurzeln wurde nur auf den Ebenen 0 (Furkation) und 1 in Richtung distal des ML-Kanals beobachtet (p < 0,05) (Tabelle 4). Obwohl die durchschnittlich niedrigsten Werte in der distalen Richtung der Wurzeln beobachtet wurden (Tabelle 4), wurde eine Dentin-Dicke von weniger als 0,5 mm nur auf den Ebenen 6 und 7 beider Kanäle und Richtungen festgestellt (Abb. 3). In Abb. 4 ist zu erkennen, dass die Dentin-Dicke mit zunehmender Komplexität des Wurzelkanalsystems abnimmt.
Kanäle von bifiden und nicht-bifiden mesialen Wurzeln vom (A) Furkationsniveau (Niveau 0) bis zu 7 mm (Niveaus 1 bis 7) in apikal Richtung (B-H) gemessen wurden.
Isthmus und mittlerer mesialer Kanal
Nur 3 mesiale Wurzeln mit bifidem Apex (10 %) hatten einen Isthmus, hauptsächlich im koronalen Drittel, während eine hohe Inzidenz von MMC beobachtet wurde (n = 10, 33,3 %). Unabhängiger MMC-Typ wurde hauptsächlich in bifiden Wurzeln beobachtet (n = 5; 16,6 %) und konfluente Anatomie ohne Isthmus in nicht-bifiden Wurzeln (n = 8; 26,6 %) (Tabelle 5). Aufgrund der in dieser Studie verwendeten Paarvergleichsmethodik wurde die gleiche Anzahl von Proben mit MMC und Isthmus in die nicht-bifide Gruppe aufgenommen. Daher wurde kein statistischer Vergleich durchgeführt.
Diskussion
In dieser Studie wurden bifide und nicht-bifide mesiale Wurzeln der mandibulären ersten Molaren hinsichtlich der Wurzelmorphologie und der Kanalanatomie unter nicht-invasiver Mikro-CT-Technologie verglichen. Es wurde gezeigt, dass die Inzidenz von bifidem Apex in dieser Wurzel relativ hoch ist (13,6 %) und dieses morphologische Merkmal als prädiktiver Faktor für eine komplexe Kanalanatomie im apikalen Drittel wirken kann. Zusätzliche Kanäle, die das Wurzelkanalsystem mit der äußeren Wurzeloberfläche (patenter Typ) verbinden, wurden hauptsächlich zwischen 1,0 und 2,0 mm vom Apex beobachtet, und ihre Häufigkeit war signifikant höher in bifiden (n = 53) als in nicht-bifiden (n = 30) Wurzeln (Tabelle 3). Andererseits waren Schleifen- und Anastomosenkanaltypen im apikalen Bereich nicht häufig (Tabelle 3), was die in früheren Mikro-CT-Studien gewonnenen Ergebnisse bestätigt (Briseño-Marroquín, Paqué, Maier, Willershausen, & Wolf, 2015; Ordinola-Zapata et al., 2019; Wolf, Paqué, Zeller, Willershausen, & Briseño-Marroquín, 2016). Ex vivo-Studien, die CBCT- und Mikro-CT-Methoden über eine große Anzahl von Zähnen verwendeten, berichteten von einer durchschnittlichen Inzidenz von MMC, die von 0,26 % (Kim, Kim, Woo, & Kim, 2013) bis 18,6 % (Versiani et al., 2016) reicht, während in der vorliegenden Studie eine signifikant hohe Inzidenz dieses zusätzlichen Kanals in den bifiden Wurzeln (n = 10, 33,3 %) beobachtet wurde, von denen die Hälfte (16,6 %) als unabhängiger Typ klassifiziert wurde. Das Vorhandensein eines unabhängigen MMC kann ein Problem darstellen, wenn seine Öffnung selbst nach einem Troughing-Verfahren nicht erkannt wird (Keleş & Keskin, 2017b). Wenn ein infizierter Kanal übersehen wird, können verbleibende Bakterien die Krankheit aufrechterhalten oder verursachen, was die Prognose der Behandlung gefährdet (Costa et al., 2019). Leider kann eine bifid-spitzige mesiale Wurzel in Kliniken, die konventionelle Radiographie verwenden, aufgrund der buccolingualen Überlagerung der Wurzelspitzen schwer zu unterscheiden sein, obwohl das Vorhandensein einer radioluzenten Linie der doppelten parodontalen Membran auf deren Vorhandensein hindeuten könnte. Darüber hinaus kann, obwohl die Cone-Beam-Computertomographie (CBCT) keine Informationen über kleinere Wurzelkanalstrukturen im apikalen Drittel bereitstellen kann (Ordinola-Zapata et al., 2017; Sousa et al., 2017), diese Technologie leicht das Vorhandensein einer bifid-spitzigen Wurzelmorphologie erkennen, und folglich wären Kliniker in der Lage, die Existenz anatomischer Komplexitäten anzunehmen, die einen angemessenen Ansatz erfordern, um die Desinfektionsverfahren zu verbessern.
Insgesamt wurde kein statistischer Unterschied zwischen bifiden und nicht-bifiden Wurzeln hinsichtlich der Position der MB- und ML-Kanal-Foramina (Tabelle 1), der Anzahl der Foramina (Abb. 2) und der Anzahl der Kanalöffnungen im apikalen Drittel (Tabelle 2) beobachtet. Diese Ähnlichkeiten könnten durch die strengen Kriterien erklärt werden, die für die Auswahl der Proben unter Verwendung von Mikro-CT-Daten verwendet wurden, die die Bildung von ausgewogenen, paarweise abgestimmten Gruppen basierend auf der Wurzellänge und der Kanal-Konfiguration ermöglichten. In Übereinstimmung mit früheren Berichten (Dummer, McGinn, & Rees, 1984; Vertucci, 2005) lagen die Hauptforamina der MB- und ML-Kanäle innerhalb von 2,5 mm vom anatomischen Apex. Aufgrund der hohen Anzahl von Öffnungen und Foramina im apikalen Drittel, wenn eine Operation notwendig wird, wird die natürliche Anatomie verändert und zusätzliche anatomische Merkmale wie Isthmus, transversale Anastomosen, laterale Verbindungen oder multiple Öffnungen müssen berücksichtigt werden (Versiani et al., 2016). In der Literatur wird empfohlen, den Wurzelapex während chirurgischer Eingriffe um 3 mm zu bevellen, um die überwiegende Mehrheit der unvorbereiteten und ungefüllten zusätzlichen Kanäle zu entfernen (Degerness & Bowles, 2008; Stropko, Doyon, & Gutmann, 2005), was die Möglichkeit eines Misserfolgs verringert (Vertucci, 2005). Obwohl die meisten der in dieser Studie beobachteten Öffnungen 3 mm vom Apex entfernt lagen, wurden, wie zuvor berichtet (Gu, Wei, Ling, & Huang, 2009; Wolf et al., 2016), auch multiple Kanalöffnungen 4 mm vom Apex beobachtet (Tabelle 2). Daher wird im Falle einer apikalen Chirurgie dringend empfohlen, die Operationsmikroskopie zu verwenden, um von Vergrößerung und Beleuchtung zu profitieren, zusammen mit dünnen Ultraschallspitzen zur Wurzelspitzenpräparation, um alle Kanalöffnungen zu integrieren und abzudichten (Leoni, Versiani, Pécora, & Sousa-Neto, 2014). Die Ergebnisse werden schlecht sein, wenn diese veränderte Anatomie nicht erkannt und ordnungsgemäß behandelt wird. Schließlich ist es erwähnenswert, dass nur 3 bifide mesiale Wurzeln (10 %) einen Isthmus im apikalen Drittel hatten. Dies ist eine signifikant niedrige prozentuale Häufigkeit, wenn man bedenkt, dass die Literatur das Vorhandensein dieser Anatomie in 55 % der mesialen Wurzeln der mandibulären ersten Molaren berichtet (De Pablo, Estevez, Péix Sánchez, Heilborn, & Cohenca, 2010), mit der höchsten Inzidenz bei 3–5 mm vom Apex (Teixeira et al., 2003).
Die Bewertung der Dentin-Dicke ist wichtig, da eine übermäßige Entfernung von Dentin während der mechanischen Präparation die Zähne anfälliger für Wurzelfrakturen machen könnte (Kishen, 2006). Im Allgemeinen wurde in dieser Studie kein signifikanter Unterschied zwischen bifiden und nicht-bifiden Wurzeln hinsichtlich der Dentin-Dicke beobachtet (Tabelle 4, Abb. 3 und 4). Wie erwähnt, kann diese morphologische Ähnlichkeit durch die Verteilung der Proben in paarweise abgestimmte Gruppen erklärt werden. In mesialer Richtung variierte die Dentin-Dicke der MB- und ML-Kanäle von 0,49 bis 1,88 mm bzw. von 0,43 bis 1,75 mm, während sie in distal Richtung von 0,40 bis 1,61 mm und von 0,32 bis 2,14 mm variierte. Eine aktuelle anatomische Studie zu mesialen Wurzeln von mandibulären Molaren beschrieb Dentin-Dickenwerte von 0,67 bis 1,93 mm (MB-Kanal) und von 0,77 bis 1,89 mm (ML-Kanal) (De-Deus et al., 2019). Interessanterweise waren die kleinsten Werte mindestens doppelt so hoch wie die in der vorliegenden Studie berichteten. Darüber hinaus war in 40 % (n = 9360) aller bewerteten Querschnitte (n = 23.400) die kleinste Dentin-Dicke, die sich auf die MB- und ML-Kanäle bezog, in Richtung des mesialen Teils der Wurzel verschoben, anstatt in distal Richtung (Gabelungsbereich). Diese Ergebnisse standen nicht im Einklang mit der vorliegenden Studie, wahrscheinlich weil die Querschnitte für die Messung senkrecht zur Zahnachse und nicht zur Achse der mesialen Wurzel waren, und zudem hat die mesiale Wurzel eine inhärente Krümmung zur distalen Seite; daher liegt die Schneidelinie an der mesialen Seite tatsächlich weiter apikal als die Schneidelinie an der distalen Seite der mesialen Wurzel. Da die mesiale Wurzel eine konische Form hat und das apikale Niveau einer geringeren Dicke entspricht, würde die Dicke auf der Gabelungsseite überschätzt werden.
Fazit
Die vorliegende Studie zeigte signifikante Unterschiede in der apikalen Anatomie von bifiden und nicht-bifiden mesialen Wurzeln der mandibulären ersten Molaren. Die Ergebnisse deuten darauf hin, dass das Vorhandensein einer bifid-spitzigen mesialen Wurzel in den mandibulären ersten Molaren als prädiktiver Faktor für eine komplexe Kanal-Anatomie mit einer hohen Inzidenz von zusätzlicher Anatomie im apikalen Drittel und einer erhöhten prozentualen Häufigkeit unabhängiger mittlerer mesialer Kanäle wirken kann.
Autoren: Ali Keleş, Cangül Keskin, Rawan Alqawasmi, Marco Aurelio Versiani
Literaturverzeichnis:
- AAE (2020). Glossar der endodontischen Begriffe (10. Aufl.). Chicago: American Association of Endodontists. https://www.aae.org/specialty/clinical-resources/glossary-endodontic-terms/.
- Alves, F. R., Andrade-Junior, C. V., Marceliano-Alves, M. F., Pérez, A. R., Rôças, I. N., Versiani, M. A., et al. (2016). Ergänzende Schritte zur Desinfektion des Wurzelkanalsystems der mandibulären Molaren: Ein korrelativer bakteriologischer, mikro–computertomographischer und kryopulverisierender Ansatz. Journal of Endodontics, 42, 1667–1672. https://doi. org/10.1016/j.joen.2016.08.003.
- Briseño-Marroquín, B., Paqué, F., Maier, K., Willershausen, B., & Wolf, T. G. (2015). Wurzelkanalanatomie und Konfiguration von 179 maxillären ersten Molaren mittels Mikro-Computertomographie: Eine ex vivo Studie. Journal of Endodontics, 41, 2008–2013. https://doi.org/10.1016/j.joen.2015.09.007.
- Costa, F., Pacheco-Yanes, J., Siqueira, J. F., Jr., Oliveira, A., Gazzaneo, I., Amorim, C. A., et al. (2019). Zusammenhang zwischen verpassten Kanälen und apikaler Parodontitis.International Endodontic Journal, 52, 400–406. https://doi.org/10.1111/iej.13022.
- De Pablo, Ó. V., Estevez, R., Péix Sánchez, M., Heilborn, C., & Cohenca, N. (2010). Wurzelanatomie und Kanal-Konfiguration des permanenten mandibulären ersten Molaren: Eine systematische Übersicht. Journal of Endodontics, 36, 1919–1931. https://doi.org/10.1016/j.joen.2010.08.055.
- De-Deus, G., Rodrigues, E. A., Belladonna, F. G., Simões-Carvalho, M., Cavalcante, D. M., Oliveira, D. S., et al. (2019). Anatomische Gefahrenzone neu überdacht: Eine Mikro-CT-Studie zur Dentin-Dicke in mandibulären Molaren. International Endodontic Journal, 52, 1501–1507. https://doi.org/10.1111/iej.13141.
- Degerness, R., & Bowles, W. (2008). Anatomische Bestimmung des Resektionsniveaus der mesiobuccalen Wurzel in maxillären Molaren. Journal of Endodontics, 34, 1182–1186. https:// doi.org/10.1016/j.joen.2008.07.007.
- Dummer, P. M. H., McGinn, J. H., & Rees, D. G. (1984). Die Position und Topographie der apikalen Kanalverengung und des apikalen Foramen. International Endodontic Journal, 17, 192–198. https://doi.org/10.1111/j.1365-2591.1984.tb00404.x.
- Gu, L., Wei, X., Ling, J., & Huang, X. (2009). Eine mikrocomputertomographische Studie der Kanalverengungen in der mesialen Wurzel der mandibulären ersten Molaren in einer chinesischen Population.
- Journal of Endodontics, 35, 353–356. https://doi.org/10.1016/j.joen.2008.11.029.
- Keleş, A., & Keskin, C. (2018). Eine mikro-Computertomographie-Studie der bandförmigen Wurzelkanalverengungen, deren Boden im apikalen Drittel der mesialen Wurzeln der mandibulären ersten Molaren liegt. International Endodontic Journal, 51, 240–246. https://doi.org/10.1111/iej.12842.
- Keleş, A., & Keskin, C. (2017a). Apikale Wurzelkanalanatomie der mesialen Wurzeln der mandibulären ersten Molaren mit Vertucci-Typ-II-Konfiguration mittels Mikro-Computertomographie. Journal of Endodontics, 43, 481–485. https://doi.org/10.1016/j.joen.2016.10.045.
- Keleş, A., & Keskin, C. (2017b). Nachweisbarkeit der Öffnungen der mittleren mesialen Wurzelkanäle durch Troughing-Technik in mandibulären Molaren: Eine mikro-Computertomographie-Studie. Journal of Endodontics, 43, 1329–1331. https://doi.org/10.1016/j.joen.2017.03.021.
- Kim, S. Y., Kim, B. S., Woo, J., & Kim, Y. (2013). Morphologie der mandibulären ersten Molaren analysiert durch Cone-Beam-Computertomographie in einer koreanischen Population: Variationen in der Anzahl der Wurzeln und Kanäle. Journal of Endodontics, 39, 1516–1521. https://doi. org/10.1016/j.joen.2013.08.015.
- Kishen, A. (2006). Mechanismen und Risikofaktoren für die Bruchneigung bei endodontisch behandelten Zähnen. Endodontic Topics, 13, 57–83. https://doi.org/10.1111/j.1601-1546.2006.00201.x.
- Kupczik, K., & Hublin, J. J. (2010). Morphologie der Wurzeln mandibulärer Molaren bei Neandertalern und spätpleistozänen sowie modernen Homo sapiens. Journal of Human Evolution, 59, 525–541. https://doi.org/10.1016/j.jhevol.2010.05.009.
- Leoni, G. B., Versiani, M. A., Pécora, J. D., & Sousa-Neto, M. D. (2014). Mikro-Computertomographie-Analyse der Wurzelkanalanatomie von mandibulären Schneidezähnen. Journal of Endodontics, 40, 710–716. https://doi.org/10.1016/j.joen.2013.09.003.
- Ordinola-Zapata, R., Bramante, C. M., Versiani, M. A., Moldauer, B. I., Topham, G., Gutmann, J. L., et al. (2017). Vergleichende Genauigkeit der Clearing-Technik, CBCT und Mikro-CT-Methoden zur Untersuchung der mesialen Wurzelkanalkonfiguration der mandibulären ersten Molaren. International Endodontic Journal, 50, 90–96. https://doi.org/10.1111/iej.12593.
- Ordinola-Zapata, R., Martins, J. N. R., Niemczyk, S., & Bramante, C. M. (2019). Apikale Wurzelkanalanatomie in der mesiobuccalen Wurzel der maxillären ersten Molaren: Einfluss der apikalen Wurzelgestalt und Prävalenz der apikalen Foramina – Eine Mikro-CT-Studie. International Endodontic Journal, 52, 1218–1227. https://doi.org/10.1111/iej.13109.
- Pomeranz, H. H., Eidelman, D. L., & Goldberg, M. G. (1981). Behandlungsüberlegungen zum mittleren mesialen Kanal der mandibulären ersten und zweiten Molaren. Journal of Endodontics, 7, 565–568. https://doi.org/10.1016/S0099-2399(81)80216-6.
- Sousa, T. O., Haiter-Neto, F., Nascimento, E. H. L., Peroni, L. V., Freitas, D. Q., & Hassan, B. (2017). Diagnostische Genauigkeit der periapikalen Radiographie und der Cone-Beam-Computertomographie zur Identifizierung der Wurzelkanalkonfiguration menschlicher Prämolaren. Journal of Endodontics, 43, 1176–1179. https://doi.org/10.1016/j.joen.2017.02.021.
- Stropko, J. J., Doyon, G. E., & Gutmann, J. L. (2005). Wurzelspitzenmanagement: Resektion, Kavitätenpräparation und Materialplatzierung. Endodontic Topics, 11, 131–151. https://doi.org/10.1111/j.1601-1546.2005.00158.x.
- Teixeira, F. B., Sano, C. L., Gomes, B. P. F. A., Zaia, A. A., Ferraz, C. C. R., & Souza-Filho, F. J. (2003). Eine vorläufige in vitro Studie zur Inzidenz und Position des Wurzelkanal-Isthmus in maxillären und mandibulären ersten Molaren. International Endodontic Journal, 36, 276–280. https://doi.org/10.1046/j.1365-2591.2003.00638.x.
- Turner, C. G. (1981). Bestimmung der Wurzelanzahl in maxillären ersten Prämolaren für moderne menschliche Populationen. American Journal of Physical Anthropology, 54, 59–62. https://doi.org/10.1002/ajpa.1330540108.
- Versiani, M. A., Ordinola-Zapata, R., Keleş, A., Alcin, H., Bramante, C. M., Pécora, J. D., et al. (2016). Mittlere mesiale Kanäle in mandibulären ersten Molaren: Eine Mikro-CT-Studie in verschiedenen Populationen. Archives of Oral Biology, 61, 130–137. https://doi.org/10.1016/j.archoralbio.2015.10.020.
- Vertucci, F. J. (2005). Wurzelkanalanatomie und ihre Beziehung zu endodontischen Verfahren. Endodontic Topics, 10, 3–29. https://doi.org/10.1111/j.1601-1546.2005.00129.x.
- Villas-Bôas, M. H., Bernardineli, N., Cavenago, B. C., Marciano, M., Del Carpio-Perochena, A., de Moraes, I. G., et al. (2011). Mikro-Computertomographie-Studie der inneren Anatomie der mesialen Wurzelkanäle von mandibulären Molaren. Journal of Endodontics, 37, 1682–1686. https://doi.org/10.1016/j.joen.2011.08.001.
- Wayman, B. E., Patten, J. A., & Dazey, S. E. (1994). Relative Häufigkeit von Zähnen, die endodontische Behandlung benötigen, bei 3350 aufeinanderfolgenden endodontischen Patienten. Journal of Endodontics, 20, 399–401. https://doi.org/10.1016/S0099-2399(06)80299-2.
- Wolf, T. G., Paqué, F., Zeller, M., Willershausen, B., & Briseño-Marroquín, B. (2016). Wurzelkanalanatomie und Konfiguration von 118 mandibulären ersten Molaren mittels Mikro-Computertomographie: Eine ex vivo Studie. Journal of Endodontics, 42, 610–614. https://doi.org/10.1016/j.joen.2016.01.004.
Um weiterzulernen und Zugang zu allen anderen Artikeln zu erhalten, melden Sie sich an oder erstellen Sie ein Konto
Oder melden / erstellen Sie hier ein Konto an:

/social-network-service/media/default/6758/89a8282e.png)