Eine vergleichende histologische Bewertung der Biokompatibilität von Materialien, die in der apikalen Chirurgie verwendet werden
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziel: Die biologischen Eigenschaften einer Vielzahl von Materialien zu bewerten, die in der apikalen Chirurgie verwendet werden könnten.
Methodik: Die von der FDI (1980) und ADA (1982) empfohlene intraossäre Implantationstechnik wurde verwendet, um die folgenden Materialien zu testen: Zinkoxid-Eugenol (ZOE), mineralisches Trioxid-Aggregat (MTA) und Z-100 lichtgehärtetes Kompositharz. Dreißig Meerschweinchen, 10 für jedes Material, unterteilt in experimentelle Zeiträume von 4 und 12 Wochen, erhielten ein Implantat auf jeder Seite der Kinnsymphyse. Die Reaktion des Bindegewebes entlang der lateralen Wand außerhalb der Tasse diente als negativer Kontrollwert für die Technik. Am Ende der Beobachtungszeiträume wurden die Tiere getötet und die Proben für die routinemäßige histologische Untersuchung vorbereitet, um ihre Biokompatibilität zu bewerten.
Ergebnisse: Die Reaktion des Gewebes auf die Materialien nahm mit der Zeit ab. Der ZOE-Zement war während des 4-wöchigen Experimentierzeitraums hochtoxisch, aber dieses Profil änderte sich signifikant nach 12 Wochen, als er biokompatible Eigenschaften zeigte. MTA und Z-100 zeigten in diesem Testmodell in beiden Zeiträumen Biokompatibilität.
Fazit: MTA und Z-100-Komposit waren in diesem experimentellen Modell nach 4 und 12 Wochen biokompatibel.
Einleitung
Der Erfolg der Wurzelkanalbehandlung hängt von der Entfernung des infizierten Kanalinhalts ab, gefolgt von der Füllung des Kanals mit einem Material von angemessener Verträglichkeit, um Reizungen des periapikalen Gewebes zu vermeiden. Trotz der ständigen Weiterentwicklung von Konzepten, neuen endodontischen Techniken und der Entwicklung effektiverer Materialien und Instrumente wird die Lösung von periapikalen Pathosen manchmal nur durch chirurgische Eingriffe erreicht (Tassery et al. 1999).
Die apikale Chirurgie sollte jedoch nur durchgeführt werden, wenn die konventionelle Wurzelkanalbehandlung gescheitert ist. Das ideale Material für die apikale Wurzelspitzenfüllung sollte biokompatible Eigenschaften, dimensionsstabilität, Haftfähigkeit, geringe Löslichkeit und die Fähigkeit besitzen, eine Abdichtung des apikalen Drittels des Kanals zu schaffen, um das Wurzelkanalsystem von der periapikalen Region zu isolieren (Gartner & Dorn 1992). Die Biokompatibilität hat sich als einer der wichtigsten Faktoren erwiesen (Pascon et al. 2001).
Bei der Betrachtung der biologischen Eigenschaften von endodontischen Materialien gibt es eine Vielzahl von Merkmalen, die berücksichtigt werden sollten. Die Methoden zur Bewertung dieser Parameter umfassen Ersttests, Sekundärtests und Gebrauchsstudien. Die erste Bewertung sollte grundlegende in vitro-Methoden zur Beurteilung der biologischen Eigenschaften umfassen. Die Sekundärbewertungen sollten in vivo an Labortieren durchgeführt werden und können Implantationsexperimente einschließen. Die Gebrauchsstudien werden an Primaten oder Menschen durchgeführt (Spångberg 1969, Stanley 1985).
Eine große Anzahl von Materialien wurde für die apikale Wurzelspitzenfüllung empfohlen. Ziel dieser Studie war es, die Gewebereaktion einer Vielzahl von potenziell nützlichen Materialien, die als Wurzelspitzenfüllung verwendet werden, unter Verwendung des experimentellen Modells, das von der FDI (1980) und der ADA (1982) empfohlen wurde, zu bewerten.
Materialien und Methoden
Die bewerteten Materialien waren Zinkoxid-Eugenol (ZOE) (S.S.White, Rio de Janeiro, Brasilien), mineralisches Trioxidaggregat (MTA) (ProRootTM MTA; Dentsply Endodontics, Tulsa, OK, USA) und Z-100 lichtgehärtete Kompositharz (3M, St Paul, MN, USA). Alle Materialien wurden gemäß den Empfehlungen des Herstellers für ihren klinischen Einsatz vorbereitet und in Teflon®-Träger (Polytetrafluorethylen; DuPont, HABIA, Knivsta, Schweden) geladen, wobei sichergestellt wurde, dass keine Luft eingeschlossen wurde.
Das intraossäre Implantat im Unterkiefer des Meerschweinchens (Spångberg 1969) und die standardisierten Methoden zur Bewertung der biologischen Reaktionen, die von der FDI (1980) und der ADA (1982) empfohlen wurden, wurden verwendet. Dreißig Meerschweinchen (mit einem Gewicht von ~800 g) wurden ausgewählt und jedes Tier erhielt zwei Implantate aus demselben Material. Zehn Proben wurden für jedes Material und Beobachtungszeitraum verwendet (Tabelle 1). Darüber hinaus diente die Reaktion des Bindegewebes entlang der lateralen Wand außerhalb der Teflon® Tasse als negativer Kontrollversuch für die Technik.
Die Tiere wurden intraperitoneal mit 0,6 mL Ketamin (100 mg mL–1) und Acepromazin (0,5 mg mL–1) anesthesiert. In der mukobukkalen Falte des Bereichs der mandibulären Schneidezähne wurde 0,6 mL Xylocain 2% mit Epinephrin (1 : 100 000) injiziert, um lokale Beschwerden zu verhindern. Die Meerschweinchen wurden im submandibulären Bereich rasiert, und die Haut wurde mit 5% Jodtinktur desinfiziert. Der distale ventrale Symphysebereich des Unterkiefers wurde chirurgisch unter antiseptischen Bedingungen durch einen Schnitt in die Haut- und Muskulatur freigelegt. Der mandibuläre Knochen auf beiden Seiten der Symphyse wurde freigelegt, und zylindrische Löcher mit einem Durchmesser von 2 mm und einer Tiefe von 2 mm wurden mit Bohrern unter steriler physiologischer Kochsalzlösung hergestellt. Sterilisierte zylindrische Teflon®-Tassen, die an einem Ende offen sind und deren Außenseiten mit Gewindegängen versehen sind, um Halterillen zu bieten, wurden unter sterilen Bedingungen mit den Materialien gefüllt und in die knöchernen Hohlräume eingesetzt, sodass die Füllmaterialien mit dem Knochengewebe in Kontakt kamen. Die Zylinder wurden
2,0 mm lang und hatte einen Innendurchmesser von 1,3 mm und einen Außendurchmesser von 2,0 mm. Als die Tassen an ihrem Platz waren, wurden die Weichgewebe ersetzt und unabhängig mit einem resorbierbaren Material der Größe 3-0 genäht. Die Beobachtungszeiträume betrugen 4 und 12 Wochen, als die Meerschweinchen getötet wurden, wurde der Unterkiefer herausdisseziert und der Knochen, der an den Tassen in situ angrenzte, in 10-mm-Blöcke geschnitten. Die Proben wurden in einer 10%igen gepufferten Formalinlösung eingetaucht und für die routinemäßige histologische Untersuchung vorbereitet. Serielle Schnitte (5 µm dick) wurden angefertigt und mit Hämatoxylin-Eosin (H & E) gefärbt, um die Zellen zu erkennen.
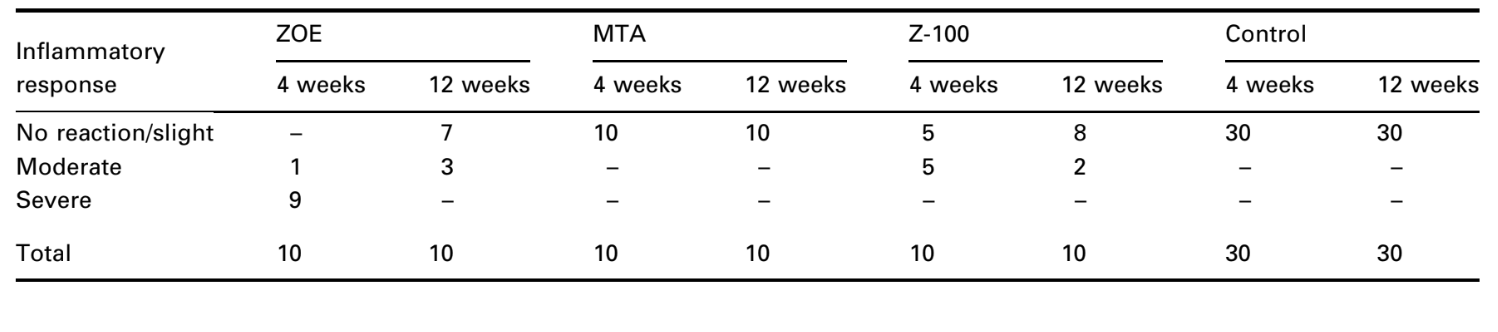
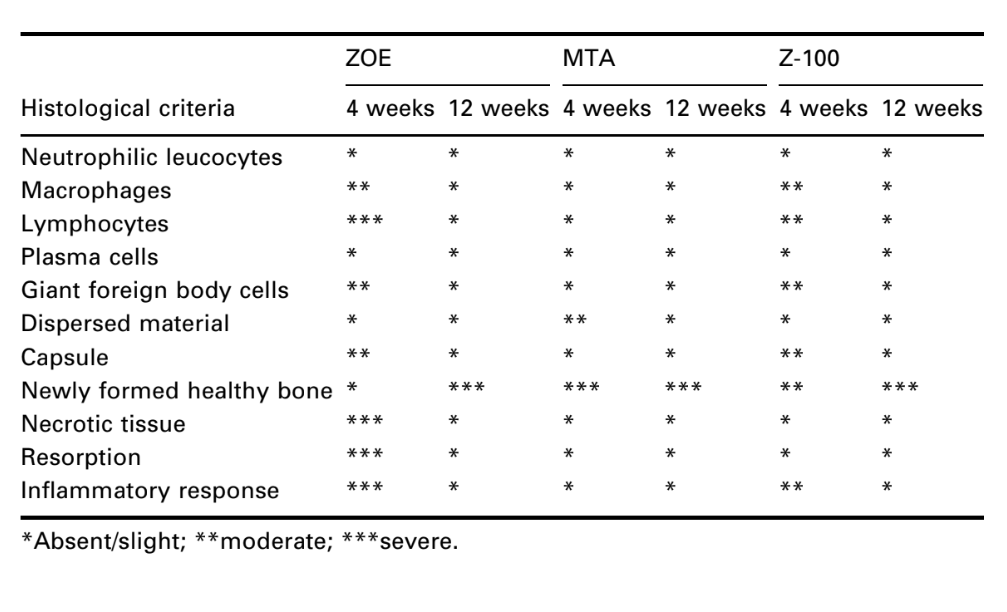
Die Schnittstelle am Öffnung der Tasse, zwischen dem Material und dem Knochen, wurde untersucht und auf die Intensität der Entzündung bewertet. Zehn histologische Kriterien wurden verwendet, um die Entzündungsgrade zu bestimmen – das Vorhandensein oder Fehlen von neutrophilen Leukozyten, Makrophagen, Lymphozyten, Plasmazellen, riesigen Fremdkörperzellen, dispergiertem Material, Kapsel, neu gebildetem gesundem Knochen, nekrotischem Gewebe und Resorption.
Zur Bewertung der Gewebereaktionen wurden zwei unabhängige Beobachter eingesetzt. Das allgemeine Niveau der Geweberreaktion wurde dann als keine bis leichte, moderate und schwere Reaktion gemäß den zuvor definierten histologischen Kriterien bewertet. Es wurde als biologisch akzeptabel angesehen, dass das Material in beiden experimentellen Zeiträumen von 4 und 12 Wochen keine bis leichte Reaktion zeigte oder eine moderate Reaktion bei 4 Wochen, die sich bei 12 Wochen verringerte.
Ergebnisse
Die Anzahl der intraossären Implantate und die Intensität der Entzündungsreaktion sind in Tabelle 2 dargestellt. Die histologischen Bewertungen der Materialien nach 4 und 12 Wochen sind in Tabelle 3 zusammengefasst.
Beobachtungen nach vier Wochen
Negative Kontrolle
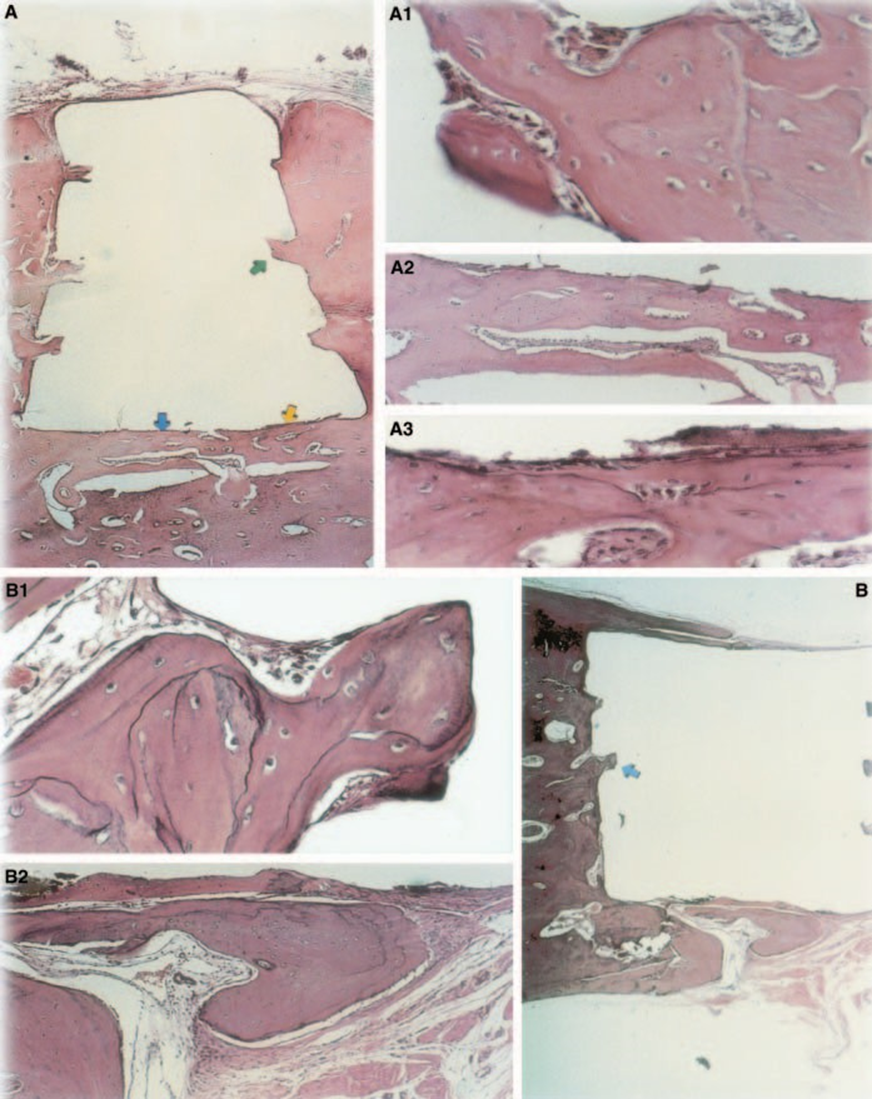
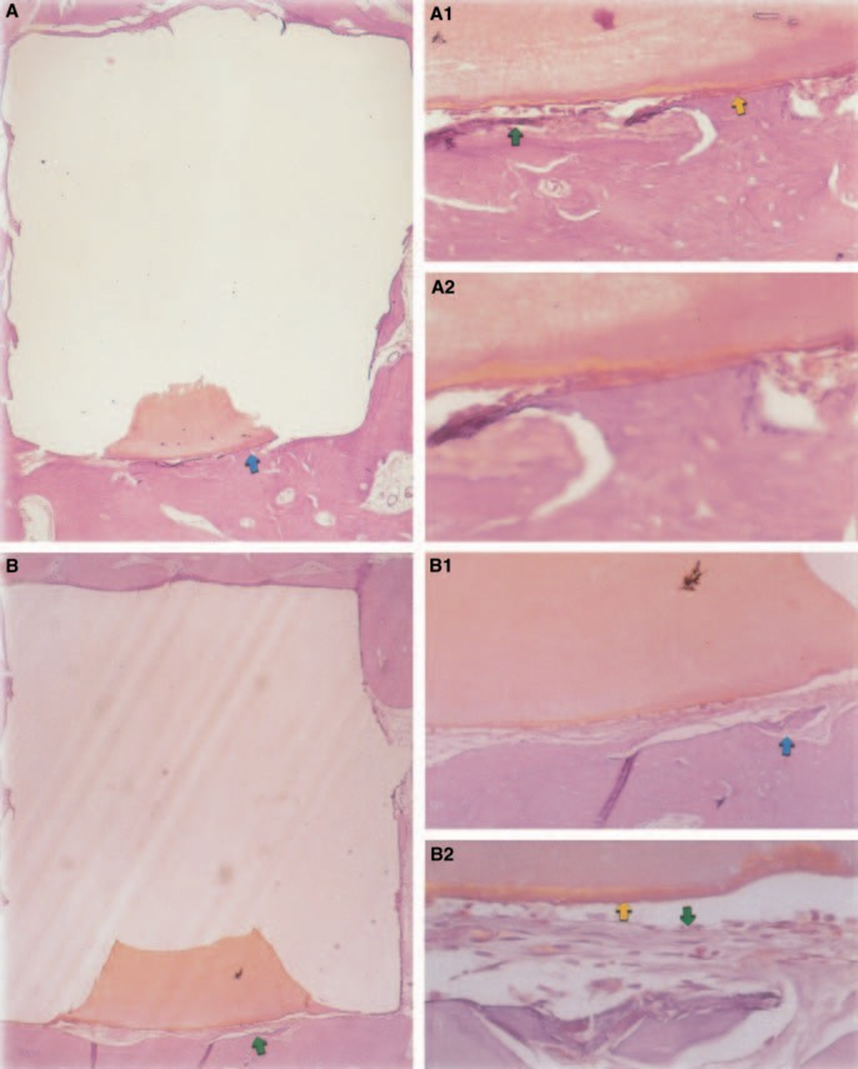
Die Reaktion des Bindegewebes entlang der seitlichen Wand außerhalb der Teflon® Becher aller Proben diente als negative Kontrolle für die Technik. Die Rillen auf der Außenseite der Becher waren mit neuem Knochengewebe gefüllt, und dünne Schichten von Bindegewebe ohne entzündliche Reaktion waren zwischen dem Becher und dem Knochen in allen Beobachtungszeiträumen bei allen Proben zu sehen (Abb. 6A1,A2).
Zinkoxid-Eugenol
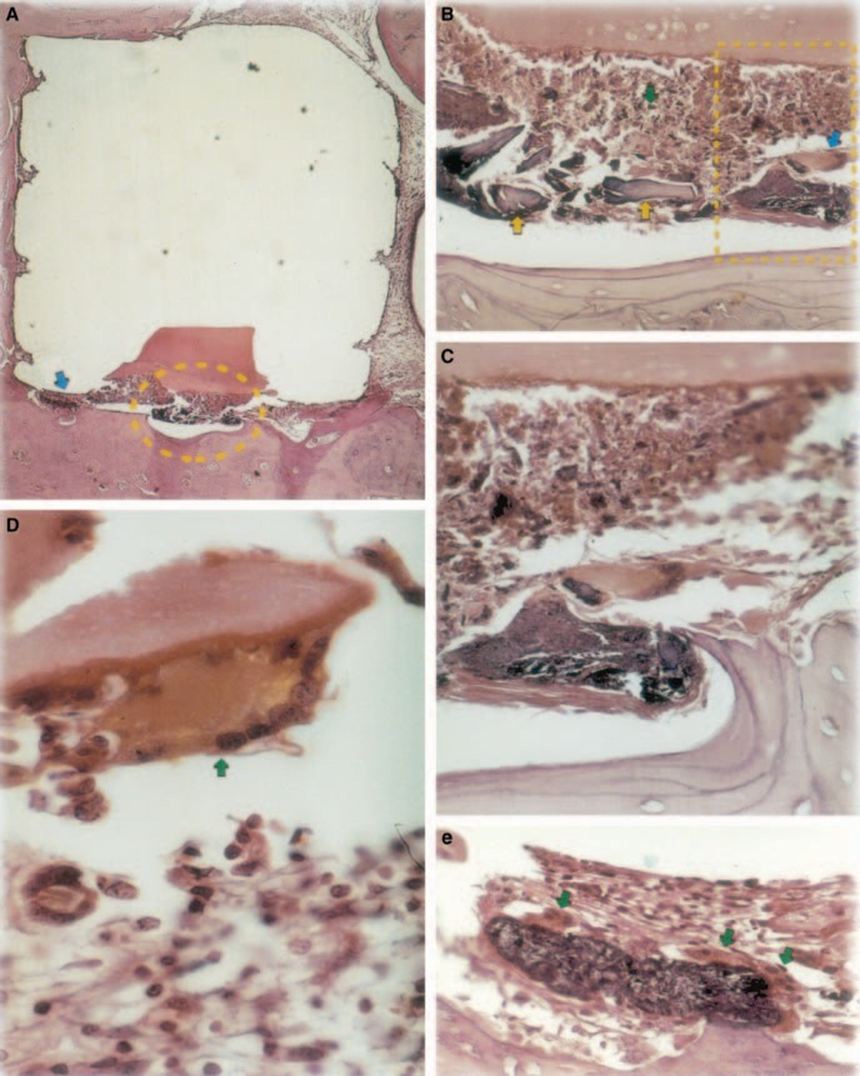
Die Reaktion war schwerwiegend mit Knochennekrose, Resorption, mononukleärem entzündlichem Infiltrat, das durch das Vorhandensein von Lymphozyten, Makrophagen und riesigen Fremdkörperzellen nachgewiesen wurde (Abb. 1C). Das Vorhandensein von Agglomeraten riesiger Fremdkörperzellen, die Material im Zytoplasma und nekrotisches Gewebe enthielten, war häufig (Abb. 1D). Es gab eine größere Ablagerung von Kollagenfasern näher am Knochengewebe als am Material und eine geringe Präsenz von Entzündungszellen (Abb. 1B).
Mineraltrioxidaggregate
Die entzündliche Reaktion wurde als none bis leicht eingestuft. Es gab die Bildung von gesundem Knochen in engem Kontakt mit dem Material (Abb. 3).
Z-100
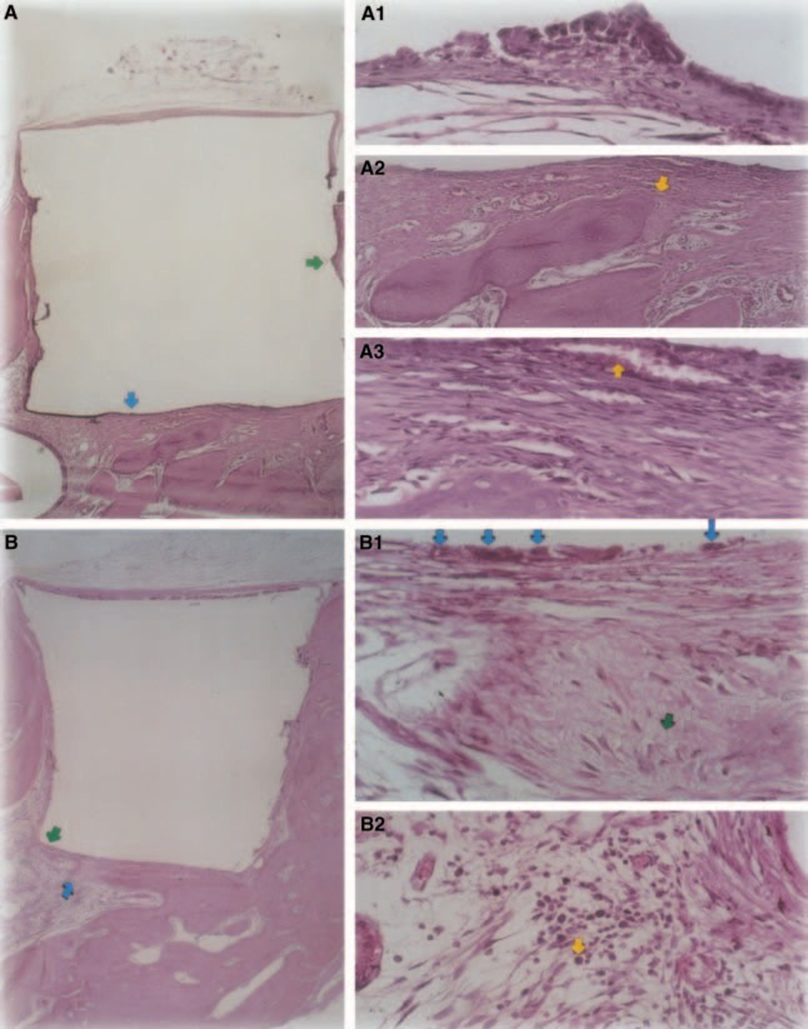
Eine leichte bis moderate entzündliche Reaktion wurde mit dichter Bindegewebsbildung an der Schnittstelle zwischen Material und Knochengewebe beobachtet (Abb. 5A2,B1). Dieses faserige Bindegewebe war reich an Fibroblasten; Gefäße, kein entzündlicher Infiltrat und Mineralgewebsablagerungen konnten beobachtet werden, was auf Knochenbildung hinweist (Abb. 5A3). Das Vorhandensein von Makrophagen und Fremdkörper-Riesen-Zellen in der Nähe des Materials war ein konstantes Ergebnis (Abb. 5A1,B1). In der Nähe des Materials wurde ein moderates chronisches entzündliches Infiltrat beobachtet (Abb. 5B2).
Beobachtungen über zwölf Wochen
Negative Kontrolle
Die Reaktion des Bindegewebes entlang der seitlichen Wand außerhalb der Teflon® Tassen aller Proben diente als negative Kontrolle für die Technik. Es war möglich zu beobachten, dass die Rillen auf der Außenseite der Tassen mit neuem Knochengewebe gefüllt waren, und eine dünne Schicht Bindegewebe ohne entzündliche Reaktion konnte zwischen der Tasse und dem Knochen in allen Beobachtungszeiträumen in allen Proben gesehen werden (Abb. 6A1,A2).
Zinkoxid-Eugenol
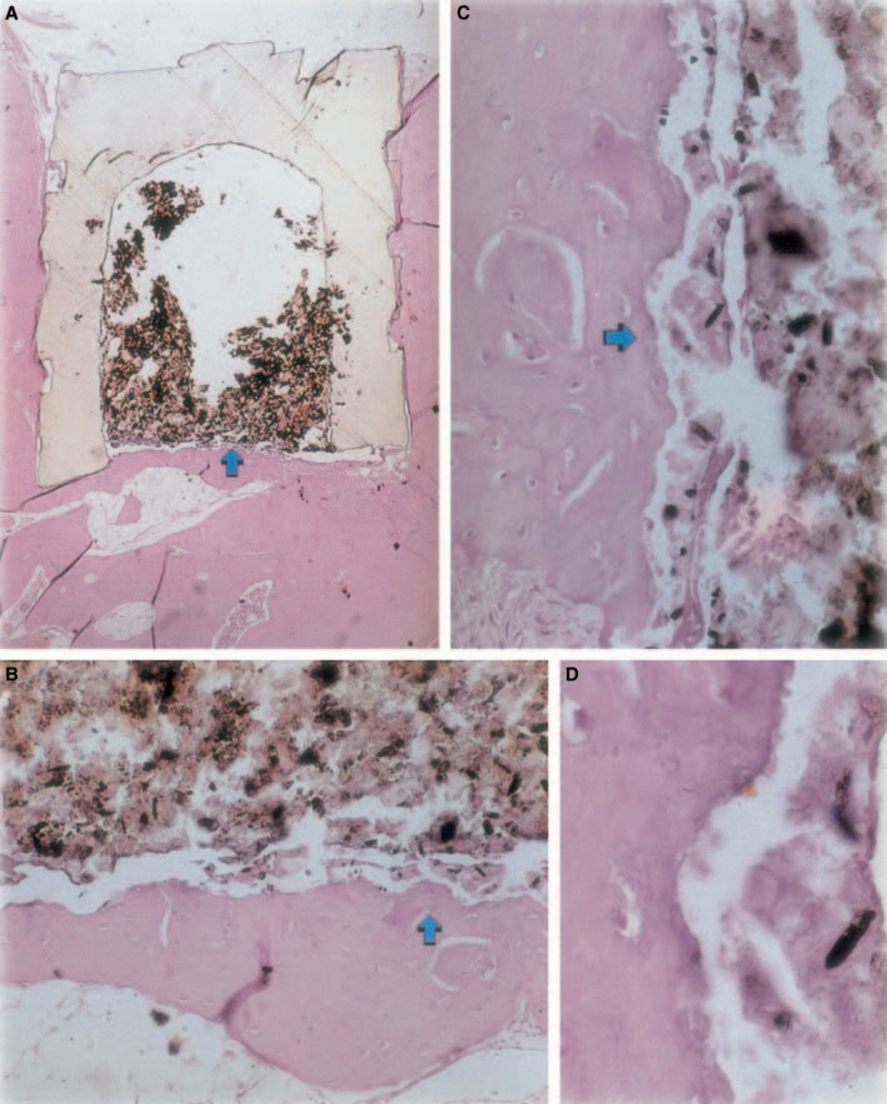
Die entzündliche Reaktion variierte im experimentellen Zeitraum von keiner bis zu leichter. Es gab Knochenbildung an der Schnittstelle (Abb. 2A,B). Der Knochen um die Tasse war gesund und bedeckte sie vollständig. In einigen Fällen gab es eine schmale Schicht Bindegewebe zwischen dem implantierten Material und dem neuen Knochengewebe (Abb. 2A1,A2,B1). Es war jedoch noch eine gewisse Resorption vorhanden (Abb. 2B2).
Mineraltrioxidaggregate
Neues Knochengewebe hatte sich an der Material-Gewebe-Grenze gebildet. Es gab keine signifikante Entzündungsreaktion und wenn vorhanden, waren Makrophagen und riesige Fremdkörperzellen im peripheren Bereich, in engem Kontakt mit der Teflon® Tasse. Gesundes Knochengewebe mit Osteoblasten in engem Kontakt mit dem Material wurde ebenfalls beobachtet (Abb. 4C).
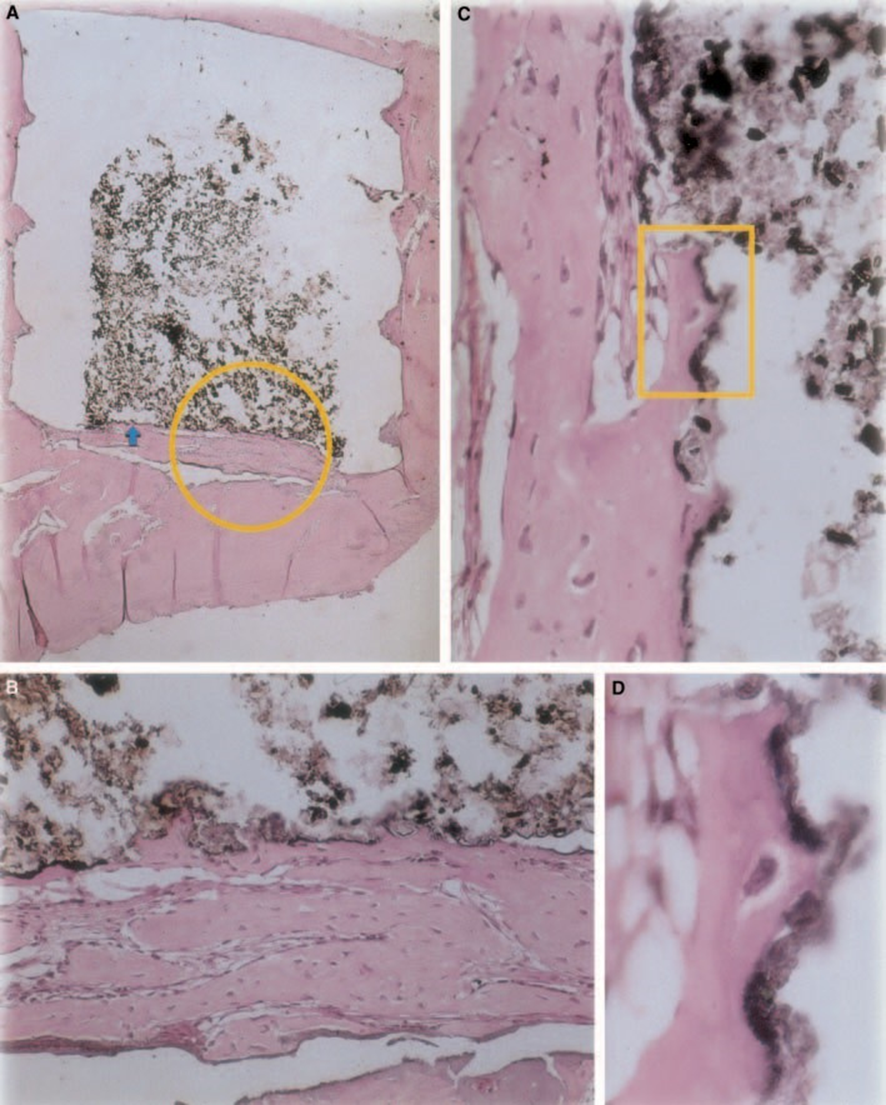
Z-100
Die Dicke des Bindegewebes war an der Schnittstelle signifikant verringert (Abb. 6A,B). Die Anwesenheit von Entzündungszellen war gering, mit Ausnahme von Fremdkörperriesenzellen (Abb. 6A3).
Diskussion
Biokompatibilität ist eine der wichtigsten Eigenschaften eines Materials, das bei der apikalen Wurzelspitzenfüllung verwendet wird, da es dauerhaft mit lebenden Geweben im periapikalen Bereich in Kontakt steht. Eines der Ziele der periradikulären Chirurgie ist es, eine Barriere zwischen dem periapikalen Bereich und physischen und/oder bakteriellen Einflüssen im Wurzelkanalsystem zu schaffen. Die Verwendung eines nicht kompatiblen Wurzelspitzenfüllmaterials wird die Heilung in diesem Bereich beeinträchtigen. Materialien, die bei der apikalen Wurzelspitzenfüllung verwendet werden, müssen neben den notwendigen Voruntersuchungen auch hinsichtlich ihrer biokompatiblen Eigenschaften untersucht werden (Torabinejad & Pitt Ford 1996).
Der Implantat-Test im Gewebe von Meerschweinchen, der von der FDI (1980) empfohlen wird, ermöglicht die Prüfung des Materials, wie es in der klinischen Umgebung verwendet wird, und wird gemäß den Empfehlungen des Herstellers vorbereitet. Obwohl die Ergebnisse nicht direkt auf Menschen extrapoliert werden können, ist der Test standardisiert und ermöglicht einen direkten Vergleich zwischen Materialien. Die Literatur auf diesem Gebiet liefert Ergebnisse aus verschiedenen Laboren, die dieselben Materialien verwenden, um einen Vergleich der Daten zu ermöglichen (Pascon et al. 1987, Andreana et al. 1989, Pascon & Langeland 1989, Barbosa et al. 1993). Die in dieser Studie erzielten Ergebnisse bestätigten die Erkenntnisse anderer, dass jedes Material, das in Kontakt mit Geweben gebracht wird, eine Fremdkörperreaktion hervorruft (Abb. 1D, 5B1 und 6A3).
Die Reaktionen entlang des äußeren Randes des Teflon®-Bechers spiegeln das Trauma wider, das durch die chirurgischen Eingriffe verursacht wurde, die für die Einführung des Teflon® und seines Inhalts erforderlich sind. Teflon® selbst verursacht eine unbedeutende Reizung des Gewebes (Stanley 1985) und wurde aufgrund seiner Biokompatibilität als Trägermaterial verwendet (Spångberg 1969, ADA 1982). Dies wurde durch das Fehlen von Entzündungsreaktionen an der Seitenwand der Träger in beiden Beobachtungszeiträumen bestätigt.
Die entzündliche Reaktion auf ZOE war in beiden Beobachtungszeiträumen signifikant größer als bei den anderen Materialien (Abb. 1 und 2). Diese schwere Reaktion auf ZOE wurde in der Literatur beschrieben (Pascon & Langeland 1989, Gulati et al. 1991, Guigand et al. 1999). Es wurde auch nachgewiesen, dass jedes Material, das Eugenol enthält, eine schwere Gewebereaktion aufgrund der Depression der Zellatmung hervorruft (Hume 1984). Serene et al. (1988) fanden heraus, dass ZOE-Dichtstoffe das Komplementsystem aktivierten und somit eine Entzündungsreaktion auslösten. Die verlängerte entzündliche Reaktion auf ZOE tritt auf, weil die Reaktion zwischen dem Material und den Gewebsflüssigkeiten letztendlich Eugenol aus dem Material freisetzt.
Die präsentierten Ergebnisse bestätigten die von Torabinejad et al. (1997, 1998) berichteten Erkenntnisse zur entzündlichen Reaktion von MTA (Abb. 3 und 4). Diese Autoren testeten dieses Material in den Tibien und Kiefern von Meerschweinchen und als apikale Wurzelspitzenfüllung bei Affen und berichteten über seine Biokompatibilität. Es wurde keine signifikante entzündliche Reaktion beobachtet.
Stabholz et al. (1985) führten Kompositharze als Materialien für apikale Wurzelspitzenfüllungen ein und verglichen ihre physikalischen Eigenschaften mit Silberamalgam, Cavit und Zinkphosphat. In ihrer Arbeit gab es jedoch keine Bedenken hinsichtlich der Gewebereaktion. Als Harze als apikale Wurzelspitzenmaterialien verwendet wurden, reichten die Ergebnisse von schwerer Entzündung (Bruce et al. 1993) bis zu einem hohen Grad an Heilung (Rud et al. 1991).
Die Ergebnisse der vorliegenden Studie sind ähnlich wie die von Rud et al. (1991), die vorschlugen, dass Komposite vielversprechende Biokompatibilität aufwiesen. Obwohl es ein routinemäßiger Befund war, trat das Knochenwachstum in engem Kontakt mit dem Z-100 auf, wahrscheinlich als Ergebnis seiner geringen Toxizität (Abb. 6A2,B2).
Schlussfolgerungen
- Das Toxizitätsniveau der getesteten Materialien nahm mit der Zeit ab.
- Der auf ZOE basierende Zement war während des 4-wöchigen Versuchszeitraums hochtoxisch, aber dieses Profil änderte sich signifikant nach 12 Wochen, als er biokompatible Eigenschaften zeigte.
- Alle untersuchten Materialien, mit Ausnahme von ZOE, wiesen in den beiden analysierten Zeiträumen akzeptable Biokompatibilitätsniveaus auf.
- MTA zeigte ausgezeichnete biologische Eigenschaften mit Knochenwachstum in engem Kontakt mit dem Material und ohne dazwischenliegendes Bindegewebe.
- Das MTA und Z-100 wiesen in diesem sekundären Test Biokompatibilität auf.
Autoren: C. J. A. Sousa, A. M. Loyola, M. A. Versiani, J. C. G. Biffi, R. P. Oliveira, E. A. Pascon
Literaturverzeichnis
- ADA (1982) Biologische Bewertung von Dentalmaterialien. American Dental Association, New York, Dokument Nr. 41.
- Andreana S, Pascon EA, Langeland K (1989) Reaktion des Knochengewebes auf Hemofibrin [Abstract]. Journal of Dental Research 68, 381.
- Barbosa SV, Araki K, Spångberg LS (1993) Zytotoxizität einiger modifizierter Wurzelkanaldichtstoffe und ihrer löslichen Komponenten. Oral Surgery, Oral Medicine and Oral Pathology 75, 357–61.
- Bruce GR, McDonald NJ, Sydiskis RJ (1993) Zytotoxizität von Retrofill-Materialien. Journal of Endodontics 19, 288–92.
- FDI (1980) Empfohlene Standardpraktiken für die biologische Bewertung von Dentalmaterialien. Federation Dentaire Internationale, London, Technischer Bericht Nr. 9.
- Gartner AH, Dorn, SO (1992) Fortschritte in der endodontischen Chirurgie. Dental Clinics of North America 36, 357–78.
- Guigand M, Pellen-Mussi P, LeGolff A, Vulcain J-M, Bonnaure-Mallet M (1999) Bewertung der Zytokompatibilität von drei endodontischen Materialien. Journal of Endodontics 25, 419–23.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M (1991) Zytotoxizität von Eugenol in Dichtstoffen, die Zinkoxid enthalten. Endodontics and Dental Traumatology 7, 181–5.
- Hume WR (1984) Wirkung von Eugenol auf Atmung und Teilung von menschlichem Zahnmark, Mausfibroblasten und Leberzellen in vitro. Journal of Dental Research 63, 1262–5.
- Pascon EA, Langeland K (1989) Zytotoxizität eines neuen endodontischen Dichtstoffs [Abstract]. Journal of Dental Research 68, 244.
- Pascon EA, Spångberg L, Langeland K (1987) Zytotoxizität von endodontischen Dichtstoffen [Abstract]. Journal of Dental Research 66, 200.
- Pascon EA, Sousa CJA, Langeland K (2001) Biokompatibilität von endodontischen Materialien: Zytotoxizität eines aus Rizinusöl abgeleiteten Polyurethanharzes. Brazilian Endodontic Journal 5, 5–12.
- Rud J, Munksgaard EC, Andreasen JO, Rud V, Asmussen E (1991) Retrograde Wurzelfüllung mit Komposit und einem Dentin-Bonding-Mittel. Teil 1. Endodontics and Dental Traumatology 7, 118–25.
- Serene TP, Vesely J, Boackle RJ (1988) Aktivierung des Komplements als mögliche in vitro-Indikation des entzündlichen Potenzials von endodontischen Materialien. Oral Surgery, Oral Medicine and Oral Pathology 65, 354–7.
- Spångberg L (1969) Biologische Effekte von Wurzelkanalfüllmaterialien. Teil 7. Reaktion des Knochengewebes auf implantiertes Wurzelkanalfüllmaterial bei Meerschweinchen. Odontologisk Tidskrift 77, 133–59.
- Stabholz A, Friedman S, Abed J (1985) Marginale Anpassung von retrograden Füllungen und deren Korrelation mit der Dichtheit. Journal of Endodontics 11, 218–23.
- Stanley HR (1985) Toxizitätstests von Dentalmaterialien, 1. Auflage. Miami, FL, USA: CRC Press.
- Tassery H, Pertot WJ, Camps J, Proust JP, Déjou J (1999) Vergleich von zwei Implantationsstellen zur Prüfung der intraossären Biokompatibilität. Journal of Endodontics 25, 615–8.
- Torabinejad M, Pitt Ford TR (1996) Wurzelspitzenfüllmaterialien: eine Übersicht. Endodontics and Dental Traumatology 12, 161–78.
- Torabinejad M, Pitt Ford TR, McKendry DJ, Abedi HR, Miller DA, Kariyawasam SP (1997) Histologische Bewertung von Mineraltrioxidaggregat als Wurzelspitzenfüllung bei Affen. Journal of Endodontics 23, 225–8.
- Torabinejad M, Pitt Ford TR, Abedi, HR, Kariyawasam SP, Tang HM (1998) Gewebereaktion auf implantierte Wurzelspitzenfüllmaterialien in der Tibia und dem Unterkiefer von Meerschweinchen. Journal of Endodontics 24, 468–71.
