Poly(ε-Caprolacton) und Polyethylenglykol-Diacrylat-basierte Gerüste für bioengineerte Disc-Implantate im Kiefergelenk
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Das Kiefergelenk (TMJ), die Verbindung zwischen dem mandibulären Kondylus und dem Schläfenbein, ist durch eine fibrocartilaginöse Scheibe in zwei Kompartimente (oberes und unteres) unterteilt. Die TMJ-Scheibe besteht aus einem avaskulären und nicht innervierten Gewebe mit viskoelastischem Verhalten. Mechanisch erfährt die TMJ-Scheibe Zug-, Druck- und Scherkräfte. Eine Verschiebung oder Degeneration der TMJ-Scheibe könnte zu schweren intraartikulären Kiefergelenkstörungen (TMD) führen. Trotz der großen Anzahl aktueller Therapien/Behandlungen gibt es nur begrenzte Behandlungsoptionen für schwere intraartikuläre TMD. Eine Strategie zur Lösung dieses Problems könnte die Verwendung eines Interpositionsmaterials sein, um die beschädigte TMJ-Scheibe zu ersetzen, das allmählich abgebaut wird und neues Gewebe hervorbringt. In dieser Arbeit wurden drei Optionen verwendet und getestet, eine mit einem thermoplastischen Material, Poly(ε-Caprolacton) (PCL), eine andere mit einem photopolymerisierbaren Hydrogel, Polyethylenglykol-Diacrylat (PEGDA), und die dritte mit der Kombination der beiden Materialien. Die erzielten Ergebnisse zeigten, dass die Kombination verschiedener Materialien einen erheblichen Vorteil in der TMJ-Scheiben-TE und in der Knorpel-TE im Allgemeinen darstellen könnte.
Einführung
Das Kiefergelenk (TMJ) ist eine bilaterale Verbindung zwischen dem Kondylenprozess des Unterkiefers und der mandibulären Fossa sowie dem Gelenktuberkel des Schläfenbeins. Ein fibrocartilaginöser Diskus ist zwischen den knöchernen Strukturen eingeklemmt, die an der fibrosen Kapsel an ihrem Rand befestigt sind, was das Gelenk in zwei Höhlen unterteilt: superior und inferior.
Der TMJ-Diskus besteht aus einem avaskulären, nicht innervierten, fibrocartilaginösen Gewebe mit viskoelastischem Verhalten. Der Diskus hat eine elliptische Form, die in der mediolateralen Richtung länger ist als in der anteroposterioren Richtung (19 und 13 mm respektive beim Menschen). Anatomisch kann der TMJ-Diskus in drei Regionen unterteilt werden: vorderes Band, intermediäre Zone und hinteres Band. Die intermediäre Zone ist erheblich dünner als die Bänder (≈1 mm beim Menschen), und das hintere Band ist die dickste Region des Diskus (≈4 mm beim Menschen). Der Hauptanteil des TMJ-Diskus besteht aus Wasser (≈73 %). Neben Wasser besteht der TMJ-Diskus aus Zellen (Fibroblasten, Fibrozyten und chondrozytenähnlichen Zellen, mit runder Form) und einer extrazellulären Matrix (ECM) aus dichten Kollagenfasern (≈80 % des Trockengewichts), elastischen Fasern (≈2 %) und Glykosaminoglykanen.
Diese bikonkave Form passt zur Knochenanatomie des Gelenks und ist entscheidend für die Funktionen des Kiefergelenks (TMJ). Wie in anderen Gelenken reduziert der TMJ-Scheiben die Reibung im Gelenk und verteilt die intraartikuläre Last. Darüber hinaus hilft sie bei der Ausrichtung und Stabilisierung des Gelenks während der Rotation und Translation aufgrund der Flexibilität, die durch den intermediären Bereich bereitgestellt wird. Die TMJ-Scheibe hat ein viskoelastisches Verhalten und erfährt Zug-, Druck- und Scherkräfte. Die berichteten Druckeigenschaften der TMJ-Scheibe sind äußerst inkonsistent und reichen von Dutzenden bis zu Zehntausenden von kPa. In Bezug auf verschiedene Regionen scheinen die vorderen und hinteren Bänder höhere Druckeigenschaften als die intermediäre Zone zu haben.
Die Degeneration und Verschiebung der TMJ-Scheibe kann zu Kiefergelenksstörungen (TMD) führen. Es wird geschätzt, dass 25% der Bevölkerung Symptome von TMD erleben können, wie: Schmerzen im Gelenk und in den umliegenden Muskeln; Klickgeräusche; Unbehagen beim Bewegen des Kiefers; Zähneknirschen. Die Mehrheit der TMD wird erfolgreich mit nicht-invasiven Behandlungen (z.B.: Physiotherapie, okklusale Schienen/Einstellungen und Pharmakologie) behandelt, aber in einigen Fällen ist es notwendig, auf chirurgische Eingriffe zurückzugreifen (z.B.: Arthrozentese, Arthroskopie, Discopexie, Diskektomie und totale Gelenkersatz).
Die äquivalente Anatomie zum menschlichen Kiefergelenk (TMJ) wurde bei verschiedenen Tieren untersucht. Zu den häufigsten Modellen gehören Schwein, Schaf, Ziege, Kuh, Hund, Ratte und Kaninchen. In dieser Arbeit wurde die Geometrie der TMJ-Scheibenimplantate durch Reverse Engineering der TMJ-Scheibe von Black Merino-Schafen (Ovies aries) gewonnen.
In den letzten zwei Jahrzehnten hat das Gebiet der Gewebeengineering (TE) für TMJ-Scheiben als vielversprechende Lösung für die Kiefergelenksdysfunktion (TMD) zugenommen, mit dem Ziel der Reparatur und Regeneration der Scheibe. Verschiedene Ansätze wurden entwickelt, mit oder ohne Gerüste, einer Vielzahl unterschiedlicher Materialien und der Einbeziehung einiger Wachstumsfaktoren.
Die in der TMJ-Scheiben-TE verwendeten Gerüste wurden aus Polyamid, Polyglykolsäure (PGA), Poly(glycerol sebacate) (PGS), Polymilchsäure (PLA), Poly-L-Milchsäure (PLLA), Polytetrafluorethylen (PTFE) und anderen natürlichen Biomaterialien, wie Kollagenhydrogel und aus dezelularisierten Schweine-TMJ-Scheiben, hergestellt. In den letzten Jahren wurden aufgrund ihrer langsamen Abbaurate Poly(ɛ-Caprolacton) (PCL) Gerüste und Schäume umfassend untersucht, wobei die langsame Regenerationsrate des Faserknorpels berücksichtigt wurde.
Diese Arbeit konzentriert sich auf die Entwicklung eines auf PCL und PEGDA basierenden Gerüsts für ein bioengineering TMJ-Scheibenimplantat, mit Eigenschaften, die dem nativen Gewebe nahekommen, hergestellt mit Rapid-Prototyping-Techniken und einem praktikablen chirurgischen Ansatz.
Materialien & Methoden
Verschiedene Gerüste wurden unter Verwendung von Reverse Engineering und additiven Fertigungstechniken hergestellt, um das TMJ-Scheiben-ECM zu ersetzen und die Regeneration zu fördern. In dieser Untersuchung wurden drei Arten von 3D-Matrizen produziert: i) PEGDA-Hydrogel durch Photopolymerisation, ii) PCL-Gerüste unter Verwendung von Fused Deposition Modeling (FDM), iii) Kombination aus beidem.
Produktion von Poly (ɛ-Caprolacton) Gerüsten
Poly (ɛ-Caprolacton) (PCL) ist ein biokompatibler und biologisch abbaubarer Polyester (12-24 Monate), der gezeigt hat, dass er in der Lage ist, eine Vielzahl von Zelltypen zu unterstützen, und es ist ein von der Food and Drug Administration (FDA) zugelassenes Material. Der Extrusionsprozess oder Fused-Deposition-Modeling (FDM) besteht aus der Extrusion eines (thermo)plastischen Materials oder Wachs, in diesem Fall PCL (als Filament oder Pellets), durch eine Düse, die die beabsichtigte Schicht schichtweise aufbaut. Widerstandsheizungen, die den Zuführkanal und die Düse umgeben, werden verwendet, um das Material knapp über seinem Schmelzpunkt (etwa 60ºC für PCL) zu halten. Dies ermöglicht es dem Material, leicht durch die Düse zu fließen, sich mit der darunter liegenden Schicht zu verbinden und eine schnelle Verfestigung zu erreichen.
Im ersten Experiment wurde der Einfluss der Düsentemperatur auf das mechanische Verhalten der Gerüste untersucht. So wurden PCL 6500 (Perstorp) Gerüste (n=4) mit der BioExtruder-Maschine (CDRSP, Leiria, Portugal) bei einer Düsentemperatur von 80ºC (Gruppe T80) und 86ºC (Gruppe T60) hergestellt. Darüber hinaus lagen die Temperaturen des Depots und des Lauf-/Gießsystems bei jeweils 80ºC und 100ºC, die verwendete Düse hatte einen Durchmesser von 300 μm und die Absetz- und Querkopfgeschwindigkeiten betrugen jeweils 14,5 U/min und 10 mm∙s-1. Die endgültigen PCL-Gerüste, deren Geometrie durch Reverse Engineering einer Schaf-TMJ-Scheibe gewonnen wurde, hatten eine Basis von 278 ± 2 mm2 und eine Schnittdicke von 280 μm.
Herstellung von PEGDA-Hydrogelen
Poly(ethylenglykol), PEG, ist eine biokompatible, hydrophile, neutrale und hochmobile Polymerkette, die in der Gewebeengineering von Knochen und Knorpel sowie in anderen biomedizinischen Anwendungen, wie kontrollierten Arzneimittelfreisetzungssystemen, verwendet wurde. Poly(ethylenglykol)diacrylat, PEGDA, ist ein PEG-Derivat, das leicht in Hydrogelen durch Photopolymerisation unter Verwendung von biokompatiblen Photoinitiatoren, wie DMPA (2,2-Dimethoxy-2-phenyl- acetophenon), und durch Bestrahlung mit UV-Licht langer Wellenlängen, das die Vernetzung induziert, verarbeitet werden kann.
PEGDA (Sigma-Aldrich) Hydrogele (n=4) wurden mit zwei verschiedenen Konzentrationen hergestellt, 20% (Gruppe H20) und 30%w/V (Gruppe H30), mit 2-[4-(2-hydroxyethyl) piperazin-1-yl]ethansulfonsäure (HEPES) Puffer (Sigma-Aldrich). Die Photopolymerisation wurde durch 0,1% w/V 2,2-dimethoxy-1,2-diphenylethanon (DMPA, Sigma-Aldrich) Photoinitiator bei UV-Licht (365 nm) Exposition induziert. Eine geeignete Form des Kiefergelenkdisks wurde durch die Verwendung eines speziell zu diesem Zweck entwickelten Schneidwerkzeugs erzielt.
Oberflächenbehandlung
Um die Hydrophilie der PCL-Gerüste zu verbessern, wurden zwei Hauptstrategien durchgeführt: i) 4 Gerüste (aus der Gruppe T86) wurden für etwa 24 Stunden in einer 1M Natriumhydroxid (NaOH) Lösung platziert (PNaOH); ii) weitere 4 Gerüste (aus der Gruppe T80) wurden vor der Photopolymerisation in einer PEGDA-Lösung platziert (PH).
Mechanische Tests
Das mechanische Verhalten der Gerüste und Hydrogele wurde durch uniaxiale unkonfined Kompressionstests mit einer universellen Prüfmaschine unter Verwendung einer Dehnungsrate von 1 mm.min-1 bewertet. Vor den mechanischen Tests wurde die Fläche jedes Gerüsts mit der Software ImageJ2 bestimmt. Die Kraft, F (N) und die Deformation (mm) wurden zu jedem Zeitpunkt während der Tests aufgezeichnet und die Druckspannung sowie die Dehnungswerte wurden bestimmt, um die Spannungs-Dehnungs-Diagramme zu erstellen. Somit wurde der elastische Druckmodul gemäß der Steigung des anfänglichen linearen Bereichs der geplotteten Kurven geschätzt.
Statistische Analyse
Univariate deskriptive Statistiken (Mittelwert und Standardabweichung) des mechanischen Verhaltens wurden für jede Gruppe bestimmt. Die signifikanten Unterschiede zwischen den Gruppen wurden durch eine einweg ANOVA bewertet. Post-hoc-Tests (Tukey-Test) wurden durchgeführt, um signifikante Unterschiede (p<0,05) für verschiedene Düsentemperaturen während der Produktion und für die oberflächliche Behandlung in Gerüsten sowie für die unterschiedlichen PEGDA-Konzentrationen im Fall von Hydrogelen zu identifizieren. Diese Tests wurden mit GraphPad Prism 6 (GraphPad Software, Inc.) und Excel 2016 (Microsoft Corporation) durchgeführt. ImageJ2 (öffentlicher Bereich) wurde verwendet, um die Flächen der Gerüste und Hydrogelen zu bestimmen.
Ergebnisse & Diskussion
Mit dem Bioextruder sind wir in der Lage, reproduzierbare Gerüste (maximal 26 x 13 x 4 mm) mit der beabsichtigten Geometrie erfolgreich zu produzieren, die durch die Verwendung der Reverse Engineering eines nativen Disks erhalten wurde (Abb. 1).

Bewertung des Einflusses der Düsentemperatur
PCL TMJ-Scheibengerüste wurden erfolgreich unter Verwendung der beiden unterschiedlichen Düsentemperaturen hergestellt. Die durch uniaxiale unkonfined Kompressionstests erhaltenen Ergebnisse zeigen, dass es signifikante Unterschiede zwischen den beiden Gruppen gibt (p<0.05) (siehe Abb. 3). Die Gruppen T80 und T86 wiesen einen elastischen Modul von 31.8 ± 1.5 MPa bzw. 23.9 ± 1.8 MPa auf.
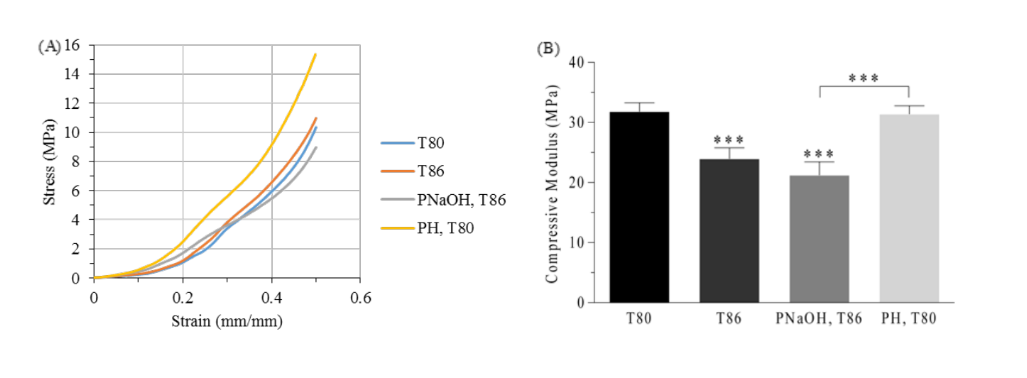
Nach der Literatur beeinflusst die Temperatur direkt die Straßenbreite, was die endgültige Porosität (höhere Temperaturen führen zu einer niedrigeren Porosität) der Strukturen beeinflusst und folglich ihr mechanisches Verhalten. Eine niedrigere Temperatur ermöglicht es dem Material, schneller zu erstarren, wodurch mögliche Änderungen in der Geometrie der Gerüste reduziert werden. Diese Änderungen können bei höheren Produktionstemperaturen auftreten, da das Material, das sich in einem viskosen Zustand befindet, von der Schwerkraft beeinflusst wird und die Gerüste leicht flach werden. Dieses Experiment steht im Einklang mit dem erwarteten Ergebnis.
Bewertung des Einflusses der PEGDA-Konzentration auf die mechanischen Eigenschaften von Hydrogelen
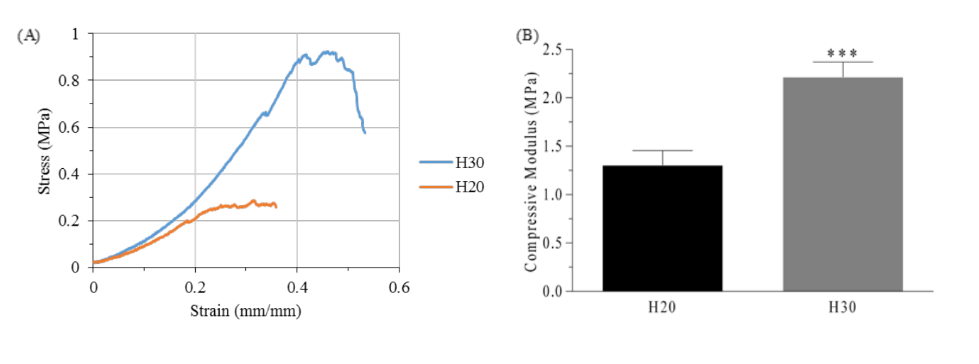
Wie in Abbildung 2 gezeigt, gibt es signifikante Unterschiede zwischen den beiden Gruppen von Hydrogelen (p<0.05). Die mit einer PEGDA-Konzentration von 20% w/V produzierten Hydrogelen wiesen fast die Hälfte des Druckmoduls und ein Drittel der maximalen Festigkeit (1.30 ± 0.15 MPa und 0.30 ± 0.03 MPa, respektive) im Vergleich zu den mit 30% w/V PEGDA produzierten Hydrogelen (2.21 ± 0.16 MPa und 1.01 ± 0.11 MPa) auf. Trotz dessen zeigten die Hydrogelen der Gruppe H30 eine hohe Sprödigkeit beim Biegen oder Ziehen. Daher wurden zur Herstellung der Gerüste der Gruppe PH Hydrogelen verwendet, die denen der Gruppe P20 ähnlich waren.
Einfluss der Oberflächenbehandlung
Die Oberflächenbehandlung der PCL-Gerüste führte nicht zu signifikanten Unterschieden im mechanischen Verhalten der Gerüste. Der Druckmodul der PNaOH-Gruppe (21,2 ± 2,2 MPa) nahm im Vergleich zur Kontrollgruppe (T86) leicht ab, aber diese Unterschiede waren nicht signifikant (p>0,05). Der leichte Rückgang der mechanischen Eigenschaften ist auf die Oberflächendegradation zurückzuführen, die durch die NaOH-Lösung gefördert wird - der Durchmesser der Filamente wird unregelmäßig entlang der Faser verringert. Somit verlieren die Gerüste an Masse und ihre Porosität nimmt zu, was zu einem Rückgang ihrer mechanischen Eigenschaften bei Druck führt.
Andererseits führte die Zugabe von Hydrogel in der Gruppe PH nicht zu signifikanten Unterschieden bei den elastischen Druckmoduli (31,4 ± 1,4 MPa) im Vergleich zur Kontrollgruppe (T80). Außerdem scheint das Hydrogel die Schmierung und Flexibilität der Gerüste signifikant zu erhöhen und könnte bei der Zelladhäsion helfen, aufgrund der Erhöhung ihrer Hydrophilie.
Die Verwendung von PCL in der Knorpel-TE, insbesondere im faserknorpeligen Gewebe des Kiefergelenkdisks, ist neu. Obwohl die ursprüngliche Hydrophobizität von PCL, die Oberflächenbehandlung mit NaOH könnte seine Hydrophilie und Zelladhäsion aufgrund der Oberflächenunregelmäßigkeit verbessern. Darüber hinaus ist die Einbeziehung von PEGDA-Hydrogel ein avantgardistischer Ansatz und könnte die richtige Richtung für ein erfolgreiches bioengineering Implantat des Kiefergelenkdisks weisen. Die Kombination von zwei verschiedenen Biomaterialien (und den damit verbundenen Produktionstechnologien) kann erhebliche Vorteile in der Kiefergelenkdisk-TE mit sich bringen. In diesem Ansatz bietet PCL den notwendigen mechanischen Widerstand und seine langsame Abbaurate ist mit der langsamen Wachstumsrate des faserknorpeligen Gewebes kompatibel, während das PEGDA-Hydrogel die Zelladhäsion fördert, die Schmierung des Implantats erhöht und die Integration von Wachstumsfaktoren ermöglicht. Obwohl PCL eine höhere Steifigkeit als das native Kiefergelenkgewebe aufweist, könnte dies in der Chirurgie von Vorteil sein, da es eine einfachere Platzierung des Implantats ermöglicht, die Zeit reduziert und eine weniger invasive Chirurgie erlaubt.
Fazit
Der TMJ-Scheiben-TE zielt darauf ab, eine Alternative zu den aktuellen Behandlungen von TMD aufgrund der Scheibendegeneration anzubieten. Somit ist es möglich, verschiedene Materialien zu kombinieren, um ein bioengineering Implantat zu produzieren, das die Eigenschaften des nativen Gewebes besser nachahmt.
In dieser Studie haben wir erfolgreich ein PCL- und PEGDA-basiertes Gerüst für das bioengineered TMJ-Scheibenimplantat hergestellt. Aufgrund der langsamen Abbaurate von PCL ist dieses Material mit der langsamen Wachstumsrate des TMJ-Scheibengewebes kompatibel. Darüber hinaus bietet PCL wichtige mechanische Eigenschaften für das Gerüst, und seine relative Steifigkeit könnte während der Operation einen Vorteil darstellen. Andererseits fördert PEGDA-Hydrogel die Zelladhäsion und bietet Schmierung. Somit sind die Funktionen der TMJ-Scheibe gewährleistet: i) die Schmierung ermöglicht eine Reduzierung der Reibung im Gelenk; ii) die Verteilung der intraartikulären Last wird durch die Geometrie des Gerüsts und die mechanischen Eigenschaften der Materialien sichergestellt; ii) die Implantatgeometrie ermöglicht die Ausrichtung und Stabilisierung des Gelenks.
Zusammenfassend hat diese Arbeit gezeigt, dass die Kombination verschiedener Materialien einen signifikanten Fortschritt in der Tissue Engineering des TMJ-Diskus und im Knorpel-Tissue Engineering im Allgemeinen darstellen könnte.
Autoren: Luís Francisco, Carla Moura, Tânia Viana, David Ângelo, Pedro Morouço, Nuno Alves
Referenzen:
- VanPutte, C., Regan, J., Russo, A., Seeley, R., Stephens, T. und Tate, P., Seeley's Anatomy & Physiology, 10. Auflage, New York, USA, 2014
- Athanasiou, K. A., Almarza, A. A., Detamore, M. S. und Kalpakci, K. N., Tissue Engineering of Temporomandibular Joint Cartilage, 2009
- Stankovic, S., Vlajkovic, S., Boskovic, M., Radenkovic, G., Antic, V. und Jevremovic, D., Morphologische und biomechanische Merkmale des Diskus des Kiefergelenks: ein Überblick über aktuelle Erkenntnisse, Arch Oral Biol, 58 (2013) 1475-82
- Kalpakci, K. N., Willard, V. P., Wong, M. E. und Athanasiou, K. A., Ein interspezifischer Vergleich des Diskus des Kiefergelenks, J Dent Res, 90 (2011) 193-8
- Matuska, A. M., Muller, S., Dolwick, M. F. und McFetridge, P. S., Biomechanische und biochemische Ergebnisse der Deformation des Diskus des Schweine-Kiefergelenks, Arch Oral Biol, 64 (2016) 72-9
- Fazaeli, S., Ghazanfari, S., Everts, V., Smit, T. H. und Koolstra, J. H., Der Beitrag von Kollagenfasern zu den mechanischen Druckeigenschaften des Diskus des Kiefergelenks, Osteoarthritis Cartilage, 24 (2016) 1292-301
- Kuo, J., Zhang, L., Bacro, T. und Yao, H., Die regionsabhängigen biphasischen viskoelastischen Eigenschaften der menschlichen Kiefergelenkscheiben unter eingeschränkter Kompression, J Biomech, 43 (2010) 1316-21
- Tanaka, E. und Eijden, T. v., Biomechanisches Verhalten des Diskus des Kiefergelenks, Crit Rev Oral Biol Med, 14 (2003) 138-150
- Beek, M., Aarnts, M. P., Koolstra, J. H., Feilzer, A. J. und Eijden, T. M. G. J. v., Dynamische Eigenschaften des menschlichen Kiefergelenkscheiben, J Dent Res, 80 (2001) 876-880
- Willard, V. P., Kalpakci, K. N., Reimer, A. J. und Athanasiou, K. A., Der regionale Beitrag von Glykosaminoglykanen zu den kompressiven Eigenschaften des Diskus des Kiefergelenks, J Biomech Eng, 134 (2012) 011011
- Ingawale, S. und Goswami, T., Kiefergelenk: Störungen, Behandlungen und Biomechanik, Ann Biomed Eng, 37 (2009) 976-96
- Murphy, M. K., MacBarb, R. F., Wong, M. E., A., K. und Athanasiou, K. A., Störungen des Kiefergelenks: Eine Übersicht über Ätiologie, klinische Behandlung und Strategien des Tissue Engineering, Int J Oral Maxillofac Implants, 28 (2013) e393–e414
- Herring, S. W., TMJ-Anatomie und Tiermodelle, J Musculoskelet Neuronal Interact, 3 (2003) 391
- Bermejo, A., González, O. und González, J. M., Das Schwein als Tiermodell für Experimente am temporomandibulären Gelenkkomplex, Oral Surc Oral Med Oral Pathol, 75 (1993) 18-23
- Angelo, D. F., Morouco, P., Alves, N., Viana, T., Santos, F., Gonzalez, R., Monje, F., Macias, D., Carrapico, B., Sousa, R., Cavaco-Goncalves, S., Salvado, F., Peleteiro, C. und Pinho, M., Auswahl von Schafen (Ovis aries) als Tiermodell für die Forschung am Kiefergelenk: Morphologische, histologische und biomechanische Charakterisierung des Gelenkdisks, Morphologie, 100 (2016) 223-233
- Mehrotra, D., TMJ-Bioengineering: Eine Übersicht, J Oral Biol Craniofac Res, 3 (2013) 140-5
- Hunter, C. J., Fibrocartilage Tissue Engineering, in: J. A. Burdick und R. L. Mauck (Hrsg.), Biomaterialien für Anwendungen im Tissue Engineering: Ein Rückblick auf vergangene und zukünftige Trends, Springer, NewYork, 2011, S. 363-389
- Allen, K. D. und Athanasiou, K. A., Auswahl von Gerüst und Wachstumsfaktoren im Tissue Engineering des Diskus des Kiefergelenks, J Dent Res, 87 (2008) 180-185
- Juran, C. M., Dolwick, M. F. und McFetridge, P. S., Ingenieurmikroporosität: Verbesserung des frühen regenerativen Potenzials von dezelularisierten Kiefergelenkscheiben, Tissue Eng Part A, 21 (2015) 829-39
- Springer, I. N. G., Fleiner, B., Jepsen, S. und Açil, Y., Kultur von Zellen aus dem Knorpel des Kiefergelenks auf nicht absorbierbarem Gerüst, Biomaterials, 22 (2001) 2569–2577
- Hagandora, C. K., Gao, J., Wang, Y. und Almarza, A. J., Poly (Glycerol Sebacate): ein neuartiges Gerüstmaterial für das Tissue Engineering des Kiefergelenkscheiben, Tissue Eng Part A, 19 (2013) 729-37
- Brown, B. N., Chung, W. L., Almarza, A. J., Pavlick, M. D., Reppas, S. N., Ochs, M. W., Russell, A. J. und Badylak, S. F., Induktiver, gerüstbasierter, regenerativer medizinischer Ansatz zur Rekonstruktion des Diskus des Kiefergelenks, J Oral Maxillofac Surg, 70 (2012) 2656-68
- Kobayashi, E., Nakahara, T., Inoue, M., Shigeno, K., Tanaka, A. und Nakamura, T., Experimentelle Studie zur In-situ-Gewebeengineering des Diskus des Kiefergelenks unter Verwendung von autologem Knochenmark und Kollagen-Schwamm-Gerüst, Journal of Hard Tissue Biology, 24 (2015) 211 -218
- Olubamiji, A. D., Izadifar, Z., Si, J. L., Cooper, D. M., Eames, B. F. und Chen, D. X., Modulation des mechanischen Verhaltens von 3D-gedruckten knorpelähnlichen PCL-Gerüsten: Einfluss von Molekulargewicht und Porengeometrie, Biofabrication, 8 (2016) 025020
- Legemate, K., Tarafder, S., Jun, Y. und Lee, C. H., Engineering menschlicher TMJ-Scheiben mit proteinfreisetzenden 3D-gedruckten Gerüsten, J Dent Res, 95 (2016) 800-7
- Ratner, B. D., Hofffman, A. S., Schoen, F. J. und Lemons, J. E., Blomaterials Science - Eine Einführung in Materialien in der Medizin, San Diego, Kalifornien, 1996
- Ebnesajjad, S., Handbook of Biopolymers and Biodegradable Plastics - Eigenschaften, Verarbeitung und Anwendungen, UK, 2013
- Domingos, M., Chiellini, F., Gloria, A., Ambrosio, L., Bartolo, P. und Chiellini, E., Einfluss von Prozessparametern auf die morphologischen und mechanischen Eigenschaften von 3D-bioextrudierten poly(ε‐caprolacton)-Gerüsten, Rapid Prototyping Journal, 18 (2012) 56-67
- Sun, H., Mei, L., Song, C., Cui, X. und Wang, P., Der in vivo Abbau, die Absorption und die Ausscheidung von PCL-basierten Implantaten, Biomaterials, 27 (2006) 1735-40
