Hyaluronsäure bei Zahnextraktionen: Eine systematische Übersicht und Metaanalyse von präklinischen und klinischen Studien
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziele Zu bewerten, ob bei Tieren oder Patienten mit ≥ 1 extrahiertem Zahn die Anwendung von Hyaluronsäure (HyA) zu einer besseren Heilung und/oder verbesserten Komplikationsbewältigung im Vergleich zu anderen Behandlungen oder keiner Behandlung führt.
Materialien und Methoden Drei Datenbanken wurden bis April 2022 durchsucht. Die relevantesten Einschlusskriterien waren (1) lokale Anwendung von HyA als Ergänzung zur Zahnentfernung oder als Behandlung der alveolären Osteitis und (2) Berichterstattung über klinische, radiografische, histologische oder patientenberichtete Daten. Die Neubildung von Knochen und/oder die Qualität wurden in präklinischen Studien als Hauptausgangsparameter betrachtet, während Schmerz, Schwellung und Trismus in klinischen Studien als Hauptausgangsparameter definiert wurden.
Ergebnisse Fünf präklinische und 22 klinische Studien (1062 Patienten bei der abschließenden Bewertung) wurden einbezogen. In präklinischen Studien wurde HyA in die Extraktionsstelle eingebracht. Obwohl in allen einzelnen Studien ein positiver Effekt von HyA auf die Knochenbildung zu sehen war, wurde dieser Effekt durch die Metaanalyse nicht bestätigt. In klinischen Studien wurde HyA in die Extraktionsstelle eingebracht oder als Spray oder Mundspülung verwendet. Die Anwendung von HyA nach nicht-chirurgischer Extraktion normalerweise durchgebrochener Zähne könnte einen positiven Effekt auf die Heilung des Weichgewebes haben. Basierend auf Metaanalysen führte die Anwendung von HyA nach chirurgischer Entfernung der unteren dritten Molaren (LM3) zu einer signifikanten Reduktion der Schmerzempfindung 7 Tage nach der Operation im Vergleich zu keiner zusätzlichen Wundbehandlung oder der Anwendung eines Placebos/Trägers. Frühe postoperative Schmerzen, Trismus und das Ausmaß der Schwellung blieben unbeeinflusst.
SchlussfolgerungenDie Anwendung von HyA kann einen positiven Effekt auf die Schmerzlinderung nach der Entfernung von LM3 haben, jedoch nicht nach der Extraktion von normalerweise durchgebrochenen Zähnen.
Klinische RelevanzDie Anwendung von HyA kann einen positiven Effekt auf die Schmerzlinderung nach chirurgischer Entfernung von LM3 haben, scheint jedoch keinen Einfluss auf andere Komplikationen oder nach der Extraktion von normalerweise durchgebrochenen Zähnen zu haben. Darüber hinaus scheint es die Modellierung des alveolären Knochens nach der Extraktion nicht zu reduzieren, obwohl präklinische Studien eine verbesserte Knochenbildung zeigen.
Einleitung
Obwohl der Heilungsprozess nach einer Zahnextraktion in der Regel unauffällig verläuft, kann jeder nachfolgende Schmerz das Wohlbefinden der Patienten beeinträchtigen, während auch Komplikationen auftreten können. Zum Beispiel ist die chirurgische Extraktion von semi-/vollständig impaktierten Weisheitszähnen regelmäßig mit erheblichen Schmerzen, Schwellungen und Trismus verbunden, die sich im Falle der Entwicklung einer alveolären Osteitis (AO) – auch als trockene Alveole bezeichnet – verschlimmern. AO gilt als eine der häufigsten Komplikationen bei Zahnextraktionen und tritt in 20 bis 35 % der Fälle bei chirurgischen Extraktionen von unteren Weisheitszähnen (LM3) und in 1,4 bis 5 % der (nicht-chirurgischen) Extraktionen von regelmäßig durchgebrochenen Zähnen auf. Neben solchen frühen Komplikationen, die die Lebensqualität der Patienten negativ beeinflussen, kann eine beeinträchtigte Heilung der Extraktionsstelle auch zu erheblichen Hartgewebedefekten führen, entweder an der Extraktionsstelle oder an den benachbarten Zähnen. Zum Beispiel wurde berichtet, dass tiefe parodontalen Defekte, z.B. Sondierungstiefen ≥ 7 mm, am distalen Aspekt des zweiten Molaren bei fast jedem vierten Patienten nach der Extraktion von impaktierten LM3 auftreten.
Um die Morbidität der Patienten zu reduzieren und die Heilung von Weich- und Hartgewebe in Extraktionssocket zu verbessern sowie zur Behandlung von frühen Komplikationen (z.B. AO) wurden verschiedene Materialien und/oder chirurgische Techniken getestet (z.B. Anwendung von Kollagenschwämmen, Gelen, Blutderivaten, verschiedenen Transplantationsmaterialien). In letzter Zeit wird zunehmend Aufmerksamkeit auf Hyaluronsäure (HyA) gelegt, aufgrund ihrer entzündungshemmenden und antibakteriellen Eigenschaften sowie ihrer positiven Auswirkungen auf die Heilung von Weich- und Hartgewebe. Insbesondere haben präklinische Studien einen positiven histologischen Effekt auf die Heilung von Knochen- und Parodontaldefekten nach der Anwendung von HyA gezeigt. Basierend auf den Ergebnissen der Meta-Analysen einer systematischen Übersicht über klinische Studien zur chirurgischen Extraktion von Weisheitszähnen wurde in Gruppen, die HyA-basierte Produkte erhielten, eine signifikante Schmerzlinderung am dritten und siebten postoperativen Tag, jedoch nicht bei Trismus, berichtet. In diesem Zusammenhang fehlt eine umfassende Bewertung der verfügbaren präklinischen und klinischen Evidenz zur Wirkung der Anwendung von HyA im Zusammenhang mit der Zahnextraktion im Allgemeinen, einschließlich der Prävalenz, des Ausmaßes und/oder des Managements von Komplikationen. Daher befasste sich die vorliegende systematische Übersicht mit der folgenden PICOS (Population (P), Intervention (I), Vergleich (C), Ergebnisse (O) und Studiendesign (S)) Frage: „Bei Tieren/Patienten, die ≥ 1 Zahn extrahiert bekommen haben, führt die Anwendung von HyA allein oder in Kombination mit anderen Produkten/Trägersystemen zu einer überlegenen Heilung von Weich-/Hartgewebe, reduzierter Morbidität, reduzierter Komplikationsrate und/oder verbessertem Komplikationsmanagement im Vergleich zu jeder anderen Behandlung oder keiner Behandlung?“.
Material und Methoden
Studienprotokoll und Studienregistrierung
Die vorliegende Arbeit folgte den verfügbaren Richtlinien zur Durchführung systematischer Übersichten über präklinische und klinische Studien (Preferred Reporting Items for Systematic Reviews and Meta-analysis (PRISMA); Anhang 1). Beide Protokolle wurden im internationalen prospektiven Register für systematische Übersichten (PROSPERO) registriert, d.h. eines für die präklinischen (CRD42021266190) und eines für die klinischen Studien (CRD42021266183).
Informationsquellen, Literatursuche und Eignungskriterien
Die Literatursuche wurde am 14. Oktober 2021 in 3 Datenbanken (d.h. Ovid (MEDLINE und CENTRAL), EMBASE und Pubmed) durchgeführt und am 7. April 2022 aktualisiert. Einzelheiten zur Suche einschließlich der Schlüsselwörter sind in Anhang 2 dargestellt. Nach der Entfernung der Duplikate wurden Titel und Abstracts von 2 Gutachtern (DD, TL) auf Eignung überprüft, und Kappa-Werte für die gesichteten Volltexte und schließlich einbezogenen Publikationen wurden berechnet. Unklarheiten wurden in Diskussion mit einem dritten Autor (KB) geklärt. Unabhängig vom Studientyp wurden Studien einbezogen, wenn (a) sie in englischer oder deutscher Sprache verfasst waren, (b) der Volltext verfügbar war und (c) klinische, radiografische oder histologische Daten bereitgestellt wurden. Zusätzliche Einschlusskriterien für die präklinischen Studien waren (a) randomisierte und nicht-randomisierte kontrollierte Experimente und (b) lokale Anwendung eines HyA-basierten Produkts allein oder in Kombination mit einem anderen Produkt in ≥ 1 der Gruppen nach der Extraktion von ≥ 1 Zahn. Zusätzliche Einschlusskriterien für die klinischen Studien waren (a) randomisierte kontrollierte Studie (RCT), kontrollierte Studie (CT) oder Fallserie mit mindestens 10 Patienten und (b) lokale Anwendung eines HyA-basierten Produkts allein oder in Kombination mit einem anderen Produkt in ≥ 1 der Gruppen entweder nach der Extraktion von ≥ 1 Zahn oder als Behandlung von AO von ≥ 1 Zahn.
Daten Sammlung und Extraktion
Zwei Autoren (DD, KB) extrahierten die Daten unabhängig voneinander zweimal, und etwaige Meinungsverschiedenheiten wurden in einer Diskussion mit einem dritten Autor (AS) geklärt. Aus den präklinischen Studien wurden folgende Informationen extrahiert: (a) erster Autor, (b) Veröffentlichungsjahr, (c) Studiendesign, (d) Behandlungsmodell, (e) Behandlungsort, (f) Spezies, (g) HyA-Anwendungsform, (h) Behandlungsgruppen, (i) Nachbeobachtungszeitraum, (j) verfügbare Ergebnisparameter und (k) Finanzierungsdetails. Ebenso wurden folgende Informationen aus den klinischen Studien extrahiert: (a) erster Autor, (b) Veröffentlichungsjahr, (c) Studiendesign, (d) Patientenmerkmale (d.h. Geschlecht, Alter, Gesundheits- und Rauchstatus), (e) standortspezifische Einschlusskriterien, (f) Anzahl der Standorte zu Beginn und bei der letzten Nachbeobachtung, (g) Behandlungsgruppen, (h) Produktdetails, (i) Anwendungsform, (j) Nachbeobachtungszeitraum, (k) postoperative Medikation, (l) verfügbare Ergebnisparameter, (m) klinische Umgebung (d.h. Privatpraxis oder Universitätsumgebung) und (n) Finanzierungsdetails. Schließlich wurden alle verfügbaren Informationen zu den HyA-basierten Produkten zusammengefasst, d.h. (a) Handelsname, (b) Hersteller, (c) Konzentration, (d) chemische Form und (e) Anwendungsform.
Bewertung des Verzerrungsrisikos
Für die präklinischen Studien wurde das Verzerrungsrisiko-Tool (RoB) von SYRCLE verwendet. Wie vorgeschlagen, wurden die folgenden Kriterien als „gering“, „hoch“ oder „unklar“ bewertet: (1) Sequenzgenerierung, (2) Ausgangsmerkmale, (3) Verblindung der Zuteilung, (4) zufällige Unterbringung, (5) Verblindung der Betreuer oder Forscher, (6) zufällige Ergebniseinschätzung, (7) Verblindung des Ergebnisevaluators, (8) unvollständige Ergebnisdaten, (9) selektive Ergebnisberichterstattung und (10) andere Verzerrungsquellen. Für jede Studie wurden die Anzahl und der Prozentsatz der positiv bewerteten Punkte berechnet (d.h. „Qualitätsbewertung“).
Für die RCT wurde das RoB 2.0-Tool der Cochrane Collaboration verwendet. Das RoB wurde als „gering“, „hoch“ oder „einige“ Bedenken für jedes der folgenden Kriterien beurteilt: (1) Randomisierungsprozess, (2) Abweichungen von den beabsichtigten Interventionen, (3) fehlende Ergebnisdaten, (4) Messung des Ergebnisses, (5) Auswahl des berichteten Ergebnisses und (6) allgemeines Verzerrungsrisiko. Für die nicht-randomisierten Studien wurde das ROBINS-I-Tool verwendet. Das Verzerrungsrisiko wurde für die folgenden Kriterien als „gering“, „mäßig“, „ernst“, „kritisch“ oder „keine Informationen“ beurteilt: (1) Störfaktoren, (2) Auswahl der Teilnehmer, (3) Klassifizierung der Interventionen, (4) Abweichungen von den beabsichtigten Interventionen, (5) fehlende Ergebnisdaten, (6) Messung des Ergebnisses, (7) Auswahl des berichteten Ergebnisses und (8) allgemeines Verzerrungsrisiko.
Die Bewertung wurde von 2 Gutachtern (DD, KB) durchgeführt, und im Falle von Unklarheiten wurde ein Konsens durch Diskussion mit einem dritten Autor (AS) erzielt. Ein Autor wiederholte die Bewertung (DD).
Synthese der Ergebnisse und statistische Analyse
Für die präklinischen Studien wurden die Neubildung von Knochen und das Knochenvolumen pro Gewebevolumen (BV/TV) als Hauptausgangsparameter betrachtet, während für die klinischen Studien Schmerzen, Trismus und Schwellungen als Hauptausgangsparameter definiert wurden. Daten wurden aus dem Text, Tabellen und Abbildungen extrahiert, berechnet und/oder die Autoren der Originalveröffentlichungen kontaktiert.
Falls mindestens 2 randomisierte Studien mit vergleichbarem Studiendesign (d.h. Behandlungsindikation, HyA-Regime, Nachbeobachtungszeitraum, Ergebnisbewertung) identifiziert wurden, wurde eine paarweise Meta-Analyse durchgeführt. Die Meta-Analysen beschränkten sich auf RCTs und schlossen somit Studien mit höherer methodologischer Qualität ein. Die Gruppen, die HyA anwendeten, wurden entweder mit einer negativen Kontrollgruppe (d.h. ohne zusätzlichen Behandlungsschritt) oder mit einer Kontrollgruppe verglichen, die eine andere Behandlung anwendete, einschließlich eines Placebos oder des Trägermaterials der Testgruppe (“Placebo/Träger”). Paarweise Meta-Analysen wurden für jeden einzelnen Vergleich sowie insgesamt durchgeführt. Es wurde die eingeschränkte maximale Wahrscheinlichkeit zur Berechnung der Heterogenität (τ2) verwendet und die Knapp–Hartung-Standardfehleranpassung, um die geringe Anzahl der Studien zu berücksichtigen. Der Mittelwertunterschied zwischen Kontroll- und Testgruppe, der Standardfehler des Mittelwertunterschieds und das 95%-Konfidenzintervall (CI) wurden berechnet. In Studien mit Split-Mouth-Design wurden die Daten als abhängig behandelt, wenn der Standardfehler des Mittelwertunterschieds mit r = 0,5 berechnet wurde. Der Chi-Quadrat-Test wurde verwendet, um die Heterogenität zu bewerten, und ein p-Wert < 0,1 wurde als Hinweis auf signifikante Heterogenität betrachtet. Darüber hinaus wurde der I2-Test auf Homogenität durchgeführt, um das Ausmaß der Heterogenität zu quantifizieren, und im Falle von mindestens 3 vergleichbaren Studien wurde zusätzlich das 95%-Vorhersageintervall berechnet. Die statistische Analyse wurde mit STATA/IC 17.0 für Mac durchgeführt.
Qualität der Evidenz (GRADE)
Die Sicherheit der meta-analytischen Evidenz aus den hier enthaltenen präklinischen und klinischen Studien wurde durch die Grading of Recommendations Assessment, Development and Evaluation (GRADE) zusammengefasst. Für sowohl präklinische als auch klinische Studien wurde die GRADEpro GDT (Guideline Development Tool, McMaster University und Evidence Prime, 2022) Software verwendet, um die Qualität der Evidenz der Ergebnisse zu bewerten.
Ergebnisse
Studienauswahl und -merkmale
Die Literatursuche ist im Anhang 3 dargestellt; 147 potenzielle Referenzen wurden identifiziert und nach dem Entfernen der Duplikate blieben 90 Studien für die Titel- und Abstract-Sichtung übrig. Insgesamt wurden 57 Studien aus verschiedenen Gründen entfernt, sodass 33 Studien für die Volltextanalyse übrig blieben. Nach dem Ausschluss von weiteren 6 Studien, in denen der Produkttyp nicht den Einschlusskriterien entsprach oder das Studiendesign fehlerhaft war, wurden 5 präklinische und 22 klinische Studien in die vorliegende systematische Übersicht aufgenommen. Beide Gutachter waren sich über die für die Volltextsichtung ausgewählten Studien vollkommen einig (Cohen’s kappa = 1; 100% Übereinstimmung), während eine substanzielle Übereinstimmung für die endgültige Studienaufnahme erzielt wurde (Cohen’s kappa = 0.61; 84.9% Übereinstimmung).
In allen präklinischen Studien wurde HyA nach der Extraktion regelmäßig durchgebrochener Zähne in die Zahnhöhle eingebracht. Die klinischen Studien wurden in 3 Gruppen unterteilt, je nach Behandlungsindikation: (1) chirurgische Entfernung von LM3 (RCT (n = 10), CT (n = 1)), (2) Extraktion regelmäßig durchgebrochener Zähne (RCT (n = 7), nicht randomisierte Split-Mouth-Studie (n = 1), prospektive Fallserie (n = 1)), und (3) Behandlung von AO (RCT (n = 1), prospektive Fallserie (n = 1)).
Studienpopulation
In Bezug auf die präklinischen Studien beinhalteten 2 Studien jeweils 5–11 Holtzman- oder 5–6 Wistar-Ratten in den verschiedenen Gruppen, während 3 Studien Beagle-Hunde verwendeten (insgesamt 20 Hunde). In den Rattenstudien wurde HyA in der Extraktionshöhle bei gesunden oder diabetischen Tieren angewendet, während in den Hundestudien HyA in infizierten Extraktionshöhlen angewendet wurde (Tabelle 1).
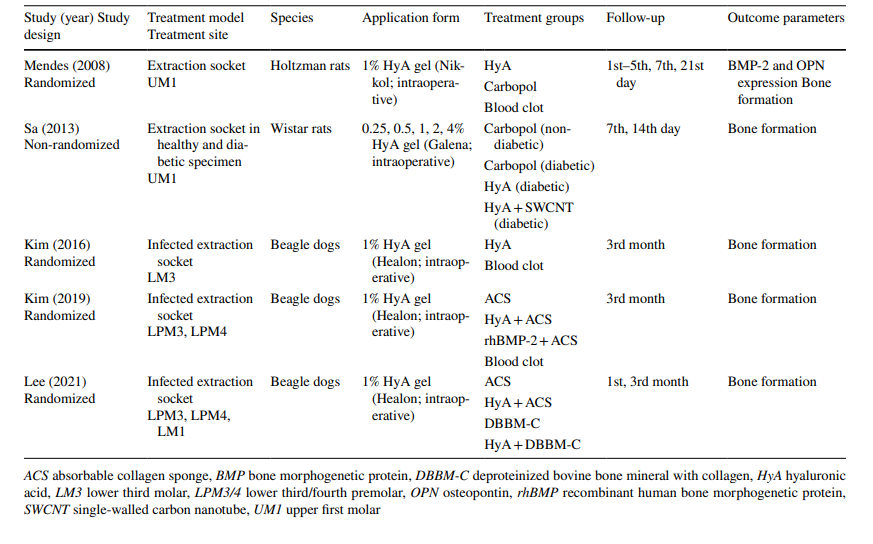
Die klinischen Studien zur chirurgischen Entfernung von LM3, der Extraktion regelmäßig durchgebrochener Zähne und der Behandlung von AO umfassten bei der abschließenden Bewertung 603, 349 und 110 Patienten, die jeweils mit 306, 226 und 90 HyA-behandelten Stellen sowie 370, 257 und 20 Kontroll-/nicht-HyA-behandelten Stellen beitrugen (Tabelle 2). In den meisten Studien waren die Patienten systemisch gesund, während eine Studie jeweils Patienten mit chronischen Lebererkrankungen oder Diabetikern betrachtete; 4 Studien berichteten nicht über den Gesundheitszustand der Patienten. Der Raucherstatus wurde in 12 Studien angegeben; 8 Studien umfassten nur Nichtraucher, 2 Studien umfassten Patienten, die ≤ 10 Zigaretten/Tag rauchten, und 2 Studien umfassten sowohl Nichtraucher als auch Raucher. Zehn Studien gaben keine Informationen zum Raucherstatus an.
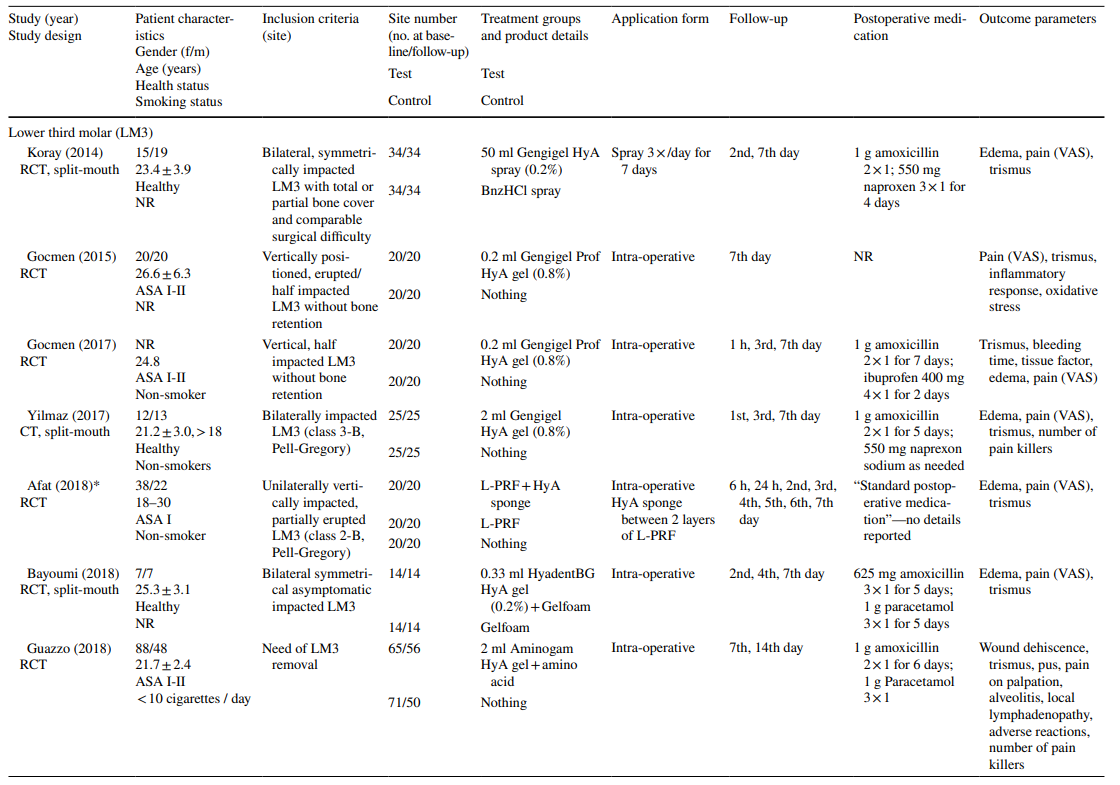
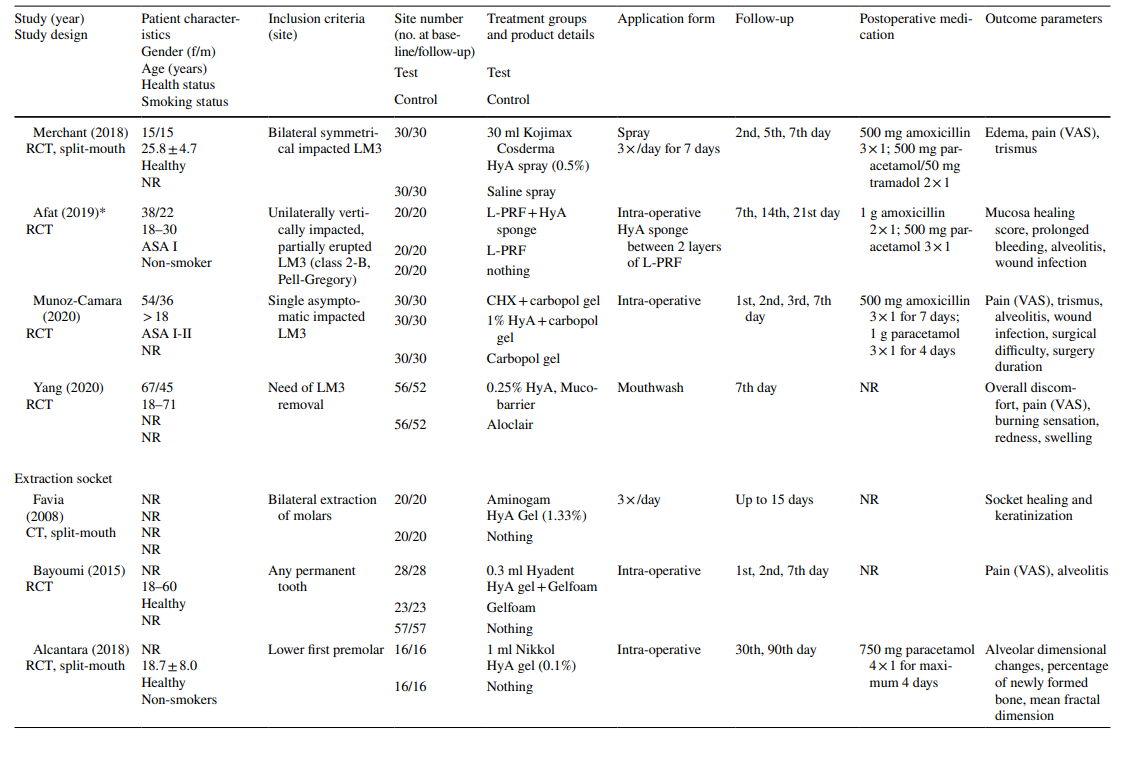
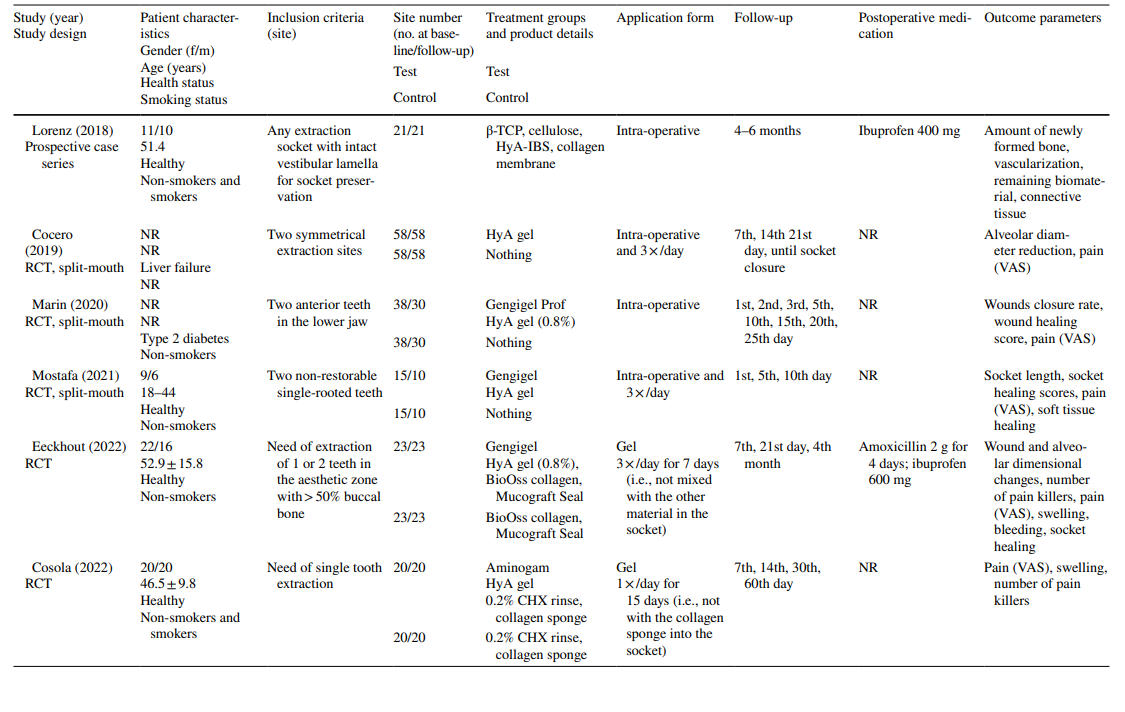
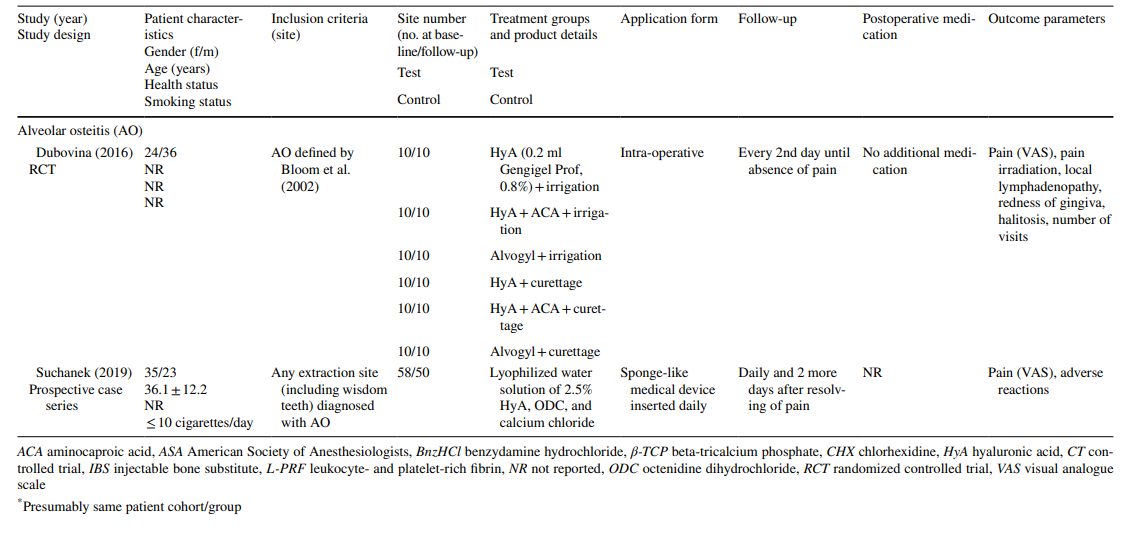
In den Studien zur LM3-Extraktion waren die Zähne asymptomatisch, überwiegend vertikal impaktiert oder halb impaktiert, was eine primäre Wundverschluss nach chirurgischer Entfernung ermöglichte. Die Hälfte der Studien zur Extraktion regelmäßig durchgebrochener Zähne umfasste nur einwurzelige Zähne (entweder Frontzähne oder Prämolaren), während die andere Hälfte entweder Molaren oder jede Art von Zahn einbezog. Beide Studien in der AO-Behandlungsgruppe umfassten alle Zahnarten, die die Kriterien von AO gemäß Blum et al. (2002) erfüllten.
Studienintervention
In allen präklinischen Studien wurde HyA als Gel direkt nach der Zahnextraktion entweder allein (n = 3) oder in Kombination mit einem resorbierbaren Kollagenschwamm (n = 2) angewendet (Tabelle 1).
In den meisten klinischen Studien (n = 19) (Tabelle 2), wurde HyA intraoperativ als Gel in die Extraktionshöhle oder postoperativ an der Extraktionsstelle entweder allein (n = 13) oder mit einem Träger (d.h. resorbierbarer Kollagenschwamm (n = 3), leukozyten- und thrombocytenreiches Fibrin (n = 2) oder Knochenersatzmaterialien (n = 1)) angewendet. In den verbleibenden 3 klinischen Studien wurde HyA entweder als Spray 3 Mal täglich für 1 Woche (n = 2) oder als Mundspülung (n = 1) verwendet.
HyA Informationen
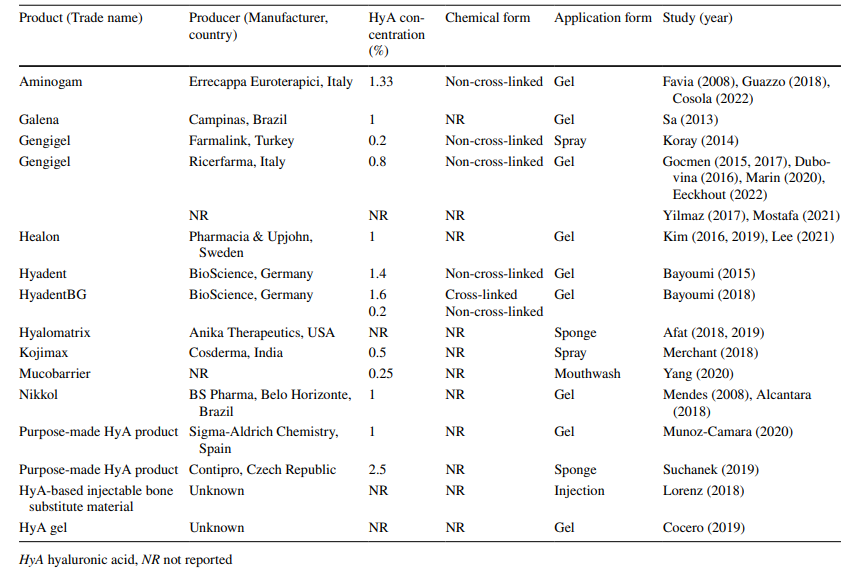
In den 5 präklinischen und 22 klinischen Studien, die einbezogen wurden, wurden 11 kommerzielle, 2 selbstgemachte und 2 HyA-Produkte unbekannter Herkunft verwendet (Tabelle 3). In allen präklinischen Studien (n = 5) wurde HyA als Gel angewendet, während in den klinischen Studien HyA als Gel (n = 15), Spray (n = 2), Mundspülung (n = 1) oder kombiniert mit einem Schwamm (n = 3) oder Knochenersatzmaterial (n = 1) während des Herstellungsprozesses angewendet wurde. Die Konzentration von HyA variierte von 0,2% in einem Spray, 0,25% in einer Mundspülung bis zu 2,5% in einem selbstkombinierten HyA-Schwamm, während in 5 Studien die Konzentration von HyA nicht angegeben wurde. Die chemische Form, d.h. nicht vernetzt oder vernetzt, wurde in den meisten Studien (n = 16) nicht berichtet, während 10 Studien nicht vernetztes HyA verwendeten und eine Studie nicht- und vernetztes HyA kombinierte.
Klinische Umgebung und Finanzierungsdetails
Alle präklinischen Studien wurden durch unabhängige Einzel- oder Mehrfachforschungsstipendien finanziert.
In einer klinischen Studie wurde ein multizentrisches Studiendesign berichtet, das 8 medizinische Zentren umfasste, während alle anderen klinischen Studien in einer einzelnen Abteilung in einem universitären Umfeld durchgeführt wurden. Elf klinische Studien berichteten nicht über Finanzierungsquellen, während in 9 klinischen Studien die Finanzierung von der Abteilung bereitgestellt wurde; jedoch wurde in 3 dieser 9 Studien das HyA-Gel vom Hersteller bereitgestellt. In einer einzigen Studie wurde die Finanzierung von 3 verschiedenen Forschungsstiftungen bereitgestellt.
Berichtete Ergebnisvariablen und Nachverfolgung
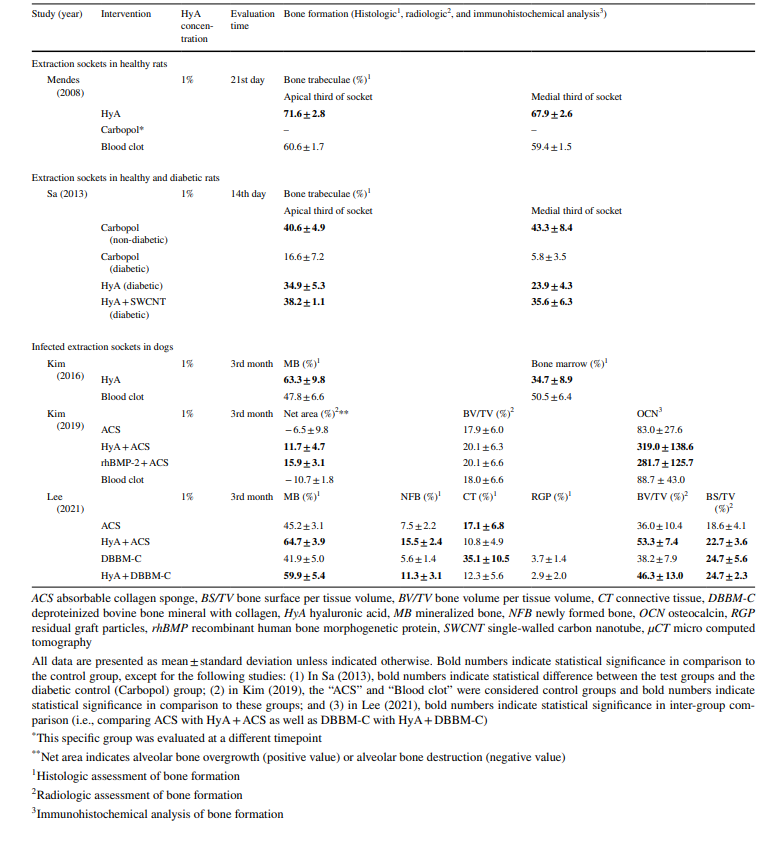
In den präklinischen Studien wurde die Knochenbildung mit verschiedenen Methoden zwischen 14 Tagen und 3 Monaten nach der Operation bewertet. Eine Studie untersuchte zusätzlich den Gehalt an Knochen-morphogenetischem Protein-2 und Osteopontin (Tabelle 1). Darüber hinaus berichteten 4 Studien von keinen Nebenwirkungen nach der HyA-Anwendung, während eine Studie keine Abwesenheit/Präsenz von Nebenwirkungen berichtete.
In den klinischen Studien variierten die bewerteten Ergebnisparameter je nach Behandlungsindikation (Tabelle 2). In den Studien zur chirurgischen Entfernung von LM3 waren die Schmerzpräsenz, gemessen mit der visuellen Analogskala (VAS), Schwellung und Trismus die am häufigsten bewerteten Ergebnisparameter. Andere weniger häufig bewertete Parameter waren das Vorhandensein/Nichtvorhandensein von verlängertem Bluten, das Vorhandensein/Nichtvorhandensein von Weichgewebsdehiszenz, die Geschwindigkeit der mukosalen Heilung, die Rate von AO/Wundinfektionen und Laborparameter für Entzündungen, oxidativen Stress und Wundheilung. Unter den Studien zur Extraktion regelmäßig durchgebrochener Zähne verwendeten 3 Publikationen unterschiedliche Punktzahlen zur Heilung von Alveolen/Weichgewebe, 3 Publikationen bewerteten die Menge an neu gebildetem Knochen und/oder alveoläre Dimensionveränderungen, 3 Publikationen bewerteten Schmerzen, und eine Studie bewertete die Rate von AO. Beide Studien zur AO-Behandlung konzentrierten sich auf die Bewertung von Schmerzen und unerwünschten Reaktionen. Die meisten klinischen Studien verzeichneten keine Nebenwirkungen nach lokaler Anwendung von HyA, während 6 Studien das Fehlen/Vorhandensein von Nebenwirkungen nicht erwähnten. Eine einzelne Studie, die 0,8% HyA-Gel nach der Entfernung von LM3 anwendete, berichtete von einer signifikant verlängerten Blutungszeit nach Wundverschluss im Vergleich zur Kontrollgruppe; da die Hämostase jedoch innerhalb eines physiologischen Zeitrahmens lag, wurde dies nicht als unerwünschtes Ereignis betrachtet.
Zusammenfassung der Ergebnisse der einzelnen Studien
In allen präklinischen Studien (Tabelle 4), basierend auf histologischen, radiologischen oder immunhistochemischen Analysen, zeigten die Testgruppen mit HyA in mindestens einem der Parameter zur Knochenbildung signifikant bessere Ergebnisse im Vergleich zur Kontrollgruppe; dies war unabhängig vom Zustand des Alveolars (gesund oder infiziert) und der Art der Kontrollbehandlung.
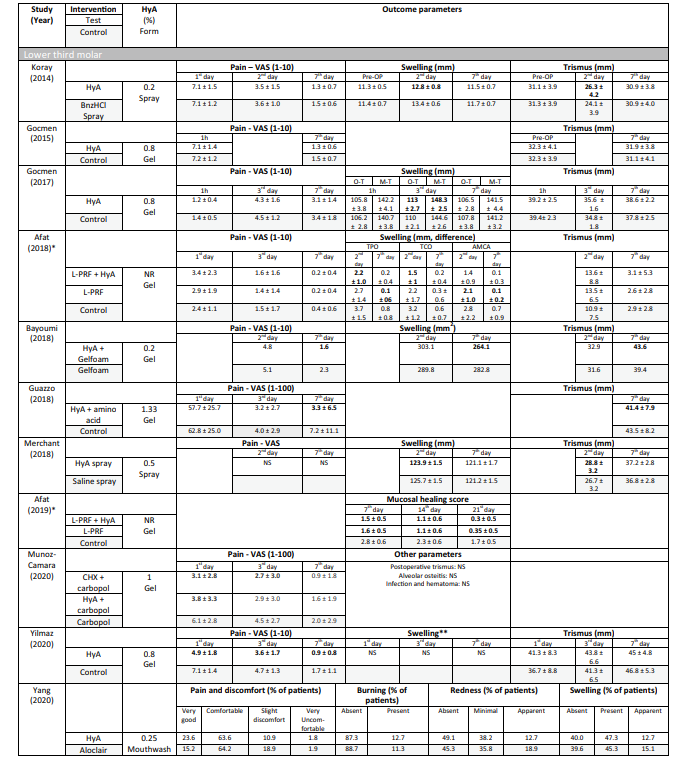
In 4 von 10 klinischen Studien zur chirurgischen Entfernung von LM3 (Tabelle 5), die über Schmerzen berichteten, wurden signifikante Vorteile für die Testgruppe, die HyA verwendete, im Vergleich zur Kontrollgruppe in mindestens einem postoperativen Zeitpunkt festgestellt. Ähnlich berichteten 4 von 7 Studien und 3 von 9 Studien, die über Schwellungen und Trismus berichteten, jeweils von signifikanten Vorteilen zugunsten der HyA-Anwendung im Vergleich zur Kontrollgruppe. In 3 von 4 Studien, die über die Heilung von Weichgewebe nach der Extraktion regelmäßig durchgebrochener Zähne berichteten, wurde eine signifikant verbesserte Heilung des Weichgewebes nach der HyA-Anwendung im Vergleich zur Kontrollgruppe festgestellt. Darüber hinaus berichtete eine Studie über eine verbesserte Knochenbildung nach 30 Tagen, eine Studie berichtete über eine verringerte Reduktion des alveolären Durchmessers nach bis zu 21 Tagen, während 2 Studien entweder keinen Unterschied zwischen den Gruppen oder signifikante Nachteile für die Testgruppe, die HyA verwendete, in Bezug auf alveoläre Dimensionierungsänderungen berichteten. Schließlich wurde die Schmerzwahrnehmung in 6 Studien berichtet, aber nur 2 Studien berichteten von signifikanten Unterschieden zwischen den Gruppen zugunsten der HyA-Anwendung. Eine Studie zur Behandlung von AO berichtete über signifikant geringere postoperative Schmerzen nach der HyA-Anwendung im Vergleich zur Anwendung von Alvogyl; die zweite Studie hatte keine Kontrollgruppe.
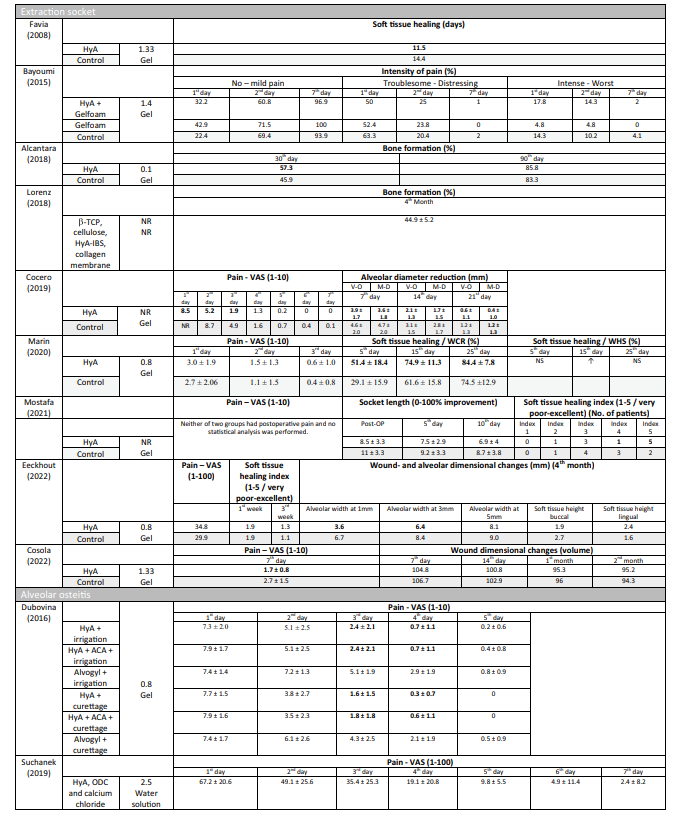

Synthese der Ergebnisse
Präklinische Studien—Knochenvolumen pro Gewebevolumen in präklinischen Studien
Zwei präklinische Studien lieferten Daten zur Zusammenfassung des radiografisch bewerteten BV/TV 3 Monate postoperativ (Abb. 1). Die Studien verglichen die Anwendung von HyA in Kombination mit einem resorbierbaren Kollagenschwamm versus dem resorbierbaren Kollagenschwamm. Insgesamt wurde kein signifikanter Unterschied zwischen den Gruppen festgestellt (Effektgröße: 9.57; 95% CI: − 86.22 bis 105.36; p = 0.42), aber die statistische Heterogenität zwischen den Studien war signifikant (I2 = 89.89%; p < 0.01).
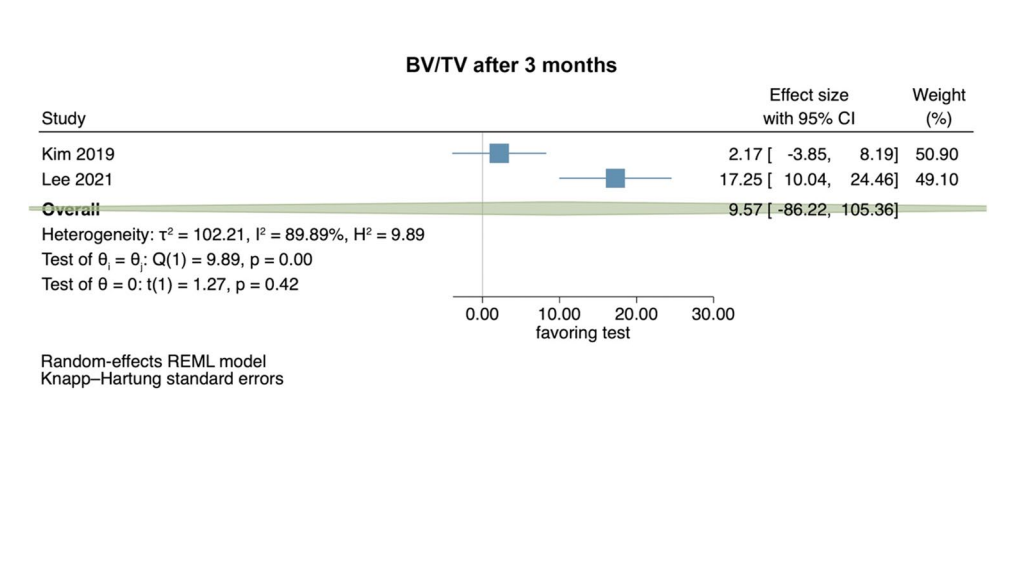
Klinische Studien—Bewertung von Schmerzen 2–3 und 7 Tage nach chirurgischer Entfernung des LM3
Basierend auf den Ergebnissen von 4 RCTs zeigte die Schmerzempfindung keine statistisch signifikanten Unterschiede zwischen Test- und Kontrollgruppen 2–3 Tage postoperativ (Effektgröße: 0.52; 95% CI: − 0.34–1.38; p = 0.15), ohne statistische Heterogenität zwischen den Studien (I2 = 0.00%; p = 0.37). Separate Analysen mit 2 Studien, die HyA mit einer negativen Kontrollgruppe verglichen (Effektgröße: 0.44; 95% CI: − 3.24–4.12; p = 0.37) und HyA mit einer Placebo/Trägergruppe (Effektgröße: 0.78; 95% CI: − 7.67–9.24; p = 0.45), wiesen ebenfalls keine statistische Signifikanz auf (Abb. 2a).
Basierend auf den Ergebnissen von 5 RCTs war die Schmerzempfindung 7 Tage postoperativ in den Testgruppen, die HyA anwendeten, signifikant niedriger (Effektgröße: 0.32; 95% CI: 0.12–0.51; p = 0.01), ohne statistische Heterogenität zwischen den Studien (I2 = 0.00%; p = 0.84). Die separaten Analysen wiesen jedoch keine statistische Signifikanz für den Vergleich von HyA mit einer negativen Kontrollgruppe auf (3 Studien; Effektgröße: 0.27; 95% CI: − 0.05–0.60; p = 0.07) und für den Vergleich von HyA mit einer Placebo/Trägergruppe (2 Studien; Effektgröße: 0.53; 95% CI: − 0.48–1.54; p = 0.09; Abb. 2b).
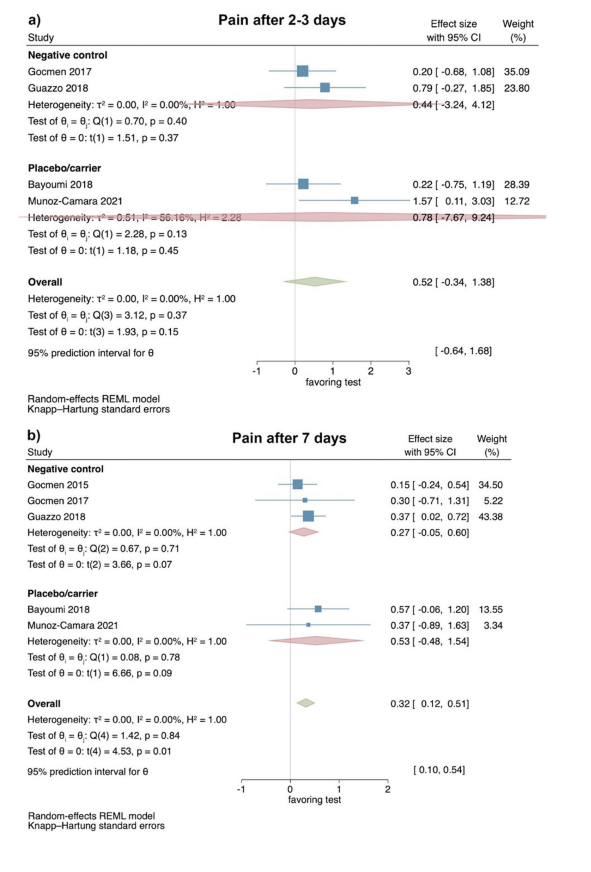
Klinische Studien—Bewertung der Schwellung 2–3 und 7 Tage nach chirurgischer Entfernung des LM3
Basierend auf den Ergebnissen von 2 RCT zeigte das Ausmaß der Schwellung 2–3 Tage postoperativ keinen signifikanten Unterschied zwischen Test- und Kontrollgruppen (Effektgröße: − 2,08; 95% CI: − 23,73–19,58; p = 0,44); jedoch war die statistische Heterogenität zwischen den Studien signifikant (I2 = 87,94%; p < 0,01; Abb. 3a).
In ähnlicher Weise zeigte das Ausmaß der Schwellung 7 Tage nach der Operation ebenfalls keinen signifikanten Unterschied zwischen den Test- und Kontrollgruppen (Effektgröße: 1,75; 95% CI: − 14,38–17,89; p = 0,40), und die statistische Heterogenität unter den Studien war erneut signifikant (I2 = 66,86%; p = 0,08; Abb. 3b). Eine separate Analyse für den Vergleich von HyA mit einer negativen Kontrolle oder einer Placebo/Trägergruppe war aufgrund der begrenzten Anzahl von Studien nicht möglich.
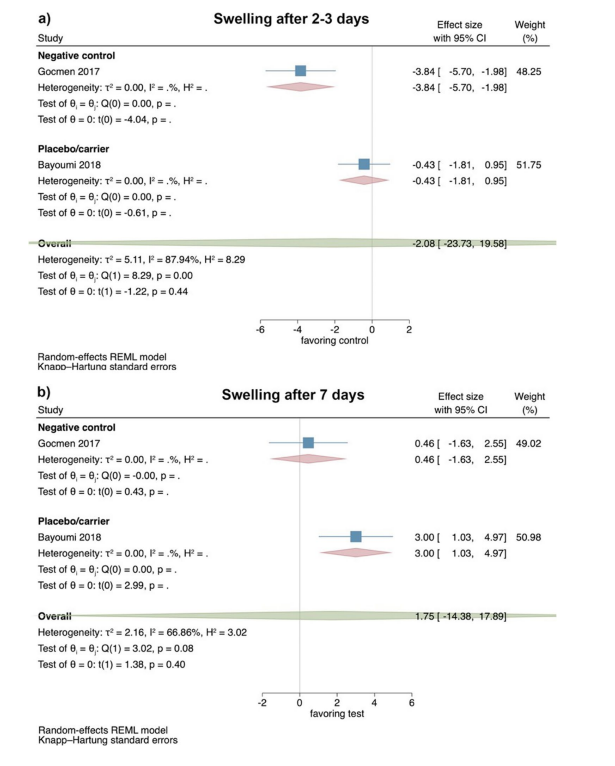
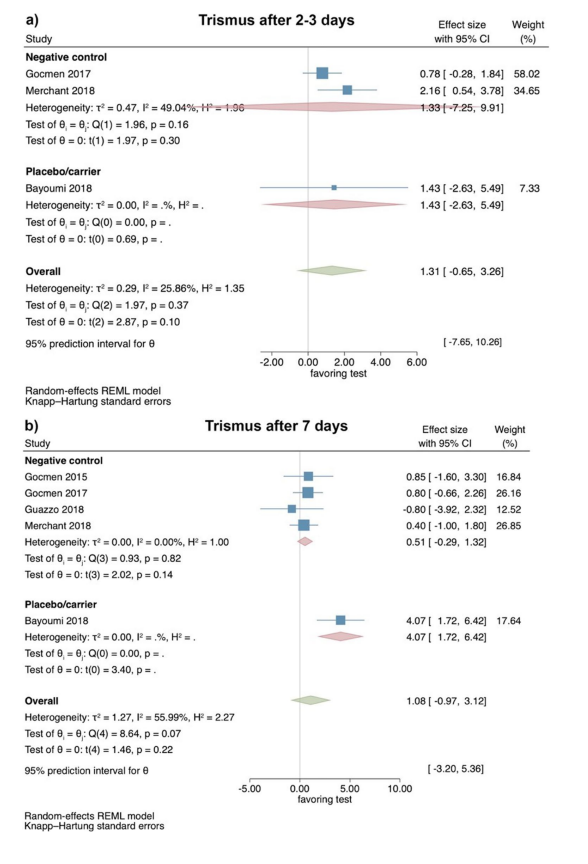
Klinische Studien—Bewertung von Trismus 2–3 und 7 Tage nach chirurgischer Entfernung des LM3
Basierend auf den Ergebnissen von 3 RCTs zeigte Trismus 2–3 Tage postoperativ keine signifikanten Unterschiede zwischen Test- und Kontrollgruppen (Effektgröße: 1.31; 95% CI: − 0.65–3.26; p = 0.10), ohne statistische Heterogenität zwischen den Studien (I2 = 25.86%; p = 0.37). Die separaten Analysen zeigten ebenfalls keine statistische Signifikanz für den Vergleich von HyA mit einer negativen Kontrollgruppe (2 Studien; Effektgröße: 1.33; 95% CI: − 7.25–9.91; p = 0.30), während nur eine einzige Studie für den Vergleich von HyA mit einer Placebo/Trägergruppe verfügbar war (Abb. 4a).
Basierend auf den Ergebnissen von 5 RCTs zeigte Trismus 7 Tage postoperativ keinen signifikanten Unterschied zwischen Test- und Kontrollgruppen (Effektgröße: 1.08; 95% CI: − 0.97–3.12; p = 0.22); jedoch war die statistische Heterogenität zwischen den Studien signifikant (I2 = 55.99%; p = 0.07). Die separaten Analysen zeigten ebenfalls keinen signifikanten Unterschied zwischen HyA und einer negativen Kontrollgruppe (4 Studien; Effektgröße: 0.51; 95% CI: − 0.29–1.32; p = 0.14), während nur eine einzige Studie für den Vergleich von HyA mit einer Placebo/Trägergruppe verfügbar war (Abb. 4b).
Bewertung des Bias-Risikos
Unter den präklinischen Studien lag der Qualitätswert zwischen 20 und 40 % (Anhang 4); nur die Berichterstattung über Basismerkmale und andere Bias-Quellen wurden in allen Studien als geringes Risiko für Bias beurteilt.
Die einbezogenen RCT wurden entweder als mit einigen Bedenken beurteilt (n = 13) oder als mit geringem Risiko für Verzerrungen (n = 5) (Anhang 5). Keines der RCT wich von der beabsichtigten Intervention ab, 5 RCTs wurden als mit einigen Bedenken im Randomisierungsprozess beurteilt, und etwa die Hälfte der Studien wurde als mit einigen Bedenken in ihrer Berichterstattung über fehlende Ergebnisdaten, Messung des Ergebnisses und Auswahl der berichteten Ergebnisse beurteilt. Die meisten der nicht-randomisierten Studien wurden als mit geringem Risiko für Verzerrungen beurteilt (n = 3), während eine Studie als mit einigen Bedenken beurteilt wurde (Anhang 6).
Qualität der Evidenz (GRADE)
Für die Ergebnisse der Meta-Analyse, die 2 präklinische Studien umfasst, wurde die Sicherheit der Evidenz für den Outcome-Parameter BV/TV nach 3 Monaten als niedrig bewertet (Anhang 8a).
Die Sicherheit der Evidenz, die aus Meta-Analysen mit klinischen Studien gewonnen wurde, wurde als moderat für die Schmerzempfindung und Trismus und als niedrig für die Schwellungsbewertung beurteilt (Anhang 8b).
Diskussion
HyA hat sich als entzündungshemmend, ödemhemmend, osteoinduktiv und pro-angiogenetisch erwiesen; somit scheint es, dass HyA die Wundheilung verbessert.
Die vorliegende systematische Überprüfung hatte zum Ziel, eine umfassende Bewertung aller verfügbaren Beweise (d.h. präklinisch und klinisch) über die Wirkung der Anwendung von HyA im Zusammenhang mit der Zahnextraktion bereitzustellen. Insgesamt scheint die Anwendung von HyA im Zusammenhang mit der chirurgischen Entfernung des LM3 einen positiven Effekt auf die Schmerzlinderung in der ersten postoperativen Woche zu haben. Insbesondere zeigte die Metaanalyse von 5 klinischen Studien, dass die lokale (intra-chirurgische) Anwendung von HyA-Gel mit einer statistisch signifikant reduzierten Schmerzempfindung 7 Tage nach der Operation im Vergleich zur Kontrollgruppe, die entweder keine zusätzliche Wundmanipulation oder die Anwendung eines Placebos/Trägers erhielt, assoziiert war. Die Anwendung von HyA schien keinen Einfluss auf andere häufig auftretende Komplikationen nach der Entfernung des LM3 (d.h. Schwellungen und Trismus) oder im Zusammenhang mit der nicht-chirurgischen Extraktion von normalerweise durchgebrochenen Zähnen zu haben.
Dieser positive Effekt der intraoperativen Anwendung von HyA auf die Schmerzwahrnehmung innerhalb der ersten postoperativen Woche nach der Entfernung des LM3 ergänzt die Ergebnisse einer früheren systematischen Überprüfung, die ebenfalls den möglichen Nutzen von HyA in derselben Indikation bewertete. Insbesondere basierend auf einer anderen Studienauswahl reduzierte die Anwendung von HyA signifikant die Schmerzen sowohl am 3. als auch am 7. postoperativen Tag. Offensichtlich wurde der positive Effekt von HyA in den sehr frühen postoperativen Tagen, der in dieser Überprüfung beobachtet wurde, in der vorliegenden Metaanalyse nicht gesehen, aufgrund der erhöhten Informationen, die durch 2 zusätzliche Studien, die hier einbezogen wurden, bereitgestellt wurden, und aufgrund des Ausschlusses einer nicht-randomisierten Studie, die die HyA-Testgruppe stark begünstigte. Ein positiver Effekt von HyA in Bezug auf die reduzierte Schmerzwahrnehmung kann teilweise durch seine modulierende Wirkung auf die Entzündungsreaktion am chirurgischen Standort erklärt werden. Es wurde zuvor nachgewiesen, dass HyA die Produktion und Expression von Prostaglandin E2, Bradykinin und Substanz P, die alle an der Schmerzübertragung und -wahrnehmung beteiligt sind, herunterregulieren kann. Dennoch übersetzt sich jeder potenzielle positive Effekt von HyA auf die lokale Entzündungsreaktion nicht notwendigerweise in weniger Schwellung und/oder Trismus in der Klinik, da sowohl die hier einbezogenen Analysen als auch die in der oben genannten Überprüfung keine Unterschiede zwischen Test- und Kontrollgruppen hinsichtlich dieser Aspekte zeigten. Diese Ergebnisse sollten jedoch mit Vorsicht interpretiert werden, da die Anzahl der Originalstudien gering ist und es an Standardisierung in den Methoden zur Bewertung der Gesichtsschwellung sowie in der Intervention selbst mangelt. Beispielsweise lieferten die einbezogenen Studien selten Informationen über den Schwierigkeitsgrad der Operation und/oder das angewandte Lappen-Design, Aspekte, die die Ergebnisparameter beeinflussen können. Darüber hinaus sollte das Fehlen eines signifikanten positiven Effekts von HyA auf die Schmerzwahrnehmung bei nicht-chirurgischen Extraktionen regelmäßig durchgebrochener Zähne, wie in den meisten Studien (4 von 5) in dieser Überprüfung gesehen, nicht als Mangel an Wirkung von HyA per se interpretiert werden. Dies könnte auf Unterschiede im Heilungsmodus zurückzuführen sein, d.h. „geschlossen“ nach chirurgischer Entfernung des LM3 im Vergleich zu „offen“ nach der Extraktion regelmäßig durchgebrochener Zähne, wo das Fehlen einer primären Verschluss und eines Trägers zu einem schnellen Auswaschen von HyA geführt haben könnte. Ob die Anwendung von HyA in einem Träger seine Wirkung verbessern könnte, ist schwer zu beurteilen, da dies nur in einer einzigen Studie verwendet wurde, die keine Unterschiede zeigte. Dennoch sollte auch bedacht werden, dass in den meisten Fällen eine unkomplizierte Zahnextraktion mit niedrigen Schmerzlevels verbunden ist, und somit könnte jeder mögliche positive Effekt von HyA schwer zu erfassen sein. Tatsächlich wurde in der einzigen vergleichenden Studie zum AO-Management, die in dieser Überprüfung enthalten ist, von signifikant reduzierten Schmerzen postoperativ in den Gruppen berichtet, die HyA erhielten (ohne primären Verschluss und ohne Verwendung eines Trägers).
Einige der Studien zur Heilung nach der Extraktion regelmäßig durchgebrochener Zähne, die in diesem Review enthalten sind, haben auch die mögliche Auswirkung der Anwendung von HyA auf die Heilung von Weich- und Hartgewebe bewertet. In 3 von 4 Studien, die die Heilung von Weichgewebe bewerteten, wurde ein positiver Effekt von HyA berichtet, basierend auf der Zeit bis zur und/oder dem Prozentsatz der Schließung der Alveole sowie auf den Bewertungen zur Beurteilung der Heilung von Weichgewebe. Im Gegensatz dazu hatte in 3 vergleichenden Studien die intra- oder postoperative Anwendung von HyA-Gel keinen positiven Effekt hinsichtlich der alveolären Dimensionen im Vergleich zur Nichtanwendung von HyA, nach einer Nachbeobachtungszeit von 3 bis 4 Monaten. Tatsächlich wurde in einer der Studien, in der nach der Erhaltung des Knochens mit Alveolengrafting mit kollagenangereichertem, deproteinisiertem bovinem Knochenmineral und der Versiegelung der Alveole mittels einer Kollagenmatrix chirurgische Therapie, HyA-Gel dreimal täglich für 1 Woche auf die Kollagenmatrix aufgetragen, signifikant mehr horizontaler Knochenverlust im koronalen Bereich der Extraktionsalveolen beobachtet. Diese Ergebnisse über das Fehlen eines positiven Effekts von HyA auf den Knochen können irgendwie im Widerspruch zu den in den hier enthaltenen präklinischen Studien berichteten Ergebnissen erscheinen. In den 2 Studien, die über die Heilung von nicht-infizierten Extraktionsalveolen bei gesunden oder diabetischen Ratten berichteten, verbesserte die Anwendung von HyA die Knochenheilung signifikant im Vergleich zur Kontrollgruppe. Ähnlich wurde in 3 von 3 Hundestudien, die über die Heilung von infizierten Extraktionsalveolen berichteten, die Anwendung von HyA, entweder allein oder mit einem Kollagenschwamm oder deproteinisiertem bovinem Knochenmineral mit Kollagen als Träger, die Knochenheilung verbessert. Es ist jedoch wichtig zu erwähnen, dass dieser positive Effekt von HyA auf die Knochenheilung in der einzigen hier möglichen Metaanalyse bezüglich BV/TV nicht gezeigt wurde, wahrscheinlich aufgrund der Tatsache, dass beide Studien eine späte Heilungszeit für dieses spezielle Tiermodell verwendeten; d.h. die Knochenheilung in einer Extraktionsalveole beim Hund ist nach 3 Monaten bereits recht fortgeschritten, selbst ohne Behandlung. Bemerkenswert ist, dass BV/TV in der HyA-Gruppe ähnlich war wie in einer anderen Testgruppe, die mit rekombinantem menschlichem Knochen morphogenetischem Protein-2 (rhBMP-2), einem bekannten sehr potenten Knochenförderer, behandelt wurde. Darüber hinaus wurden solche positiven Effekte von HyA auf die Knochenheilung auch in anderen präklinischen Studien gezeigt, die kritische Defektmodelle verwendeten. Perspektivisch hat keine Studie zur chirurgischen Entfernung von LM3 das Heilungsergebnis im distalen Bereich des unteren zweiten Molaren bewertet, einem Bereich, der oft mit einem tiefen parodontalen Defekt nach der Extraktion eines impaktierten LM3 assoziiert ist.
Diese Überprüfung versuchte ebenfalls zu ermitteln, ob die Anwendung von HyA die Rate von AO nach der Zahnextraktion reduzieren kann; jedoch gab es in den Studien nur begrenzte Berichte über diese Komplikation. In diesem Zusammenhang wird die Anwendung von HyA im Allgemeinen als sicher und ohne Nebenwirkungen angesehen; es muss jedoch erwähnt werden, dass HyA zu erheblichen unerwünschten Ereignissen führen kann, wenn es (injiziert) in das Gewebe eingebracht wird. Hier berichtete nur eine einzige Studie von einer verlängerten Blutungszeit nach der Wundverschluss im Vergleich zur Kontrollgruppe; jedoch wurde die Hämostase als innerhalb eines physiologischen Zeitrahmens beurteilt und daher nicht als unerwünschtes Ereignis angesehen. Alle anderen in dieser Überprüfung einbezogenen Studien erwähnten keine Nebenwirkungen oder Komplikationen nach der Anwendung von HyA. Abgesehen von der Tatsache, dass HyA sicher in Verbindung mit chirurgischen LM3 oder nicht-chirurgischen Zahnextraktionen angewendet werden kann, können keine Schlussfolgerungen über die effizienteste HyA-Formulierung (z. B. niedrige vs. hohe Konzentration, nicht vernetzt vs. vernetzt, Gel vs. Spray) oder Anwendungsmodus (z. B. mit vs. ohne Träger, Häufigkeit) getroffen werden, und somit kann keine klare Empfehlung gegeben werden.
Insgesamt konnten hier nur eine begrenzte Anzahl gut gestalteter, randomisierter präklinischer und klinischer Studien identifiziert und in einer Metaanalyse zusammengefasst werden. Darüber hinaus besteht, wie oben dargelegt, ein Mangel an Konsens und Informationen zu den Details der HyA-Produkte, aber auch zu den chirurgischen Details (z. B. Schwierigkeitsgrad der Operation oder Design des Lappens). Diese Einschränkungen führten zu einer insgesamt niedrigen bis moderaten Evidenzsicherheit. In zukünftigen Studien sollte eine bessere und standardisierte Berichterstattung über die Details der HyA-Produkte, Dosierung und Anwendung sowie längere Nachbeobachtungszeiten implementiert werden, um eine umfassendere Bewertung des Potenzials der HyA-Anwendung im Zusammenhang mit der Zahnextraktion zu ermöglichen. Darüber hinaus sollten zukünftige aktualisierte systematische Übersichten, die eine größere Anzahl von Studien einbeziehen, auch in den Metaanalysen einen Vergleich zwischen Studien mit parallelen Armen und Studien im Split-Mouth-Design berücksichtigen. Dies wäre insbesondere für Parameter wie die Schmerzempfindung von Interesse, was hier aufgrund der sehr begrenzten Anzahl von Split-Mouth-Studien nicht möglich ist.
Fazit
Die Ergebnisse der vorliegenden systematischen Übersicht und Meta-Analysen zeigten, dass die intraoperativen Anwendungen von HyA in Verbindung mit der chirurgischen Entfernung des dritten Molars zu einer signifikanten Reduktion der Schmerzempfindung 7 Tage nach der Operation führten, während frühe postoperative Schmerzen, Trismus und das Ausmaß der Schwellung unbeeinflusst blieben. Darüber hinaus scheint die Anwendung von HyA einen positiven Effekt auf die Heilung des Weichgewebes nach nicht-chirurgischer Extraktion normalerweise durchgebrochener Zähne zu haben, jedoch scheint sie die Modellierung des alveolären Kamms nach der Extraktion nicht zu reduzieren, obwohl Hinweise aus präklinischen Studien darauf hindeuten, dass HyA die Knochenbildung fördern kann.
Autoren: Danijel Domic, Kristina Bertl, Tobias Lang, Nikolaos Pandis, Christian Ulm, Andreas Stavropoulos
Referenzen:
- Upadhyaya C, Humagain H (2010) Prävalenz von trockener Alveole nach der Extraktion permanenter Zähne am Kathmandu University Teaching Hospital (KUTH), Dhulikhel, Kavre, Nepal: eine Studie. Kathmandu Univ Med J (KUMJ) 8(29):18–24
- Akinbami BO, Godspower T (2014) Trockene Alveole: Inzidenz, klinische Merkmale und prädisponierende Faktoren. Int J Dent 2014:796102
- Duarte-Rodrigues L et al (2018) Entfernung des dritten Molars und ihre Auswirkungen auf die Lebensqualität: systematische Übersicht und Meta-Analyse. Qual Life Res 27(10):2477–2489
- Halabi D et al (2018) Chlorhexidin zur Prävention von alveolärer Osteitis: eine randomisierte klinische Studie. J Appl Oral Sci 26:e20170245
- Kan KW et al (2002) Residuale parodontaldefekte distal zum zweiten unteren Molar 6–36 Monate nach der Extraktion des impaktierten dritten Molars. J Clin Periodontol 29(11):1004–1011
- Peng KY et al (2001) Parodontalstatus des zweiten unteren Molars nach der Extraktion des dritten Molars. J Periodontol 72(12):1647–1651
- MacBeth N et al (2017) Veränderungen von Hart- und Weichgewebe nach der Erhaltung des alveolären Kamms: eine systematische Übersicht. Clin Oral Implants Res 28(8):982–1004
- Taberner-Vallverdú M et al (2015) Wirksamkeit verschiedener Methoden zur Behandlung trockener Alveolen: eine systematische Übersicht. Med Oral Patol Oral Cir Bucal 20(5):e633–e639
- Taberner-Vallverdú M, Sánchez-Garcés M, Gay-Escoda C (2017) Wirksamkeit verschiedener Methoden zur Prävention trockener Alveolen und Risikofaktoranalyse: eine systematische Übersicht. Med Oral Patol Oral Cir Bucal 22(6):e750–e758
- Han W et al (2022) Die entzündungshemmende Aktivität von spezifisch großen Hyaluronsäure-Oligosacchariden. Carbohydr Polym 276:118699
- Harris LG, Richards RG (2004) Adhäsion von Staphylococcus aureus an unterschiedlich behandelten Titanoberflächen. J Mater Sci Mater Med 15(4):311–314
- Romanò CL et al (2017) Hyaluronsäure und ihre Komposite als lokale antimikrobielle/antiadhäsive Barriere. J Bone Jt Infect 2(1):63–72
- Matheus HR et al (2021) Die Assoziation von Hyaluronsäure mit einem deproteinisierten bovinen Transplantat verbessert die Knochenreparatur und erhöht die Knochenbildung bei kritischen Knochendefekten. J Periodontol 92(11):1646–1658
- Yun J, Lee J, Ha CW et al (2021) Der Effekt eines 3D-gedruckten Polylactid-Schaums mit und ohne Hyaluronsäure auf die Knochenregeneration. J Periodontol 1–11. https://doi.org/10.1002/JPER.21-0428
- Shirakata Y et al (2021) Parodontalwundheilung/Regeneration von zweiwandigen intrabony Defekten nach rekonstruktiver Chirurgie mit quervernetztem Hyaluronsäure-Gel mit oder ohne Kollagenmatrix: eine präklinische Studie an Hunden. Quintessence Int 0(0):308–316
- Shirakata Y et al (2021) Heilung von buccalen Zahnfleischrezessionen nach Behandlung mit allein oder kombiniert mit einem coronalen fortgeschrittenen Lappen und einem quervernetzten Hyaluronsäure-Gel. Eine experimentelle Studie an Hunden. J Clin Periodontol 48(4):570–580
- Maria de Souza G et al (2020) Die Wirksamkeit von Hyaluronsäure bei der Kontrolle von Schmerzen, Ödemen und Trismus nach der Extraktion von dritten Molaren: systematische Übersicht und Meta-Analyse. J Oral Maxillofac Surg 14:14
- de Vries R et al (2015) Ein Protokollformat für die Vorbereitung, Registrierung und Veröffentlichung von systematischen Übersichten über tierexperimentelle Interventionen. Evid-Based Preclin Med 2:e00007
- Page MJ et al (2021) Die PRISMA 2020-Erklärung: eine aktualisierte Richtlinie zur Berichterstattung über systematische Übersichten. Syst Rev 10(1):89
- Hooijmans CR et al (2014) SYRCLEs Risiko von Bias-Tool für Tierstudien. BMC Med Res Methodol 14:43
- Sterne JAC et al (2019) RoB 2: ein überarbeitetes Tool zur Bewertung des Risikos von Bias in randomisierten Studien. BMJ 366:l4898
- Sterne JA et al (2016) ROBINS-I: ein Tool zur Bewertung des Risikos von Bias in nicht-randomisierten Studien zu Interventionen. BMJ 355:i4919
- Higgins JPT, Thompson SG, Spiegelhalter DJ (2009) Eine Neubewertung der Meta-Analyse mit zufälligen Effekten. J R Stat Soc A Stat Soc 172(1):137–159
- Wei D et al (2016) Die Anwendung des GRADE-Ansatzes in systematischen Übersichten über Tierstudien. J Evid Based Med 9(2):98–104
- Chen H et al (2015) Wie man gradepro gdt verwendet, um die Qualität der Evidenz in systematischen Übersichten über Interventionsstudien zu bewerten: Eine Einführung. Chin J Evid Based Med 15:600–606
- Mendes RM et al (2010) Auswirkungen von einwandigen Kohlenstoffnanoröhren und deren Funktionalisierung mit Natriumhyaluronat auf die Knochenreparatur. Life Sci 87(7–8):215–222
- Kapitan M et al (2021) Erste Beobachtungen von Faktoren, die die Behandlung von alveolärer Osteitis mit Hyaluronsäure und Octenidin beeinträchtigen – eine Reihe von Fallberichten. Biomolecules 11(8):04
- Martins-Junior PA et al (2016) Bewertung von Kohlenstoffnanoröhren, die mit Natriumhyaluronat funktionalisiert sind, in den Entzündungsprozessen für Anwendungen in der regenerativen Zahnmedizin. Clin Oral Invest 20(7):1607–1616
- Catanzano O et al (2018) Komposite Alginate-Hyaluronan-Schwämme zur Abgabe von Tranexamsäure in postextraktive alveoläre Wunden. J Pharm Sci 107(2):654–661
- Mendes RM et al (2008) Natriumhyaluronat beschleunigt den Heilungsprozess in Zahnsockeln von Ratten. Arch Oral Biol 53(12):1155–1162
- Sa MA et al (2013) Mit Natriumhyaluronat funktionalisierte Kohlenstoffnanoröhren stellen die Knochenreparatur in diabetischen Rattenzahnfächern wieder her. Oral Dis 19(5):484–493
- Kim JJ et al (2016) Hyaluronsäure verbessert die Knochenbildung in Extraktionsfächern mit chronischer Pathologie: eine Pilotstudie an Hunden. J Periodontol 87(7):790–795
- Kim JJ et al (2019) Biomodifikation von kompromittierten Extraktionsfächern mit Hyaluronsäure und rhBMP-2: eine experimentelle Studie an Hunden. J Periodontol 90(4):416–424
- Lee JB et al (2021) Auswirkungen von Hyaluronsäure und deproteinisiertem bovinem Knochenmineral mit 10% Kollagen auf die Erhaltung des Kamms in kompromittierten Extraktionsfächern. J Periodontol 23:23
- Koray M et al (2014) Wirksamkeit von Hyaluronsäurespray auf Schwellungen, Schmerzen und Trismus nach chirurgischer Extraktion von impaktierten unteren dritten Molaren. Int J Oral Maxillofac Surg 43(11):1399–1403
- Gocmen G et al (2015) Die antioxidative und entzündungshemmende Effizienz von Hyaluronsäure nach der Extraktion des dritten Molars. J Craniomaxillofac Surg 43(7):1033–1037
- Gocmen G et al (2017) Auswirkungen von Hyaluronsäure auf Blutungen nach der Extraktion des dritten Molars. J Appl Oral Sci 25(2):211–216
- Afat İM, Akdoğan ET, Gönül O (2018) Auswirkungen von leukocyte- und platelet-reichem Fibrin allein und in Kombination mit Hyaluronsäure auf Schmerzen, Ödeme und Trismus nach chirurgischer Extraktion von impaktierten unteren dritten Molaren. J Oral Maxillofac Surg 76(5):926–932
- Bayoum A, Nadershah M, Albandar A, Alsulaimani B, Sankour I et al (2018) Der Effekt von quervernetzter Hyaluronsäure bei der chirurgischen Extraktion von impaktierten unteren dritten Molaren. Int J Dent Oral Health 4(2). https://doi.org/10.16966/2378-7090.254
- Guazzo R et al (2018) Effekt auf die Wundheilung eines topischen Gels, das Aminosäuren und Natriumhyaluronat enthält, das auf die alveoläre Sockel nach der Extraktion des unteren dritten Molars aufgetragen wurde: Eine doppelt-blind randomisierte kontrollierte Studie. Quintessence Int 49(10):831–840
- Merchant R et al (2018) Vergleichende Bewertung der klinischen Wirksamkeit von Hyaluronsäurespray versus normaler Kochsalzlösung auf Schwellungen, Schmerzen und Trismus nach chirurgischer Extraktion des impaktierten unteren dritten Molars – eine randomisierte kontrollierte Split-Mouth-Studie. Int J Sci Res 7:152
- Afat IM, Akdoğan ET, Gönül O (2019) Auswirkungen von leukocyte- und platelet-reichem Fibrin allein und in Kombination mit Hyaluronsäure auf die frühe Weichgewebsheilung nach chirurgischer Extraktion von impaktierten unteren dritten Molaren: eine prospektive klinische Studie. J Craniomaxillofac Surg 47(2):280–286
- Munoz-Camara D, Pardo-Zamora G, Camacho-Alonso F (2020) Postoperative Effekte der intra-alveolären Anwendung von 0,2% Chlorhexidin oder 1% Hyaluronsäure-Bioadhesivgelen nach der Extraktion des unteren dritten Molars: eine doppelt-blind randomisierte kontrollierte klinische Studie. Clin Oral Investig 24:24
- Yilmaz N et al (2017) Die Wirksamkeit von Hyaluronsäure in postextraktionsfächern von impaktierten dritten Molaren: eine Pilotstudie. Niger J Clin Pract 20(12):1626–1631
- Yang H et al (2020) Nicht-Unterlegenheitsstudie zur Wirksamkeit von zwei Hyaluronsäureprodukten in post-extraktionsfächern von impaktierten dritten Molaren. Maxillofac Plast Reconstr Surg 42(1):40
- Favia G et al (2008) Beschleunigte Wundheilung von oralen Weichgeweben und angiogene Wirkung, die durch einen Pool von Aminosäuren in Kombination mit Natriumhyaluronat (AMINOGAM®) induziert wird. J Biol Regul Homeost Agents 22(2):109–116
- Bayoumi AM, Jan A, Amoudi WA, Shakir M (2015) Die Auswirkungen der Verwendung von Hyaluronsäure auf die Extraktionsfächer. Int J Dent Oral Health 2(1). https://doi.org/10.16966/2378-7090.157
- Alcântara CEP et al (2018) Hyaluronsäure beschleunigt die Knochenreparatur in menschlichen Zahnsockeln: eine randomisierte dreifach-blinde klinische Studie. Braz Oral Res 32:e84
- Lorenz J et al (2018) Injektierbares Knochenersatzmaterial auf Basis von beta-TCP und Hyaluronan erreicht eine vollständige Knochenregeneration bei nahezu vollständiger Abbau. Int J Oral Maxillofac Implants 33(3):636–644
- Marin S et al (2020) Ergebnis der Hyaluronsäurebehandlung auf die Wundheilung nach der Extraktion bei Patienten mit schlecht kontrolliertem Typ-2-Diabetes: eine randomisierte kontrollierte Split-Mouth-Studie. Med Oral Patol Oral Cir Bucal 25(2):e154–e160
- Mostafa D et al (2021) Effekt von Hyaluronsäuregel auf die Heilung einfacher Zahnentfernungssockel: eine Pilotstudie. Open Access Maced J Med Sci 9(D):190–195
- Eeckhout C et al (2022) Eine randomisierte kontrollierte Studie zur Bewertung von Hyaluronsäuregel als Wundheilungsmittel bei der Erhaltung des alveolären Kamms. J Clin Periodontol 49(3):280–291
- Cosola S, Oldoini G, Boccuzzi M, Giammarinaro E, Genovesi A, Covani U, Marconcini S (2022) Aminosäurenangereicherte Formel für die postoperative Pflege von Extraktionsfächern, bewertet durch 3D-intraorale Scans. Int J Environ Res Public Health 19(6):3302. https://doi.org/10.3390/ijerph19063302
- Cocero N et al (2019) Wirksamkeit von Natriumhyaluronat und synthetischen Aminosäuren in postextraktiven Fächern bei Patienten mit Leberversagen: Split-Mouth-Studie. J Biol Regul Homeost Agents 33(6):1913–1919
- Dubovina D et al (2016) Die Verwendung von Hyaluronsäure und Aminocapronsäure bei der Behandlung von alveolärer Osteitis. Vojnosanit Pregl 73(11):1010–1015
- Suchánek J, Ivančaková RK, Mottl R, Browne KZ, Pilneyová KC, Pilbauerová N, Schmidt J, Suchánková Kleplová T (2019) Hyaluronsäure-basiertes Medizinprodukt zur Behandlung von alveolärer Osteitis - klinische Studie. Int J Environ Res Public Health 16:3698. https://doi.org/10.3390/ijerph16193698
- Blum IR (2002) Zeitgenössische Ansichten zur trockenen Alveole (alveoläre Osteitis): eine klinische Bewertung der Standardisierung, Ätiopathogenese und Behandlung: eine kritische Überprüfung. Int J Oral Maxillofac Surg 31(3):309–317
- Lee J-B, Chu S, Amara HB et al (2021) Die Auswirkungen von Hyaluronsäure und deproteinisiertem bovinem Knochenmineral mit 10% Kollagen auf die Erhaltung des Kamms in kompromittierten Extraktionsfächern. J Periodontol 1–12. https://doi.org/10.1002/JPER. 20-0832
- Sá MA et al (2013) Mit Natriumhyaluronat funktionalisierte Kohlenstoffnanoröhren stellen die Knochenreparatur in diabetischen Rattenfächern wieder her. Oral Dis 19(5):484–493
- Marin S et al (2020) Hyaluronsäurebehandlungsergebnis auf die Wundheilung nach der Extraktion bei Patienten mit schlecht kontrolliertem Typ-2-Diabetes: eine randomisierte kontrollierte Split-Mouth-Studie. Medicina Oral, Patologia Oral y Cirugia Bucal 25(2):e154–e160
