Wiederholte lokale Verabreichung von Hyaluronsäuregel als unterstützende Behandlung von Residualtaschen bei Parodontalpatienten in der unterstützenden parodontalen Pflege. Eine randomisierte kontrollierte klinische Studie.
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziele Die Wirkung der Anwendung von Hyaluronsäure (HyA) als Ergänzung zur Re-Instrumentierung von Residualtaschen bei Patienten, die eine regelmäßige unterstützende parodontalmedizinische Behandlung (SPC) erhalten, zu bewerten.
Methoden Patienten mit chronischer Parodontitis (Stadium III und IV, Grad B und C) mit 4 interproximalen Residualtaschen wurden zufällig der Testgruppe (HyA-Gel) oder der Kontrollgruppe (Salzlösung) zugewiesen. Nach subgingivaler Instrumentierung wurde die Test- oder Kontrollsubstanz subgingival angewendet, dann täglich supragingival für 3 Monate, und falls erforderlich ein zweites Mal nach subgingivaler Re-Instrumentierung nach 3 Monaten. Klinische und patientenberichtete Ergebnisparameter wurden alle 3 Monate über 12 Monate erfasst. Der Taschenverschluss [Sondierungstiefen (PPD) ≤ 4 mm ohne Blutung bei Sondierung (BoP) bei PPD = 4 mm] war der Hauptausgangsparameter.
Ergebnisse Sechsundfünfzig Patienten (221 experimentelle Stellen) wurden analysiert. Der Taschenverschluss wurde in 56,8 % und 46,6 % der experimentellen Stellen in der Test- bzw. Kontrollgruppe erreicht (p > 0,05), während die mediane PPD und die PPD-Verteilung (< 5 mm/5 mm/ > 5 mm) signifikant zwischen den Gruppen zugunsten der Testgruppe bei 12 Monaten unterschiedlich waren. Darüber hinaus benötigten signifikant weniger Stellen in der HyA-Gruppe nach 3 Monaten eine Re-Instrumentierung, und Stellen in der HyA-Gruppe zeigten eine Tendenz zu geringeren Chancen, krank zu bleiben, im Vergleich zur Kontrollgruppe (OR 0,48, 95%CI 0,22–1,06). Die Chancen, dass eine Stelle nach 12 Monaten krank bleibt, erhöhten sich signifikant in Anwesenheit von Plaque (OR 7,94, 95%CI 4,12–15,28), aber im Allgemeinen verringerten sie sich signifikant über die Zeit (OR 0,48, 95%CI 0,28–0,81).
Fazit Die Re-Instrumentierung von Residualtaschen bei SPC-Patienten führt per se, zu einem signifikanten Anstieg der Taschenschließung über die Zeit; dies wurde durch eine schlechte Plaque-Kontrolle behindert. Die wiederholte lokale Anwendung von HyA führt zu weniger Stellen, die eine Re-Instrumentierung erfordern, und könnte die Rate der Taschenschließung leicht verbessern. (clinicaltrials.gov Registrierungsnr. NCT04792541).
Klinische Relevanz HyA-Gel ist einfach anzuwenden, wird von den Patienten gut akzeptiert und könnte einen positiven Effekt in Bezug auf weniger Stellen haben, die nach 3 Monaten eine Re-Instrumentierung erfordern, sowie eine höhere Taschenschließungsrate nach 12 Monaten.
Einleitung
Die initiale nicht-chirurgische subgingivale Instrumentierung (d.h. zweiter Schritt der Therapie), entweder von Hand oder mit (ultra)sonischen Instrumenten (oder einer Kombination davon), ist ein sehr erfolgreicher Behandlungsansatz bei Parodontitis-Patienten; im Durchschnitt kann eine flache Sondierungstiefen (PPD) in 3 von 4 Taschen erreicht werden. Kürzlich haben der World Workshop zur Klassifikation von parodontalen und peri-implantären Erkrankungen und Zuständen sowie die EFP S3-Level-Klinische Praxisleitlinie das Ziel der parodontalen Behandlung definiert. Auf der Standortebene wird die Taschenschließung als PPD ≤ 4 mm und kein Bluten bei Sondierung (BoP) definiert, während auf der Patientenebene ein erfolgreich behandelter stabiler Parodontitis-Patient durch 1) PPD von ≤ 4 mm, 2) keine PPD = 4 mm mit BoP und 3) Vollmund-BoP < 10% gekennzeichnet ist. Obwohl dieses Ziel schwer zu erreichen ist, wurde gezeigt, dass Patienten, die diese klinischen Endpunkte erreichen, eine reduzierte Rate an Krankheitsprogression/Rückfall und Zahnverlust aufgrund von Parodontitis während der langfristigen unterstützenden parodontalen Pflege (SPC) aufweisen. Daher wird die Verwendung von Zusatzprodukten (lokal oder systemisch verabreicht) während des zweiten Schrittes der Therapie häufig diskutiert, mit dem Ziel, 1) die Rate der Taschenschließung weiter zu verbessern, 2) den Bedarf an zusätzlicher chirurgischer Therapie zu reduzieren und/oder 3) die Rate zu verbessern, um einen erfolgreich behandelten stabilen Parodontitis-Patienten zu erreichen. Dies sollte wiederum nicht nur die langfristige Stabilität der Behandlung verbessern und den Zahnverlust reduzieren, sondern auch die Morbidität der Patienten minimieren und letztendlich die Behandlungskosten senken. Die verschiedenen Optionen und die Wirksamkeit von lokal verabreichten Zusatzstoffen (d.h. Wirtsmodulatoren oder Antimikrobiellen) während des zweiten Schrittes der Therapie wurden im Rahmen der EFP S3-Level-Klinischen Praxisleitlinie umfassend evaluiert. Es wurde schließlich vorgeschlagen, dass nur lokal angewendetes, nachhaltig freigesetztes Chlorhexidin und Antibiotika als gültige Optionen in Betracht gezogen werden können. In diesem Zusammenhang gibt es begrenzte Informationen über den „besten“ Zeitpunkt der Verabreichung von lokal angewendeten Zusatzstoffen, in Bezug auf (Kosten-)Effizienz, d.h. ob sie während des zweiten Schrittes der Therapie oder während des dritten oder vierten Schrittes der Therapie bei der Re-Instrumentierung von Residual-/Rückfalltaschen angewendet werden sollten. Unter Berücksichtigung der Patienten-, gesellschaftlichen und/oder möglichen biologischen Auswirkungen der unnötigen Verwendung von Zusatzmaßnahmen würde der letztere Ansatz es ermöglichen, deren Verwendung auf diejenigen Patienten/Stellen zu beschränken, die sich nach der initialen subgingivalen Instrumentierung nicht heilen. Zwei kürzlich durchgeführte systematische Übersichten behandelten die Wirksamkeit von Zusatzstoffen für Parodontitis-Patienten mit Residual-/Rückfalltaschen während der SPC. Insbesondere unter den lokal verabreichten Antimikrobiellen rangierten nachhaltig freigesetztes Chlorhexidin und Tetracyclin-Fasern am höchsten mit einer statistisch und klinisch signifikanten zusätzlichen PPD-Reduktion von etwa 0,6 bis 0,7 mm, während für keine andere adjunctive Behandlungsoption (d.h. andere als Antimikrobielle) ausreichende Beweise vorliegen.
Ein weiteres lokal verabreichtes Hilfsmittel, das jedoch weder in einer der oben genannten systematischen Übersichten noch in den EFP S3-Klinischen Praxisrichtlinien enthalten ist, ist Hyaluronsäure (HyA). Verschiedene Gele mit HyA in unterschiedlichen Konzentrationen wurden seit mehreren Jahren als Ergänzung zur nicht-chirurgischen mechanischen subgingivalen Instrumentierung getestet, und ihre Wirksamkeit wurde sogar in einigen systematischen Übersichten zusammengefasst. Diese Übersichten kamen zu gut vergleichbaren Schlussfolgerungen, d.h. die meisten der einbezogenen klinischen Studien berichteten von einem positiven, wenn auch moderaten, Effekt zugunsten von HyA hinsichtlich der Reduktion von PPD und BoP. Es gab jedoch eine große Variation in den Anwendungsmodi und -häufigkeiten in den Originalstudien, und alle Übersichten betonten die Notwendigkeit weiterer gut gestalteter randomisierter kontrollierter klinischer Studien (RCTs), einschließlich ausreichender Berichterstattung über Produktdetails. In diesem Zusammenhang ist derzeit unklar, ob die wiederholte Anwendung eines lokal verabreichten Hilfsmittels im Allgemeinen vorteilhaft ist im Vergleich zur einmaligen Anwendung, d.h. nur direkt nach der Instrumentierung. Dennoch haben 2 aktuelle RCTs die Anwendung von HyA in der Praxis speziell bei der Wiederinstrumentierung von verbleibenden/rückfallenden Taschen bewertet. Jede Studie testete ein anderes HyA-Produkt und eine andere Anwendungsfrequenz; in einer der Studien wurde HyA subgingival einmal angewendet, während in der anderen Studie HyA subgingival bei 2 aufeinanderfolgenden Terminen angewendet wurde, aber beide zeigten eine Tendenz zugunsten der HyA-Anwendung.
Daher scheint es sinnvoll zu sein, zu bewerten, ob die kombinierte lokale Anwendung von HyA, d.h. subgingival in der Praxis nach mechanischer Instrumentierung und wiederholt supragingival durch den Patienten einmal täglich für 3 Monate, das Potenzial hat, die Rate der Taschenverschluss im Vergleich zur erneuten Instrumentierung allein bei der Behandlung von Residualtaschen bei Parodontitis-Patienten, die eine regelmäßige SPC erhalten, zu verbessern.
Materialien und Methoden
Studiendesign und Teilnehmer
Die vorliegende Studie war eine randomisierte, doppelblinde (Patient und Beobachter), placebo-kontrollierte, parallel-gruppierte klinische Studie mit 12 Monaten Nachbeobachtung und wird gemäß den Standards für die Berichterstattung über klinische Studien (CONSORT-Erklärung; Anhang 1) berichtet. Das Protokoll wurde von der regionalen Ethikkommission genehmigt (Dnr. 2016/468) und bei clinicaltrials.gov registriert (NCT04792541); alle Änderungen im Protokoll nach dessen Veröffentlichung sind im Anhang 2 aufgeführt. Die Rekrutierung der Patienten erfolgte zwischen Dezember 2016 und Januar 2020, d.h. die Rekrutierung begann vor dem World Workshop zur Klassifikation von Parodontal- und peri-implantären Erkrankungen und Zuständen im Jahr 2017. Alle Parodontitis-Patienten, die die aktive Behandlungsphase seit ≥ 6 Monaten abgeschlossen hatten und in ein reguläres SPC-Programm (d.h. Schritt 4 der Behandlung) in einer Spezialklinik für Parodontologie (Öffentlicher Zahndienst, Värmland, Schweden) eingeschrieben waren und die folgenden Einschlusskriterien erfüllten, wurden nacheinander eingeschlossen: (i) 35 bis 75 Jahre alt, (ii) Diagnose einer chronischen Parodontitis, (iii) mindestens 10 verbleibende Zähne und (iv) 4 bis 8 interproximale Stellen mit PPD von ≥ 5 bis < 8 mm und Vorhandensein von BoP zum Zeitpunkt der Einschluss. Darüber hinaus wurden die folgenden Ausschlusskriterien definiert: (i) Molaren mit Furkationsbeteiligung Klasse II oder III, (ii) Zahnbeweglichkeit Klasse II oder III, (iii) > 2 mm tiefere PPD an einer anderen Stelle im gleichen interproximalen Raum, (iv) Antibiotikatherapie in den vorangegangenen 6 Monaten oder während der Studienteilnahme, (v) Bedarf an antibiotischer Prophylaxe vor der parodontalen Untersuchung und/oder Behandlung, (vi) langfristige Einnahme von entzündungshemmenden und immunsuppressiven Medikamenten, (vii) unkontrollierter oder neu diagnostizierter Diabetes vor oder während der Studienteilnahme, (viii) Schwangerschaft oder Stillzeit, (ix) schwere okklusale Dysfunktion, (x) laufende kieferorthopädische Behandlung und (xi) endodontische Läsionen. Alter, Geschlecht, Raucherstatus (d.h. nie / ehemaliger / aktueller Raucher) und Vorhandensein/Nichtvorhandensein eines gut kontrollierten Diabetes mellitus wurden für jeden Teilnehmer erfasst.
Test- und Placebo-Produkt
Das im „Test/HyA-Gruppe“ für sub- und supragingivale Anwendung verwendete Produkt war ein Gel, das Hyaluronsäure (0,3 %, nicht vernetzt, mittleres Molekulargewicht; Afta Clear™ Gel; Sunstar Europe SA, Etoy, Schweiz) enthielt, während die „Kontroll-/Placebo-Gruppe“ eine kleine Flasche mit physiologischer Kochsalzlösung erhielt. Beide Produkte wurden mit weißem Tape maskiert, sodass der Patient über die Gruppenzuteilung im Unklaren war.
Intervention, Randomisierung und Verblindung
Vor Beginn der Studie wurde eine zufällige Sequenzliste zur Gruppenzuteilung von einem nicht in den Rekrutierungsprozess einbezogenen Parodontologen (KB) computer-generiert (Verhältnis 1:1 für die Test/HyA- und Kontroll-/Placebo-Gruppe). Alle Teilnehmer wurden von einer der 3 erfahrenen Dentalhygienikerinnen (LG, AS, MSS) rekrutiert. Vier interproximale Stellen jedes Teilnehmers wurden als experimentelle Stellen definiert (d.h. mesio-bukkal, mesio-palatal/-lingual, disto-bukkal oder disto-palatal/-lingual); wenn möglich wurde 1 Stelle pro Quadrant gewählt, andernfalls mussten die experimentellen Stellen in verschiedenen interproximalen Räumen liegen. Alle Teilnehmer erhielten zu Beginn eine standardisierte SPC-Sitzung, die eine Re-Instrumentierung mit einem Ultraschallgerät (E.M.S. Electro Medical Systems S.A., Nyon, Schweiz) und/oder Handinstrumenten (HuFriedyGroup, Chicago, USA) aller verbleibenden Taschen durch eine der oben genannten 3 Dentalhygienikerinnen umfasste; jeder Patient wurde während der gesamten Studiendauer von derselben Dentalhygienikerin behandelt. Die Gruppenzuteilung wurde bis nach der Re-Instrumentierung der verbleibenden Taschen geheim gehalten. Nach der Re-Instrumentierung trat ein Parodontologe (AZ) der Behandlungssitzung bei, enthüllte die Gruppenzuteilung nur für sich selbst, indem er eine versteckte Notiz im Umschlag mit dem Fallbericht des Patienten öffnete, und wandte entweder das Test- oder das Placebo-Produkt subgingival an allen experimentellen Stellen an. Für die subgingivale Anwendung wurden das Test- und das Placebo-Produkt in eine sterile Spritze mit einer stumpfen Nadel überführt und die experimentellen Stellen wurden gefüllt, bis das Produkt aus der Tasche überlief (Abb. 1). Derselbe Parodontologe führte dieses Verfahren bei allen Teilnehmern durch, während die Dentalhygienikerinnen und Patienten blind gegenüber der Gruppenzuteilung blieben. Jeder Patient erhielt einen Informationsflyer mit einer Zusammenfassung der relevanten Anweisungen und einer Zeichnung, die die 4 experimentellen Stellen einschließlich der richtigen Größe der Interdentalbürsten (TePe Munhygienprodukter AB, Malmö, Schweden) für den spezifischen interproximalen Raum und entweder das Test- oder das Placebo-Produkt anzeigte. Die Patienten mussten das Produkt einmal täglich supragingival mit einer Interdentalbürste nach dem Zähneputzen, nur an den experimentellen Stellen, und für die kommenden 3 Monate bis zum zweiten SPC-Termin (d.h. 3-Monats-Nachuntersuchung) anwenden. Darüber hinaus wurden die Patienten angewiesen, das Zähneputzen oder Essen für 3 Stunden nach der Anwendung zu vermeiden und während der Teilnahme an der vorliegenden Studie keine Mundspülungen oder andere Gele zu verwenden. SPC-Sitzungen wurden nach 3, 6, 9 und 12 Monaten wiederholt, jedoch hörte der Patient nach den ersten 3 Monaten auf, das Test- oder Placebo-Produkt anzuwenden. Schließlich erhielten alle experimentellen Stellen mit PPD = 5 mm und BoP oder PPD > 5 mm bei der 3-Monats-Nachuntersuchung erneut eine Re-Instrumentierung und eine zweite subgingivale Anwendung des zugewiesenen Produkts, wie oben beschrieben. Im Allgemeinen erhielten alle Stellen mit PPD = 5 mm und BoP oder PPD > 5 mm bei einer der SPC-Sitzungen als Standardversorgung eine subgingivale Re-Instrumentierung.
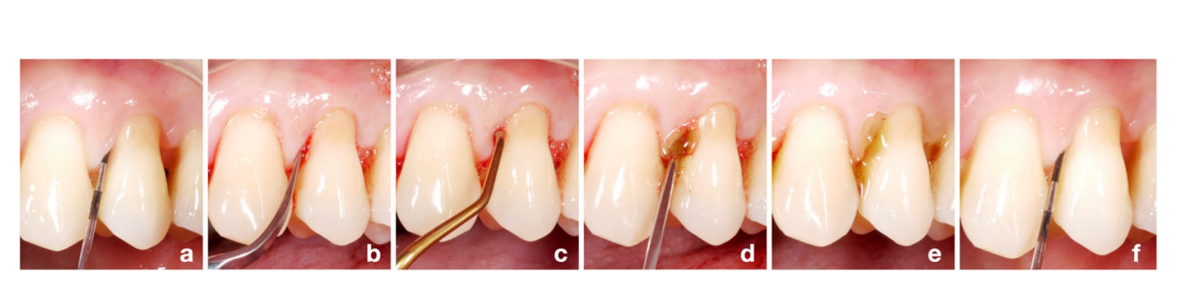
Ergebnisbewertung und Verblindung
Subgingivale mikrobiologische Probenahme von den 4 experimentellen Standorten wurde zu Beginn und nach 3, 6 und 12 Monaten durchgeführt. Die Ergebnisse der mikrobiologischen Probenahme werden an anderer Stelle berichtet. Darüber hinaus zeichnete die gleiche verblindete und kalibrierte Zahnmedizinische Fachangestellte (LG, AS, MSS) nach der mikrobiologischen Probenahme und bei jedem SPC (d.h. zu Beginn und nach 3, 6, 9 und 12 Monaten) PPD, klinisches Attachmentniveau (CAL), Vorhandensein/Nichtvorhandensein von BoP und Vorhandensein/Nichtvorhandensein von Plaque an jedem experimentellen Standort auf. Als Standard der Versorgung kontrolliert der Parodontologe (AZ) der spezifischen Spezialklinik die PPD-Messungen jedes Hygienikers etwa 2- bis 3-mal pro Jahr, was als Kalibrierung angesehen wurde. Darüber hinaus wurden die Patienten bei jedem Follow-up nach Änderungen in ihrer Krankengeschichte und nach der Einnahme von Antibiotika in den letzten 3 Monaten gefragt. Beim zweiten SPC (d.h. 3-Monats-Nachuntersuchung) erhielten die Patienten zusätzlich einen kurzen Fragebogen zu ihrer Meinung über das getestete Produkt. Der Fragebogen fragte nach dem Vorhandensein und der Intensität von Schmerzen während der Anwendung und nach der Meinung der Patienten zur Konsistenz und zum Geschmack des Produkts während der Anwendung zu Hause, wobei eine Skala von 1 bis 10 verwendet wurde. Ein erfolgreicher Behandlungserfolg (d.h. Taschenverschluss) wurde definiert als PPD≤ 4 mm mit Abwesenheit von BoP bei PPD = 4 mm; wenn diese Kriterien nicht erfüllt waren, blieb der experimentelle Standort als "erkrankt" klassifiziert. Dieses zusammengesetzte Ergebnis wurde als primärer Ergebnisparameter definiert und bei jedem SPC bewertet.
Folgekriterien für die Teilnahme
Die Patienten wurden alle 3 Monate für SPC eingeplant, jedoch war ein Zeitraum von 2,5 bis 5 Monaten zwischen 2 SPC-Sitzungen erlaubt; wenn der Zeitraum zwischen 2 SPC-Sitzungen 5 Monate überschritt, wurde der SPC-Termin als verpasst angesehen. Darüber hinaus durfte der Gesamtzeitraum vom ersten bis zum fünften SPC-Termin 18 Monate nicht überschreiten, andernfalls wurde der Patient ausgeschlossen. Da mehrere Patienten vor dem Ausbruch der Covid-19-Pandemie eingeschlossen wurden, durften Patienten entweder den 6- oder 9-Monats-Termin versäumen, ohne aus der Studie ausgeschlossen zu werden. Patienten, die 2 SPC-Sitzungen oder den 3- oder 12-Monats-Termin versäumten, wurden jedoch ebenfalls ausgeschlossen.
Berechnung der Stichprobengröße
Für die Berechnung der Stichprobengröße wurde angenommen, dass 75 und 25 % der Stellen in der Test-/HyA- und Kontroll-/Placebo-Gruppe jeweils eine Taschenverschluss erreichen würden, d.h. PPD ≤ 4 mm mit Abwesenheit von BoP bei PPD = 4 mm. In Anwesenheit dieser klinischen Parameter wird das Risiko für das Fortschreiten der Krankheit als gering angesehen und die Behandlung als erfolgreich. Basierend auf dem Datensatz einer vorherigen Veröffentlichung wird ein intraindividueller Korrelationskoeffizient von 0,42 für das Vorhandensein von BoP angenommen. Basierend auf diesem Korrelationskoeffizienten, einer Power von 0,80 und einem Alpha-Wert von 0,05 wurde eine Stichprobengröße von 30 Teilnehmern pro Gruppe (d.h. eine Gesamtstudienpopulation von 60) berechnet. Um Ausfälle auszugleichen, wurden insgesamt 80 Patienten (40 Patienten pro Gruppe) nacheinander rekrutiert.
Statistische Analyse
Die Häufigkeitsverteilung für kategoriale Variablen (wie Geschlecht, Raucherstatus, PPD-Verteilung usw.) und Mittelwerte (Standardabweichungen) oder Mediane und Interquartilsabstände für kontinuierliche Variablen (wie Alter, PPD usw.) werden separat für die Test-/HyA- und Kontroll-/Placebo-Gruppe berichtet. Um Unterschiede zwischen der Test-/HyA- und der Kontroll-/Placebo-Gruppe zu testen, wurde entweder der exakte Fisher-Test oder der Chi-Quadrat-Test für kategoriale Parameter angewendet (d.h. der Chi-Quadrat-Test wurde angewendet, wenn jede Zelle eine Häufigkeit > 5 aufwies) und für kontinuierliche Variablen entweder ein unabhängiger t-Test (für normalverteilte Daten) oder ein Mann-Whitney-U-Test (für nicht normalverteilte Daten). Die Normalverteilung der Daten wurde mit dem Shapiro-Wilk-Test überprüft. Der „Gesundheitszustand der experimentellen Stelle“ wurde als primärer Ergebnisparameter definiert [dichotom; „erkrankt“ (d.h. PPD > 4 mm oder PPD = 4 mm mit BoP) versus „erfolgreich behandelt/Taschenverschluss“ (d.h. PPD ≤4 mm ohne BoP bei PPD = 4 mm). Es wurden zwei multivariable gemischte logistische Regressionsmodelle berechnet, wobei die Gruppenzuteilung als Hauptprädiktor und die folgenden a priori Störfaktoren berücksichtigt wurden: 1) Zahnart (Frontzahn / Prämolar / Molaren), 2) interproximaler Bereich (bukkal / palatinal/lingual), 3) PPD zu Beginn an der experimentellen Stelle (5 mm / 6–7 mm), 4) Plaque an der experimentellen Stelle bei jedem Termin (abwesend / vorhanden), 5) Raucherstatus (nie / ehemalig / aktuell), 6) Geschlecht (weiblich / männlich), 7) Zeitspanne zwischen den Terminen (Monate) und 8) Alter (Jahre). Das erste Modell umfasste nur die 3-Monats-Daten, während das zweite Modell alle über einen Zeitraum von 12 Monaten gesammelten Daten beinhaltete; in letzterem Modell wurde ein zusätzlicher Störfaktor hinzugefügt, d.h. Zeitpunkt (3- / 6- / 9- / 12-Monats-Nachverfolgung). Die statistische Analyse wurde mit STATA/IC 17.0 für Mac (Lakeway Drive, Texas, USA) durchgeführt, und ein p-Wert ≤ 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Merkmale der Population zu Beginn (Patientenebene)
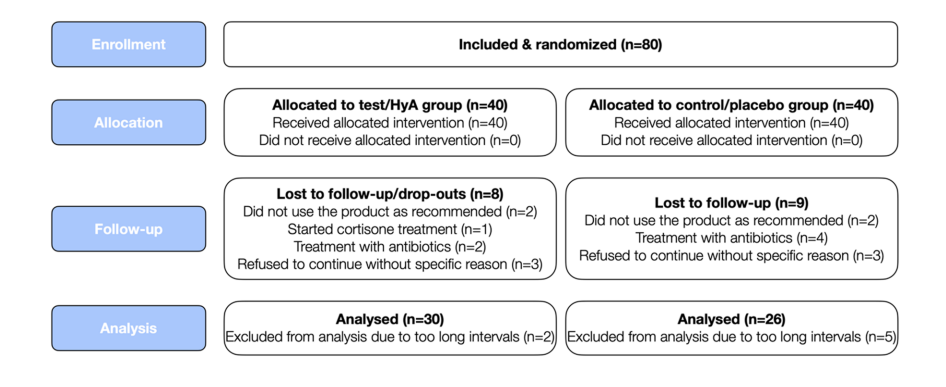
Achtzig Patienten mit chronischer Parodontitis (entsprechend Patienten mit Parodontitis im Stadium III und IV sowie Grad B und C), die sich einer regelmäßigen SPC unterzogen, wurden rekrutiert und randomisiert. Insgesamt fielen 24 Teilnehmer aus oder konnten aus verschiedenen Gründen nicht in die Analyse einbezogen werden (für Details siehe Abb. 2). Die Merkmale der 56 Patienten (d.h. 30 und 26 Patienten in der Test/HyA- und Kontroll/Placebo-Gruppe, jeweils) die zur Analyse beitrugen, sind in Tabelle 1 dargestellt; keine der Basismerkmale auf Patientenebene unterschied sich signifikant zwischen den 2 Gruppen. Kurz gesagt, die Stichprobe 1) bestand aus ca. 66% Frauen, 2) hatte ein Durchschnittsalter von 58 Jahren, 3) umfasste ungefähr 46% aktuelle Raucher und 4) hatte 3 gut kontrollierte Diabetiker.
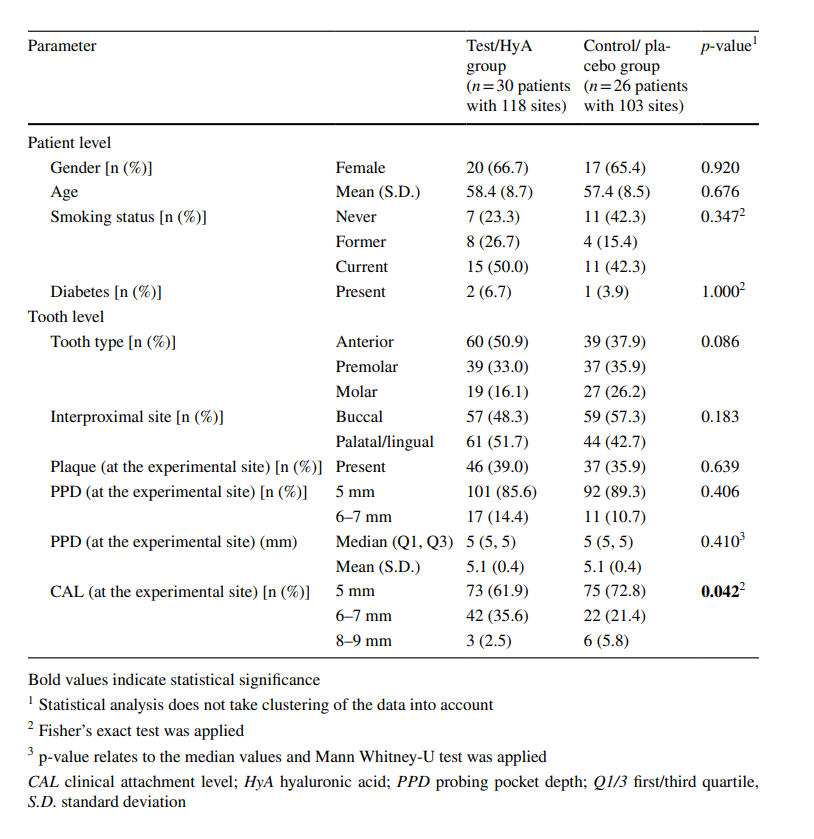
Merkmale der experimentellen Standorte zu Beginn (auf Zahn-Ebene)
Die Stichprobe umfasste 221 experimentelle Standorte, die alle gemäß den Eignungskriterien als „erkrankt“ mit Vorhandensein von BoP zu Beginn beurteilt wurden. Außer bei 3 Patienten trug jeder Patient mit 4 experimentellen Standorten bei. Drei experimentelle Standorte (jeweils ein Standort von 2 Test/HyA-Patienten und 1 Kontroll-/Placebo-Patient) mussten ausgeschlossen werden, da eine Rehabilitation mit einer neuen prothetischen Restauration am experimentellen oder benachbarten Zahn stattfand (n = 2) und aufgrund eines Patienten, der versehentlich das Produkt am kontralateralen Zahn, d.h. am falschen, anwendete (n = 1). Die Ausgangsmerkmale der experimentellen Standorte der Test/HyA- und Kontroll-/Placebo-Gruppe sind in Tabelle 1 dargestellt. Zahntyp, interproximale Standorte, Plaque und PPD waren gut zwischen den 2 Gruppen verteilt, während die Test/HyA-Gruppe signifikant mehr Standorte mit einem CAL ≥ 6 mm im Vergleich zur Kontroll-/Placebo-Gruppe aufwies (p = 0.042). Die meisten Standorte wiesen zu Beginn einen PPD von 5 mm auf, während 14,4 % bzw. 10,7 % der Test/HyA- und Kontroll-/Placebo-Gruppe zu Beginn einen PPD von 6 bis 7 mm hatten.
Merkmale der experimentellen Standorte nach 3 Monaten (Zahnebene)
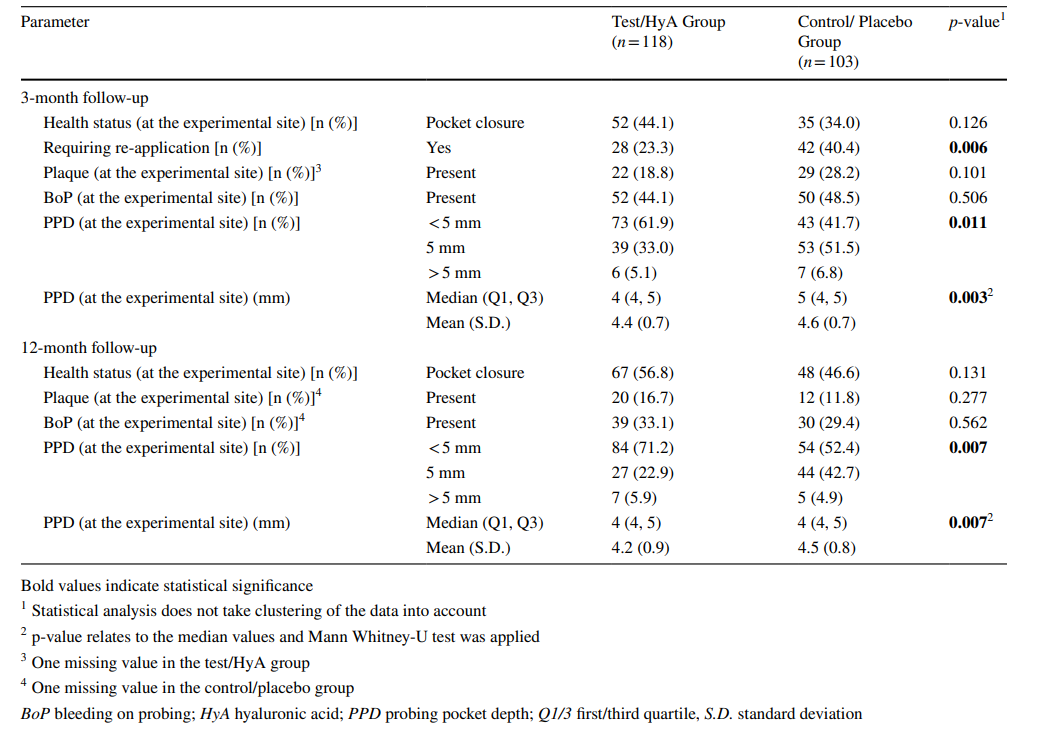
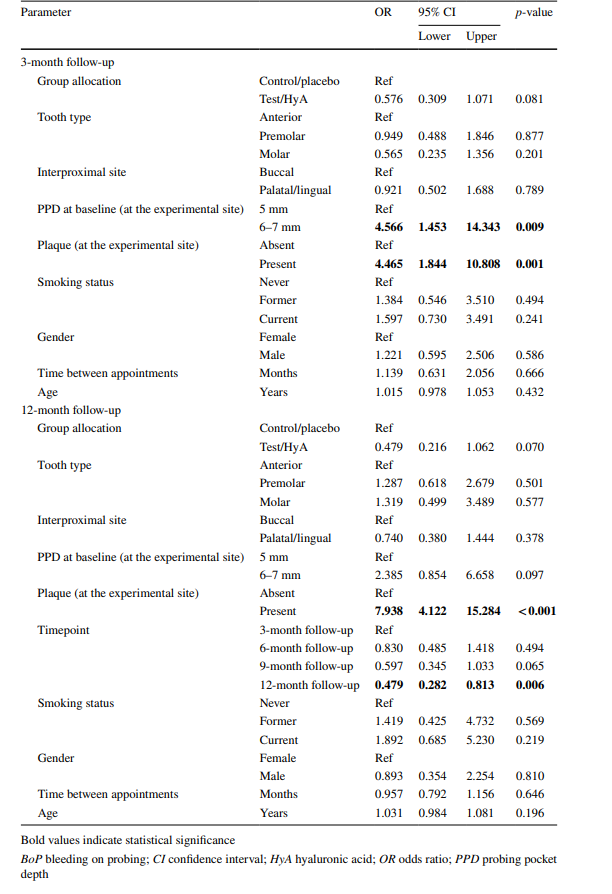
Die Merkmale der experimentellen Standorte nach 3 Monaten sind in Tabelle 2 aufgeführt. Nach 3 Monaten erreichten 44,1 und 34,0 % der experimentellen Standorte der Test-/HyA- und Kontroll-/Placebo-Gruppe jeweils eine Taschenverschluss ohne signifikanten Unterschied zwischen den Gruppen. Ebenso war das Vorhandensein von Plaque und BoP zwischen den 2 Gruppen vergleichbar. Dennoch unterschieden sich der mediane PPD (p = 0,003) und die PPD-Verteilung (< 5 mm / 5 mm / > 5 mm; p = 0,011) signifikant zwischen den Gruppen zugunsten der Test-/HyA-Gruppe. Konkret wiesen 61,9 und 41,7 % der experimentellen Standorte der Test-/HyA- und Kontroll-/Placebo-Gruppe jeweils einen PPD < 5 mm auf. Darüber hinaus benötigten signifikant weniger Standorte in der Test-/HyA-Gruppe (p = 0,006) im Vergleich zur Kontroll-/Placebo-Gruppe, 23,3 und 40,4 %, jeweils, eine subgingivale Wiederanwendung bei der 3-Monats-Nachuntersuchung.
Bewertung des Behandlungsergebnisses nach 3 Monaten
Die Ergebnisse der multivariablen gemischten logistischen Regressionsanalyse nach 3 Monaten SPC sind in Abb. 3a und Tabelle 3 dargestellt. Die experimentellen Standorte in der Test/HyA-Gruppe hatten leicht, aber statistisch nicht signifikant niedrigere Chancen im Vergleich zur Kontroll-/Placebogruppe, „krank“ zu bleiben (d.h. PPD > 4 mm oder PPD = 4 mm mit BoP) (OR 0.58, 95% CI 0.31–1.07; p = 0.081). Von den einbezogenen Störfaktoren hatten nur Plaque und PPD zu Beginn einen signifikanten Einfluss auf das Ergebnis. Insbesondere erhöhte das Vorhandensein von Plaque (OR 4.47, 95% CI 1.84–10.81; p = 0.001) und ein höherer PPD zu Beginn (OR 4.57, 95% CI 1.45–14.34; p = 0.009) signifikant die Chancen, beim 3-Monats-Follow-up „krank“ zu bleiben.
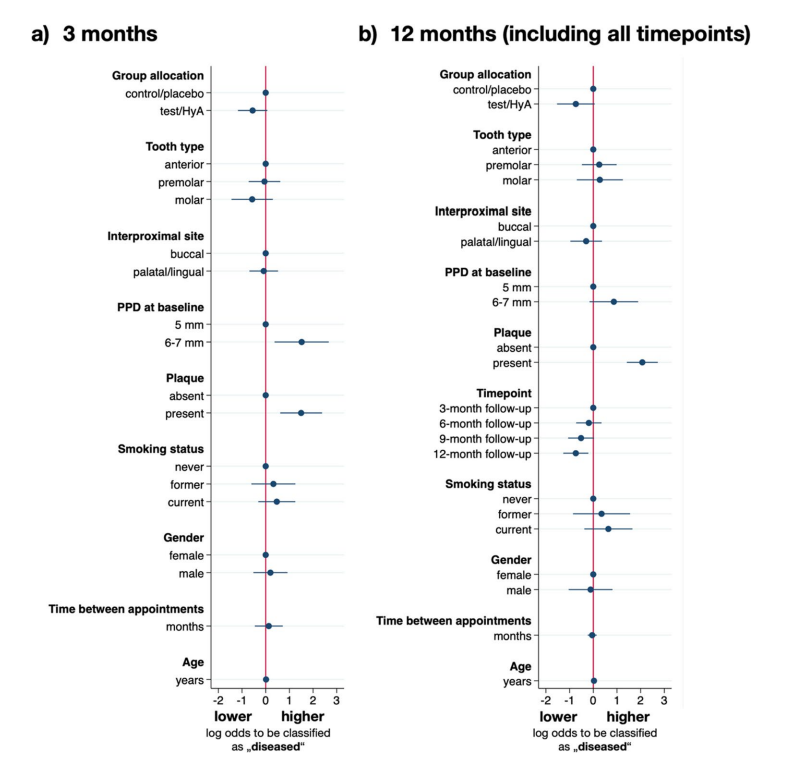
Merkmale der Experimentierorte nach 12 Monaten (Zahnebene)
Die Merkmale der experimentellen Standorte bei der abschließenden Bewertung (12-Monats-Nachuntersuchung) sind in Tabelle 2 aufgeführt. Bei der abschließenden Bewertung erreichten 56,8 % und 46,6 % der experimentellen Standorte der Test/HyA- und Kontroll/Placebo-Gruppe jeweils eine Taschenverschluss ohne signifikanten Unterschied zwischen den Gruppen. Ähnlich waren das Vorhandensein von Plaque und BoP zwischen den 2 Gruppen vergleichbar. Dennoch unterschieden sich der mediane PPD (p = 0,007) und die PPD-Verteilung (< 5 mm / 5 mm / > 5 mm; p = 0,007) signifikant zwischen den Gruppen zugunsten der Test/HyA-Gruppe. Konkret wiesen 71,2 % und 52,4 % der Test/HyA- und Kontroll/Placebo-Standorte jeweils einen PPD < 5 mm auf, und der mediane PPD war in der Test/HyA-Gruppe niedriger. In der Test/HyA-Gruppe waren von 28 experimentellen Standorten, die nach 3 Monaten erneut behandelt wurden, 28,6 % nach 12 Monaten nicht mehr erkrankt, während von 90 experimentellen Standorten, die nach 3 Monaten nicht erneut behandelt wurden, 34,4 % wieder als „erkrankt“ eingestuft wurden. In der Kontroll/Placebo-Gruppe waren von 42 experimentellen Standorten, die nach 3 Monaten erneut behandelt wurden, 33,3 % nach 12 Monaten nicht mehr erkrankt, während von 61 experimentellen Standorten, die nach 3 Monaten nicht erneut behandelt wurden, 44,3 % wieder als „erkrankt“ eingestuft wurden.
Bewertung des Behandlungsergebnisses nach 12 Monaten
Die Ergebnisse der multivariaten gemischten logistischen Regressionsanalyse sind in Abb. 3b und Tabelle 3 dargestellt. Die experimentellen Standorte der Test/HyA-Gruppe hatten im Vergleich zur Kontroll-/Placebogruppe leicht, aber statistisch nicht signifikant niedrigere Chancen, „krank“ zu bleiben (d.h. PPD > 4 mm oder PPD = 4 mm mit BoP) (OR 0.48, 95% CI 0.22–1.06; p = 0.070). Von den einbezogenen Störfaktoren hatte nur Plaque und der Zeitpunkt einen signifikanten Einfluss auf das Ergebnis. Insbesondere erhöhte das Vorhandensein von Plaque die Chancen, „krank“ zu bleiben, um etwa das 8-Fache (OR 7.94, 95% CI 4.12–15.28; p < 0.001), und im Allgemeinen nahmen die Chancen, „krank“ zu bleiben, während des Studienzeitraums ab und erreichten bei der abschließenden Bewertung Signifikanz (OR 0.48, 95% CI 0.28–0.81; p = 0.006).
Meinung der Patienten
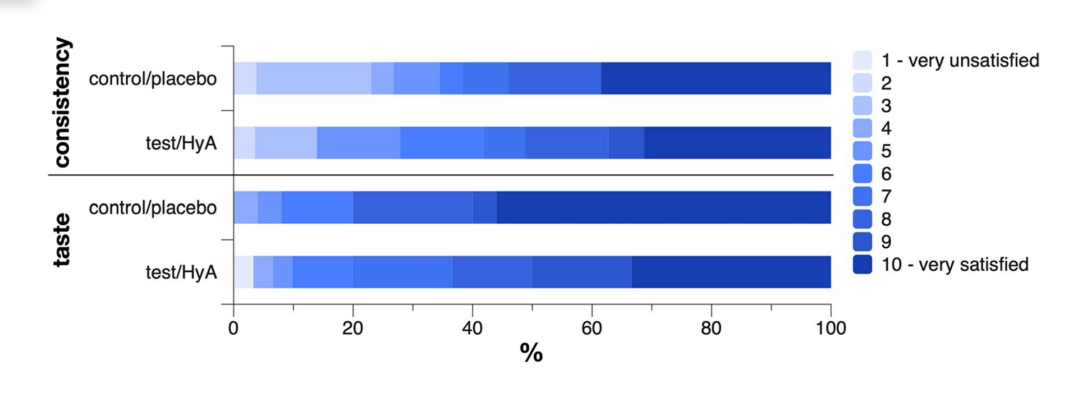
Ein Patient aus jeder Gruppe berichtete, während der Anwendung des Produkts Schmerzen am Zahnfleisch mit einer Intensität von 3 bis 4 auf einer Skala von 10 erlebt zu haben, wobei 10 maximale Schmerzen darstellt. Ein Patient der Test-/HyA-Gruppe gab keine Antwort zur Konsistenz und ein Patient der Kontroll-/Placebo-Gruppe gab keine Antwort zum Geschmack. Die Gruppen wiesen keinen signifikanten Unterschied in ihrer Meinung zur Konsistenz und zum Geschmack des Produkts auf (Abb. 4). Konkret lagen die Mittelwerte (Standardabweichung) der Skala für die Konsistenz bei 7,2 (2,6) und 7,0 (3,0) in der Test-/HyA- und Kontroll-/Placebo-Gruppe, respektive (p = 0,822), und die Medianwerte (erstes, drittes Quartil) der Skala für den Geschmack lagen bei 8,5 (7, 10) und 10 (8, 10) in der Test-/HyA- und Kontroll-/Placebo-Gruppe, respektive (p = 0,184); für beide Parameter stellte ein Wert von 10 dar, dass man sehr zufrieden war.
Sicherheit
Keiner der Patienten berichtete über Nebenwirkungen/Komplikationen im Zusammenhang mit der Produktanwendung, und es konnten klinisch keine unerwünschten Ereignisse beobachtet werden.
Diskussion
Lokal verabreichte Chemotherapeutika werden häufig als Ergänzung zur nicht-chirurgischen Behandlung bei Parodontitis-Patienten eingesetzt, entweder in der Anfangsphase der Behandlung oder bei verbleibenden/rückfallenden Taschen in einem späteren Behandlungsstadium. Da die anfängliche nicht-chirurgische subgingivale Instrumentierung jedoch eine recht erfolgreiche Behandlung an sich ist, könnte ein spezifischerer Ansatz für Taschen, die während des zweiten Schrittes der Therapie nicht geheilt sind, und/oder für rückfallende Taschen während der SPC der relevantere Ansatz sein. Hier zeigte ein HyA-haltiges Gel, das über einen Zeitraum von 3 Monaten wiederholt (täglich) als Ergänzung zur Reinstrumentierung von verbleibenden/rückfallenden Taschen bei Patienten, die eine regelmäßige SPC durchlaufen, angewendet wurde, eine gewisse Tendenz zur Verbesserung des Ergebnisses, d.h. eine um 10% höhere Rate an Taschenschlüssen wurde für die Stellen beobachtet, die HyA erhielten, im Vergleich zu denen in der Kontrollgruppe, die eine physiologische Kochsalzlösung erhielten (d.h. 57 gegenüber 47% der Stellen, jeweils), nach 12 Monaten. Darüber hinaus war der Prozentsatz der experimentellen Stellen mit PPD < 5 mm in der Test-/HyA-Gruppe etwa 1,4-mal höher im Vergleich zur Kontroll-/Placebo-Gruppe (d.h. 71 und 52% der Stellen, jeweils).
Diese Ergebnisse stimmen mit denen überein, die in 2 aktuellen RCTs berichtet wurden, die ein HyA-haltiges Gel als Ergänzung zur Re-Instrumentierung von residualen/rezidivierenden Taschen bewerteten und zeigten, dass die Verwendung eines HyA-haltigen Gels zu einer Tendenz für überlegene Ergebnisse im Vergleich zur reinen Re-Instrumentierung führte. Darüber hinaus berichteten beide Studien in ihrer Testgruppe von einer ähnlichen Häufigkeit von Stellen mit PPD < 5 mm nach 12 Monaten wie hier, d.h. 76 bis 77 % in den 2 vorherigen Studien und 71 % hier. Darüber hinaus wurde in einer der RCT-Studien, die über die Taschenverschluss berichtete (d.h. PPD ≤ 4 mm ohne BoP), eine vergleichbare Rate in der HyA-Gruppe wie hier beobachtet, d.h. in 59 und 57 %, respektive. Ein signifikanter Unterschied zwischen diesen 2 RCTs und der aktuellen Studie betrifft jedoch die Produkteigenschaften des angewandten HyA-Gels. Konkret wurde in dieser Studie ein nicht vernetztes, mittel-molekulares HyA mit einer relativ niedrigen Konzentration (0,3 %) verwendet, während die anderen Studien entweder ein Produkt mit vernetztem, hochmolekularem HyA in höherer Konzentration oder ein Kombinationsprodukt mit Polynukleotiden und hochmolekularem HyA in höherer Konzentration verwendeten. Laborstudien zu parodontalen Zellen oder parodontalen Pathogenen haben die Auswirkungen von entweder nicht vernetztem und vernetztem HyA oder von HyA unterschiedlicher Molekulargewichte verglichen; keine der getesteten Formulierungen zeigte negative Auswirkungen auf die parodontalen Wundheilung. In diesem Zusammenhang bleibt aufgrund des Fehlens vergleichender klinischer Studien bis jetzt unklar, ob unterschiedliche HyA-Eigenschaften tatsächlich in klinisch relevanten Unterschieden resultieren. Ein weiterer Unterschied zwischen diesen 2 RCTs und hier betrifft den Anwendungsmodus/-häufigkeit von HyA. In dieser Studie wurde das HyA-haltige Gel wiederholt (täglich) supragingival über einen Zeitraum von 3 Monaten von den Patienten zusätzlich zu den subgingivalen In-Office-Anwendungen angewendet. Eine der vorherigen Studien bewertete die Wirkung einer wiederholten In-Office-Anwendung nach 3 Monaten, konnte jedoch keinen zusätzlichen positiven Effekt von HyA nach der Wiederanwendung zeigen; jedoch wurde vor der Wiederanwendung in dieser speziellen Studie keine zusätzliche subgingivale Instrumentierung durchgeführt. Hier erhielten nur Stellen mit verbleibenden Anzeichen von Pathologie eine Wiederanwendung in Kombination mit subgingivaler Re-Instrumentierung. In beiden Gruppen (d.h. Test- und Kontrollgruppe) wurden etwa 30 % der Stellen, die eine Re-Instrumentierung und Wiederanwendung benötigten, am Ende der Studie als erfolgreich behandelt beurteilt. Dennoch, obwohl die Nachbehandlung die Situation in 1 von 3 Fällen verbesserte und kein deutlicher positiver Effekt von HyA festgestellt werden konnte, war die Anzahl der Stellen, die eine Re-Instrumentierung (Nachbehandlung) nach 3 Monaten benötigten, in der HyA-Gruppe signifikant niedriger im Vergleich zur Gruppe, die NaCl erhielt. Schließlich erlauben auch die aktuellen Daten keine Schlussfolgerung über einen potenziellen zusätzlichen Effekt der wiederholten supragingivalen Anwendung durch die Patienten über 3 Monate, da hier eine dritte Gruppe mit nur subgingivaler In-Office-Abgabe fehlte.
Im Allgemeinen hat sich gezeigt, dass die Reduzierung der Anzahl der Residualtaschen nach aktiver parodontaler Behandlung (d.h. Schritt 1 bis 3) in verschiedenen Studien, die sich auf langfristige SPC nach aktiver parodontaler Behandlung konzentrieren, vorteilhaft in Bezug auf Krankheitsrückfall/Fortschreiten und Zahnverlust ist. Daher ist es vernünftig anzunehmen, dass jede Behandlungsmaßnahme, wie die Verwendung von lokal angewendeten Hilfsmitteln, die die Rate der Taschenverschließung verbessert – unabhängig vom Behandlungsstadium – auch positiv zum langfristigen Ergebnis beitragen kann. In diesem Zusammenhang haben HyA-haltige Gele als Ergänzung zur subgingivalen Instrumentierung im zweiten Schritt der Therapie ein gewisses Potenzial hinsichtlich der Reduktion von PPD und BoP gezeigt, was durch neuere RCTs erneut bestätigt wurde. Im Vergleich zu anderen Studien mit einem ähnlichen Studiendesign, die jedoch unterschiedliche Produkte als Ergänzungen zur Reinstrumentierung von Residualtaschen bei SPC-Patienten bewerteten, schien die Häufigkeit der Taschenverschließung hier etwas niedriger zu sein. Zum Beispiel berichteten 2 aktuelle RCTs über den ergänzenden Effekt der flaplosen Anwendung von Schmelzmatrixderivaten, Natriumhypochloritgel und Chlorhexidingel von Taschenverschlüssen (d.h. PPD ≤ 4 mm ohne BoP) in 80, 78 und 63% der Stellen im Vergleich zu 57% hier. Daher und unter Berücksichtigung des Mangels an RCTs, die diese Produkte direkt vergleichen, schien HyA ähnlich effektiv wie CHX-Gel, jedoch leicht unterlegen gegenüber Schmelzmatrixderivaten und Natriumhypochloritgel. Letzteres könnte von spezifischem Interesse sein, da die Kombination von Natriumhypochloritgel mit vernetzten HyA-Gel kürzlich als kombinierte ergänzende Behandlung bei Parodontalerkrankungen Aufmerksamkeit erhalten hat. Eine aktuelle retrospektive Fallserie, die 29 SPC-Patienten mit Residual-/Rückfalltaschen einbezog, berichtete jedoch für diesen kombinierten Ansatz von einer etwas niedrigeren Taschenverschließungsrate von 25%.
Unter den Störfaktoren, die zur Anpassung der vorliegenden Analyse verwendet wurden, hatten zwei einen signifikanten Einfluss auf das Ergebnis bei der abschließenden Bewertung, d.h. Plaque-Kontrolle und Compliance/Zeit, die beide gut mit der Literatur übereinstimmen. Insbesondere senkte das Vorhandensein von Plaque, das an jedem experimentellen Standort bei jeder SPC-Sitzung bewertet wurde, signifikant die Wahrscheinlichkeit, eine Taschenverschluss zu erreichen. Patienten erfolgreich zu motivieren, während der SPC kontinuierlich hohe Plaque-Kontrollniveaus aufrechtzuerhalten, ist eine wohlbekannte klinische Herausforderung, und aktuelle Langzeit-SPC-Studien haben die klinische Relevanz davon erneut bestätigt. Beide Studien, die jeweils 100 und > 200 Personen umfassten, die nach aktiver parodontaler Behandlung etwa 10 Jahre SPC durchliefen, zeigten ein erhöhtes Risiko für Krankheitsrückfälle und Zahnverlust aufgrund von Parodontitis bei schlechter Plaque-Kontrolle. Darüber hinaus zeigten die Patienten der vorliegenden RCT im Allgemeinen und unabhängig von der Gruppenzuteilung eine signifikante Verbesserung im Laufe der Zeit, die nach 12 Monaten signifikant wurde. Insbesondere erreichten auch in der Kontroll-/Placebo-Gruppe fast 50 % der experimentellen Standorte am Ende der Studie einen Taschenverschluss. Diese Effektgröße, einen Taschenverschluss nur durch mechanische Reinstrumentierung zu erreichen, ist gut vergleichbar mit früheren Studien, die Raten von 42 bis 60 % berichteten. Darüber hinaus hat die Teilnahme an der Studie per se wahrscheinlich einen positiven Einfluss auf die Compliance aus der Perspektive des Patienten, aber auch aus der Perspektive des behandelnden Zahnarztes/Zahnmedizinischen Fachangestellten, der möglicherweise mehr darauf besteht, den 3-Monats-Intervall einzuhalten. In diesem Zusammenhang wurde gezeigt, dass eine kürzere Zeit zwischen aufeinanderfolgenden SPC-Sitzungen im Laufe der Zeit zu reduzierten PPD und parodontaler Stabilität führen kann, während eine längere Zeit zu parodontaler Instabilität und anschließendem Zahnverlust führen kann.
Die vorliegende Studie – durchgeführt unter „realen“ Bedingungen – hat einige Einschränkungen, wie eine relativ hohe Abbruchrate von 30%, die es uns nicht ermöglichte, die angestrebte Stichprobengröße in der Kontroll-/Placebo-Gruppe zu erreichen, d.h. es wurden 26 anstelle von 30 Teilnehmern analysiert. Die hohe Abbruchrate ist zumindest teilweise darauf zurückzuführen, dass Teilnehmer ihre geplanten Termine während der Covid-19-Pandemie verpasst haben, d.h. obwohl ein Zeitraum von 2,5 bis 5 Monaten zwischen 2 SPC-Sitzungen akzeptiert wurde, wurden fast 10% der Teilnehmer (d.h. 2 und 5 der Test-/HyA- und Kontroll-/Placebo-Gruppe, jeweils) aufgrund zu langer Intervalle von der Analyse ausgeschlossen. Dennoch, da die Zeit zwischen 2 SPC-Sitzungen als relevanter Faktor erscheint, wurde dieser Parameter in die Regressionsanalysen einbezogen, um im Modell die leichte Variation der SPC-Intervalle zu korrigieren. Da die vorliegende Studie jedoch im Parallelgruppen-Design durchgeführt wurde, erhielten die Patienten nicht beide Produkte, was wiederum jegliche Verzerrung aufgrund unzureichender Patientenblindung einschränken sollte. In diesem Zusammenhang war es interessant, dass die Gruppen keinen signifikanten Unterschied in der Meinung der Patienten über die Konsistenz und den Geschmack des Produkts aufwiesen; beide Produkte wurden von den Patienten gut akzeptiert, was wiederum auf eine gute Compliance hindeuten könnte.
Fazit
Die Re-Instrumentierung von Residualtaschen bei SPC-Patienten führt per se, zu einem signifikanten Anstieg der Taschenverschlüsse im Laufe der Zeit. Diese Verbesserung hing von der Mundhygiene des Patienten ab, d.h. das Vorhandensein von Plaque erhöhte die Wahrscheinlichkeit, weiterhin erkrankt zu bleiben, um etwa das 8-Fache. Die zusätzliche sub- und supragingivale wiederholte Anwendung eines HyA-haltigen Gels führte zu signifikant weniger Stellen, die nach 3 Monaten eine Re-Instrumentierung benötigten, und zu einigen klinisch relevanten Unterschieden nach 12 Monaten SPC im Vergleich zur Kontroll-/Placebogruppe, wie z.B. 71 gegenüber 52 % der experimentellen Stellen, die einen PPD < 5 mm erreichten. Allerdings wurde die statistische Signifikanz dieses Effekts in der angepassten Analyse zum Erreichen des Taschenverschlusses knapp verfehlt. Daher sind weitere klinische Studien erforderlich, um die Überlegenheit dieses Zusatzes im Vergleich zur alleinigen subgingivalen Re-Instrumentierung zu bestätigen.
Autoren: Kristina Bertl, Stefania Vlachou, Nikolaos Pandis, Antonios Zampelis, Andreas Stavropoulos
Referenzen:
- Sanz M, Herrera D, Kebschull M et al (2020) Behandlung von Parodontitis im Stadium I-III - Die EFP S3 klinische Praxisleitlinie. J Clin Periodontol 47(Suppl 22):4–60. https://doi.org/10.1111/jcpe.13290
- Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C (2020) Subgingivale Instrumentierung zur Behandlung von Parodontitis. Eine systematische Übersicht. J Clin Periodontol 47(Suppl 22):155–175. https://doi.org/10.1111/jcpe.13245
- Chapple ILC, Mealey BL, Van Dyke TE et al (2018) Parodontalgesundheit und gingivale Erkrankungen und Bedingungen bei intaktem und reduziertem Parodontium: Konsensbericht der Arbeitsgruppe 1 des 2017 World Workshop zur Klassifikation von parodontalen und peri-implantären Erkrankungen und Bedingungen. J Clin Periodontol 45(Suppl 20):S68–S77. https://doi.org/10.1111/jcpe.12940
- Bertl K, Pandis N, Stopfer N, Haririan H, Bruckmann C, Stavropoulos A (2022) Der Einfluss des Status eines „erfolgreich behandelten stabilen Parodontitis-Patienten“ auf patientenbezogene Ergebnisparameter während der langfristigen unterstützenden parodontalen Pflege. J Clin Periodontol 49:101–110. https://doi.org/10.1111/jcpe.13582
- Rattu V, Raindi D, Antonoglou G, Nibali L (2023) Prävalenz stabiler und erfolgreich behandelter Parodontitis-Patienten und Inzidenz des anschließenden Zahnverlusts während der unterstützenden parodontalen Pflege: Eine systematische Übersicht mit Metaanalysen. J Clin Periodontol. https://doi.org/10.1111/jcpe.13835
- Donos N, Calciolari E, Brusselaers N, Goldoni M, Bostanci N, Belibasakis GN (2020) Der ergänzende Einsatz von Wirtsmodulatoren in der nicht-chirurgischen parodontalen Therapie. Eine systematische Übersicht über randomisierte, placebo-kontrollierte klinische Studien. J Clin Periodontol 47(Suppl 22):199–238. https://doi.org/10.1111/jcpe.13232
- Herrera D, Matesanz P, Martín C, Oud V, Feres M, Teughels W (2020) Ergänzende Wirkung von lokal verabreichten Antimikrobiotika in der Parodontitistherapie: eine systematische Übersicht und Metaanalyse. J Clin Periodontol 47(Suppl 22):239–256. https://doi.org/10.1111/jcpe.13230
- Calciolari E, Ercal P, Dourou M, Akcali A, Tagliaferri S, Donos N (2022) Die Wirksamkeit ergänzender parodontaler Therapien während der unterstützenden parodontalen Pflege bei Patienten mit Residualtaschen. Eine systematische Übersicht und Metaanalyse. J Periodontal Res 57:671–689. https://doi.org/10.1111/jre.13001
- Wang CY, Yang YH, Li H et al (2020) Ergänzende lokale Behandlungen für Patienten mit Residualtaschen während der unterstützenden parodontalen Pflege: Eine systematische Übersicht und Netzwerk-Metaanalyse. J Clin Peri- odontol 47:1496–1510. https://doi.org/10.1111/jcpe.13379
- Bertl K, Bruckmann C, Isberg PE, Klinge B, Gotfredsen K, Stavropoulos A (2015) Hyaluronan in nicht-chirurgischer und chirurgischer parodontaler Therapie: eine systematische Übersicht. J Clin Periodontol 42:236–246. https://doi.org/10.1111/jcpe.12371
- Eliezer M, Imber JC, Sculean A, Pandis N, Teich S (2019) Hyaluronsäure als Ergänzung zur nicht-chirurgischen und chirurgischen parodontalen Therapie: eine systematische Übersicht und Metaanalyse. Clin Oral Investig 23:3423–3435. https://doi.org/10.1007/s00784-019-03012-w
- Karakostas P, Davidopoulou S, Kalfas S (2022) Verwendung von Hyaluronsäure in der Behandlung von Parodontalerkrankungen: eine systematische Übersicht. J Contemp Dent Pract 23:355–370
- Tan OL, Safii SH, Razali M (2021) Klinische Wirksamkeit wiederholter Anwendungen von lokaler Medikamentenabgabe und ergänzenden Mitteln in der nicht-chirurgischen parodontalen Therapie: eine systematische Übersicht. Antibiotika (Basel) 10:1178. https://doi.org/10.3390/antibiotics10101178
- Pilloni A, Rojas MA, Trezza C et al (2023) Klinische Effekte der ergänzenden Verwendung von Polynukleotid- und Hyaluronsäure-basiertem Gel bei der subgingivalen Reinstrumentierung von Residualparodontaltaschen: eine randomisierte, split-mouth klinische Studie. J Periodontol 94:354–363. https://doi.org/10.1002/JPER.22-0225
- Pilloni A, Zeza B, Kuis D et al (2021) Behandlung von Residualparodontaltaschen mit einem Hyaluronsäure-basierten Gel: eine 12-monatige multizentrische randomisierte doppelblinde klinische Studie. Antibiotika (Basel) 10:924. https://doi.org/10.3390/antibiotics10080924
- Schulz KF, Altman DG, Moher D, CONSORT G (2010) CONSORT 2010 Erklärung: aktualisierte Richtlinien zur Berichterstattung über parallel gruppierte randomisierte Studien. PLoS Med 7:e1000251. https://doi.org/ 10.1371/journal.pmed.1000251
- Papapanou PN, Sanz M, Buduneli N et al (2018) Parodontitis: Konsensbericht der Arbeitsgruppe 2 des 2017 World Workshop zur Klassifikation von parodontalen und peri-implantären Erkrankungen und Bedingungen. J Clin Periodontol 45(Suppl 20):S162–S170. https:// doi.org/10.1111/jcpe.12946
- Tonetti MS, Greenwell H, Kornman KS (2018) Stadieneinteilung und Gradierung der Parodontitis: Rahmen und Vorschlag einer neuen Klassifikation und Falldefinition. J Clin Periodontol 45(Suppl 20):S149– S161. https://doi.org/10.1111/jcpe.12945
- Armitage GC (2000) Entwicklung eines Klassifikationssystems für parodontalen Erkrankungen und Zustände. Northwest Dent 79:31–35
- Hamp SE, Nyman S, Lindhe J (1975) Parodontalbehandlung von mehrwurzeligen Zähnen. Ergebnisse nach 5 Jahren. J Clin Periodontol 2:126–135. https://doi.org/10.1111/j.1600-051x.1975.tb01734.x
- Asparuhova MB, Kiryak D, Eliezer M, Mihov D, Sculean A (2019) Aktivität von zwei Hyaluronan-Präparaten auf primäre menschliche orale Fibroblasten. J Periodontal Res 54:33–45. https://doi.org/10. 1111/jre.12602
- Fujioka-Kobayashi M, Müller HD, Mueller A et al (2017) In-vitro-Effekte von Hyaluronsäure auf menschliche parodontalen Ligamentzellen. BMC Oral Health 17:44. https://doi.org/10.1186/ s12903-017-0341-1
- Mueller A, Fujioka-Kobayashi M, Mueller HD et al (2017) Effekt von Hyaluronsäure auf morphologische Veränderungen der Dentinoberflächen und anschließenden Effekt auf das Überleben, die Anheftung und die Ausbreitung von parodontalen Ligamentzellen. Clin Oral Investig 21:1013–1019. https://doi.org/10.1007/s00784-016-1856-6
- Chen M, Li L, Wang Z, Li P, Feng F, Zheng X (2019) Hochmolekulare Hyaluronsäure reguliert die durch P. gingivalis induzierte Entzündung und Migration in menschlichen gingivalen Fibroblasten über den MAPK- und NF-κB-Signalweg. Arch Oral Biol 98:75–80. https:// doi.org/10.1016/j.archoralbio.2018.10.027
- Dannewitz B, Zeidler A, Hüsing J et al (2016) Verlust von Molaren bei parodontal behandelten Patienten: Ergebnisse 10 Jahre und mehr nach aktiver parodontaler Therapie. J Clin Periodontol 43:53–62. https:// doi.org/10.1111/jcpe.12488
- Graetz C, Schützhold S, Plaumann A et al (2015) Prognostische Faktoren für den Verlust von Molaren – eine 18-jährige retrospektive Kohortenstudie. J Clin Periodontol 42:943–950. https://doi.org/10.1111/jcpe.12460
- Graetz C, Plaumann A, Schlattmann P et al (2017) Langfristige Zahnerhaltung bei chronischer Parodontitis - Ergebnisse nach 18 Jahren eines konservativen parodontalen Behandlungsregimes in einer universitären Umgebung. J Clin Periodontol 44:169–177. https://doi.org/10.1111/jcpe.12680
- Matuliene G, Pjetursson BE, Salvi GE et al (2008) Einfluss von Residualtaschen auf das Fortschreiten der Parodontitis und Zahnverlust: Ergebnisse nach 11 Jahren der Erhaltungstherapie. J Clin Periodontol 35:685– 695. https://doi.org/10.1111/j.1600-051X.2008.01245.x
- Salvi GE, Mischler DC, Schmidlin K et al (2014) Risikofaktoren, die mit der Langlebigkeit von mehrwurzeligen Zähnen verbunden sind. Langfristige Ergebnisse nach aktiver und unterstützender parodontaler Therapie. J Clin Periodontol 41:701–707. https://doi.org/10.1111/jcpe.12266
- Ariel H, Kahn A, Hila ZO, Anton S, Natan G, Kolerman R (2022) Ein thermosensitives Gel mit einem aktiven Hyaluronsäure-Inhaltsstoff, das ein Octenidin-Konservierungssystem enthält, als Ergänzung zu Scaling und Root Planning: eine randomisierte prospektive klinische Studie. Clin Oral Investig 26:3721–3733. https://doi.org/10.1007/s00784-021-04344-2
- Mohammad CA, Mirza BA, Mahmood ZS, Zardawi FM (2023) Der Effekt von Hyaluronsäure-Gel auf parodontalen Parameter, pro-inflammatorische Zytokine und biochemische Marker bei Parodontitis-Patienten. Gels 9:325. https://doi.org/10.3390/gels9040325
- Olszewska-Czyz I, Kralik K, Prpic J (2021) Biomoleküle in zahnmedizinischen Anwendungen: randomisierte, kontrollierte klinische Studie zur Bewertung des Einflusses der Hyaluronsäure-Ergänzungstherapie auf klinische Parameter der moderaten Parodontitis. Biomoleküle 11:1491. https://doi.org/10.3390/biom11101491
- Ramanauskaite E, Machiulskiene V, Shirakata Y, Dvyliene UM, Nedzelskiene I, Sculean A (2023) Klinische Bewertung von Natriumhypochlorit/Aminosäuren und vernetzter Hyaluronsäure als Ergänzung zur nicht-chirurgischen parodontalen Behandlung: eine randomisierte kontrollierte klinische Studie. Clin Oral Investig. https://doi.org/10.1007/ s00784-023-05271-0
- Jentsch HFR, Roccuzzo M, Pilloni A, Kasaj A, Fimmers R, Jepsen S (2021) Flapless Anwendung von Zahnschmelzmatrixderivat in der parodontalen Nachbehandlung: eine multizentrische randomisierte Machbarkeitsstudie. J Clin Periodontol 48:659–667. https://doi.org/10.1111/jcpe.13438
- Radulescu V, Boariu MI, Rusu D et al (2022) Klinische und mikrobiologische Effekte einer einmaligen Anwendung von Natriumhypochlorit-Gel während der subgingivalen Reinstrumentierung: eine dreifach-blinde randomisierte placebo-kontrollierte klinische Studie. Clin Oral Investig 26:6639–6652. https://doi.org/10.1007/s00784-022-04618-3
- Diehl D, Friedmann A, Liedloff P, Jung RM, Sculean A, Bilhan H (2022) Ergänzende Anwendung von Hyaluronsäure in Kombination mit einem Natriumhypochlorit-Gel zur nicht-chirurgischen Behandlung von Residualtaschen reduziert den Bedarf an parodontaler Chirurgie - retrospektive Analyse einer klinischen Fallserie. Materialien (Basel) 15:6508. https://doi.org/10.3390/ma15196508
- Costa FO, Costa AM, Cortelli JR et al (2023) Einfluss der supragingivalen Plaque-Kontrolle auf rezidivierende Parodontitis und klinische Stabilität bei Personen unter parodontaler Erhaltungstherapie: 10-Jahres-Nachverfolgung. J Periodontol 94:55–65. https://doi.org/10. 1002/JPER.22-0301
- Tomasi C, Koutouzis T, Wennström JL (2008) Lokal verabreichtes Doxycyclin als Ergänzung zur mechanischen Debridement bei der Nachbehandlung von parodontalen Taschen. J Periodontol 79:431–439. https:// doi.org/10.1902/jop.2008.070383
- Ramseier CA, Nydegger M, Walter C et al (2019) Zeit zwischen Recall-Besuchen und Residual-Probing-Tiefen sagen die langfristige Stabilität bei Patienten, die an unterstützender parodontaler Therapie teilnehmen, voraus. J Clin Periodontol 46:218–230. https://doi.org/10.1111/jcpe.13041
