Wirksamkeit von Silizium-plättchenreichem Fibrin und autologem Knochen bei der Knochenregeneration in Kaninchenkalvariendefekten: eine radiologische und histologische Studie.
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung: Die Reparatur von Knochendefekten in der Oralchirurgie erfordert oft den Einsatz von Knochenregenerationstechniken. Silizium ist ein Element, das in mehreren Studien als Regenerationsmaterial verwendet wurde. In unserer Studie wurde Silizium mit autologem Knochen und plättchenreichem Fibrin (PRF) kombiniert, um das Verhalten dieses Elements bei der Knochenregeneration zu analysieren. Es wurden vier zirkumferentielle Defekte im Schädeldach von 5 Neuseelandkaninchen erzeugt. Die folgenden Elemente wurden zur Regeneration der Defekte angewendet: (P): PRF; (S): Silizium und (B): autologer Knochen, mit folgender Verteilung der Studiengruppen: Gruppe 1 (PSB); Gruppe 2 (PS); Gruppe 3 (SB) und Gruppe 4 (KONTROLLE): unregenerierte Gruppe. Die Tiere wurden nach 3 Wochen getötet. Computertomographische Studien (μ-CT) sowie histomorphometrische Untersuchungen wurden durchgeführt. Der ANOVA-Statistiktest wurde mit einem Bonferroni-Nachtest verwendet, um die Ergebnisse zu vergleichen (p≤ 0,05). Radiologisch waren die Gruppen PSB und SB hinsichtlich der Menge und des Prozentsatzes des beobachteten gesunden Knochens besser, jedoch nicht signifikant im Vergleich zur Kontrollgruppe. Die PS-Gruppe war signifikant schlechter. Der histologische Test ergab, dass die PSB-Gruppe die größte Fläche, den höchsten Prozentsatz und den Umfang des mineralisierten Knochens aufwies. Bei der Bewertung des sich bildenden Knochens (Osteoid) wurden keine Unterschiede zwischen den Gruppen festgestellt, mit Ausnahme des Knochenumfangs, wo die SB-Gruppe signifikant besser war. Die Variable der Knochenhöhe zeigte keine signifikanten Unterschiede. Zusammenfassend können wir feststellen, dass die Kombination von PRF, autologem Knochen und Silizium gute Ergebnisse nach 3 Wochen liefert, während die PS-Gruppe die schlechtesten Ergebnisse zeigt. Dies unterstreicht die Bedeutung des autologen Knochens als Teil des Transplantatmaterials, damit der Knochen mineralisieren kann.
Einführung
Knochenfehler in der Oralchirurgie sind häufig und manchmal schwer zu reparieren, was Techniken zur Knochenregeneration erfordert, um den Erfolg der restaurativen Behandlung sicherzustellen. Wissenschaftliche Forschungen machen weiterhin Fortschritte im Verständnis der biologischen und physiologischen Prozesse, die an der Knochenheilung, Regeneration und Umgestaltung beteiligt sind. In vivo Gewebeengineering umfasst die Regeneration und Rekonstruktion von Geweben und Organen im Körper selbst. Die grundlegende Prämisse ist, dass die kontrollierte Manipulation des extrazellulären Mikroumfelds dazu führen kann, die Fähigkeit der Zellen zu steuern, sich zu organisieren, zu wachsen, sich zu differenzieren und eine funktionierende extrazelluläre Matrix und schließlich neues funktionelles Gewebe zu bilden.
Regenerative Techniken sind zu Routineverfahren geworden und haben sich mit nachgewiesenen klinischen Ergebnissen etabliert, aber ihre Vorhersagbarkeit und Wartezeit sind weiterhin einige der Faktoren, die die Untersuchung der Entwicklung neuer und verbesserter Materialien zur Knochenregeneration vorantreiben. Autologes Knochenmaterial und plättchenreiches Plasma sind zwei weit verbreitete Materialien im Bereich der Implantologie zur Regeneration von Weich- und Hartgewebe. Ein Material, das alle Vorteile jedes einzelnen von ihnen kombiniert, wurde jedoch bisher noch nicht entwickelt.
Die Verwendung von autologem Knochen wird in der Literatur weitgehend beschrieben, da er als der Goldstandard für die Knochenregeneration gilt. Dennoch, trotz der Tatsache, dass er ausgezeichnete biologische Eigenschaften der Osteoinduktion, Osteokonduktion und Osteogenese aufweist, weist das Autograft eine erhebliche Morbidität und eine erhöhte sowie unvorhersehbare Resorptionsrate auf, hat jedoch gezeigt, dass sich sein Verhalten in Kombination mit anderen Knochenersatzmaterialien verbessert, wodurch über die Zeit ein reichhaltigeres und konsistenteres Volumen sowie eine schnellere Knochenheilung erzielt werden.
Zusammen mit autologem Knochen werden auch plättchenreiche Blutderivate häufig in der Geweberegeneration verwendet. Zu diesen Derivaten gehört plättchenreiches Fibrin [PRF]. Es ist ein regeneratives Biomaterial, das in verschiedenen medizinischen Anwendungen weit verbreitet ist. Darüber hinaus hat es im Vergleich zu plättchenreichem Plasma [PRP] an Popularität gewonnen, da es eine Ein-Schritt-Technik ist, bei der keine chemischen Substanzen hinzugefügt werden müssen. Ein weiterer Vorteil ist die größere allmähliche Freisetzung von Wachstumsfaktoren über die Zeit. Eine einzelne Fibrinmembran enthält eine große Menge an Wachstumsfaktoren und Zytokinen, die an der Knochenregeneration und der Reifung von Weichgewebe beteiligt sind. Es ist ein leicht zu manipulierendes Biomaterial, das in der Oralchirurgie in der Parodontaltherapie, der Erhaltung des Alveolarknochens, chirurgischen Knochenaugmentationen und in Kombination mit Knochenimplantaten bei der Kieferhöhlenhebung angewendet wird. Seine neueste Anwendung, die noch nicht klinisch getestet wurde, ist als Dekontaminationsmittel für raue Titanoberflächen aufgrund seiner antimikrobiellen Eigenschaften.
Schließlich gibt es mehrere Publikationen, die besagen, dass bioanorganische Ionen wie Zink, Mangan, Magnesium oder Silizium für den Knochenstoffwechsel unerlässlich sind. Silizium ist das zweithäufigste Element in der Erdkruste und im menschlichen Körper findet man es hauptsächlich in Bereichen der Knochenmineralisation und des Wachstums. Es spielt eine entscheidende Rolle in der Biologie von Knochen und Bindegewebe, und obwohl sein Wirkmechanismus nicht genau verstanden ist, ist dank der Forschung von Carlisle und Schwarz bekannt, dass es wirkt, indem es eine größere Mineralisation der Knochenmatrix durch die Synthese und Stabilisierung der Vernetzung von Kollagenfasern erzeugt. Silizium ist ein initiierender Faktor in der Knochenmineralisation, da es in erhöhten Konzentrationen in der Osteoidmatrix von unreifem Knochen vorhanden ist und, während der Knochen reift, die Siliziumkonzentration durch die Konzentration von Kalzium verringert wird. Es wurde im Laufe der Jahre als knochenregeneratives Material in Form von Beschichtungen für Zahnimplantate verwendet und auch in keramische Biomaterialien [Hydroxylapatit, Trikalziumphosphat oder Glaskeramiken] integriert, was gute Ergebnisse hinsichtlich der Knochenregeneration in in vitro und in vivo Studien liefert. Dieses gute Verhalten ist auf die starke Bindung zurückzuführen. Silizium wurde zusammen mit anderen Biomaterialien wie Glaskeramiken oder Apatit oder mit Trikalziumphosphat [TCP] eingesetzt, um die biologischen Eigenschaften der Materialien, mit denen es sich verbindet, zu verbessern. Soweit wir wissen, gibt es jedoch keine Studien mit Knochen aufgrund der Bildung einer biologisch aktiven Schicht, die der von Apatit ähnelt, auf seiner Oberfläche.
Silizium wurde zusammen mit anderen Biomaterialien wie Glaskeramiken oder Apatit oder mit Trikalziumphosphat [TCP] eingesetzt, um die biologischen Eigenschaften der Materialien, mit denen es sich verbindet, zu verbessern. Soweit wir wissen, wurden jedoch keine Studien zur Verwendung von Silizium in Kombination mit autologem Knochen oder mit plättchenreichem Fibrinmembranen zur Verwendung in der Knochenregeneration gefunden.
In unserer Studie wurde Silizium mit autologem Knochen und PRF-Membranen kombiniert, um die Rolle dieses Elements in der Knochenregeneration in Kombination mit anderen weit verbreiteten Biomaterialien zu analysieren. Das Hauptziel war die Bewertung der Knochenregeneration, die in den verschiedenen analysierten Gruppen erzielt wurde (diese sind (P): PRF; (S): Silizium und (B): autologer Knochen, mit einer Verteilung der Studiengruppen wie folgt: Gruppe 1 (PSB); Gruppe 2 (PS); Gruppe 3 (SB) und Gruppe 4 (KONTROLLE): unregenerierte Gruppe) über einen Zeitraum von 3 Wochen in einem Tiermodell.
Materialien und Methoden
Testtierproben
Die experimentelle Studie wurde am Scheitelbein von 5 Labor-Neuseelandkaninchen im Alter von 6 Monaten und mit einem Gewicht von 3,5-4 kg durchgeführt. Die Tiere wurden täglich (ad libitum) mit einer Labor-Tierdiät von Harlan-Teklad (2030) gefüttert. Die Tiere wurden unter Allgemeinanästhesie im Jesús Usón Minimally Invasive Surgical Centre, [Cáceres, Extremadura, Spanien] operiert. Das Experiment wurde gemäß den Richtlinien des spanischen Nationalen Gesundheitsinstituts (NIH) und der europäischen Richtlinie 86/609/EEC über die Pflege und den Gebrauch von Versuchstieren durchgeführt. Die Studie entsprach auch der europäischen Richtlinie 2010/63/EU zum Schutz von Tieren, die für experimentelle Zwecke verwendet werden, sowie allen lokalen Gesetzen und Vorschriften. Die Forscher erhielten die Genehmigung des Ethikkomitees der Institution (CCMI-Ref 028/16). Die Identifizierung der Tiere, die die zu bewertenden Gruppen bildeten, erfolgte mittels eines Chips. Während des experimentellen Zeitraums wurden die Proben in einzelnen Käfigen gehalten.
Chirurgischer Eingriff
Vor Beginn des chirurgischen Eingriffs wurde die Immobilisation der Kaninchen durchgeführt und ihre Vitalzeichen wurden aufgezeichnet. Die verwendeten Anästhetika waren intravenöses Midazolam (0,25 mg / kg) und Propofol (5 mg / kg) sowie inhalatives 2,8% Sevofluran-Gas. Zwei Analgetika wurden eingesetzt: Tramadol (3 mg / kg) und Ketorolac (1,5 mg / kg). Nach der Sedierung wurde aus jedem Kaninchen eine retro-orbitale Blutprobe mit einer Butterfly-Nadel entnommen. Die Proben wurden in Testtuben ohne Antikoagulans gegeben und 12 Minuten lang bei einer Geschwindigkeit von 2700 U/min bei Raumtemperatur zentrifugiert, um PRF-Membranen zu erhalten. Sobald die Membranen erhalten waren, wurden sie in kleine Stücke von etwa 2 mm Durchmesser geschnitten, die in drei Teile geteilt wurden, die anschließend für die drei Versuchsgruppen verwendet wurden. Es wurde 0,01 mg pro cc Silikonversenat verwendet. (Natural Energy Laboratory of Venezuela, Caracas, Venezuela).
Vier nicht selbstheilende Knochendefekte wurden erzielt (Durchmesser: 9 mm; Tiefe: ca. 3 mm, bis zur Dura mater) am Scheitelbein, auf jeder Seite der Mittellinie des Schädels, unter Verwendung einer Trepanation (Helmut-Zepf Medical GmbH, Seitingen, Deutschland), die auf einem chirurgischen Mikromotor bei 2000 U/min unter Spülung mit Kochsalzlösung montiert war. Piezoelektrische Instrumente wurden verwendet, um die innere Tafel und das Markknochen jedes Defekts zu entfernen. Die Tiefe wurde mit einer Parodontalsonde kontrolliert. Nachdem die Defekte angelegt worden waren, wurde das gewonnene Knochenmaterial zerkleinert und das erhaltene Material wurde in zwei gleiche Teile geteilt. Die Konfiguration der Gruppen war wie folgt: Gruppe 1 (PSB): Mischung aus plättchenreichem Fibrinmembran (P) + Silikon (S) + autologem Knochen (B); Gruppe 2 (PS): plättchenreiche Fibrinmembran (P) + Silikon (S); Gruppe 3 (SB): Silikon (S) + autologer Knochen (B) und schließlich Gruppe 4 (KONTROLLE), in der kein regeneratives Material platziert wurde. Die Verteilung der Gruppen im Scheitelbein ist in Tabelle 1 zu sehen.
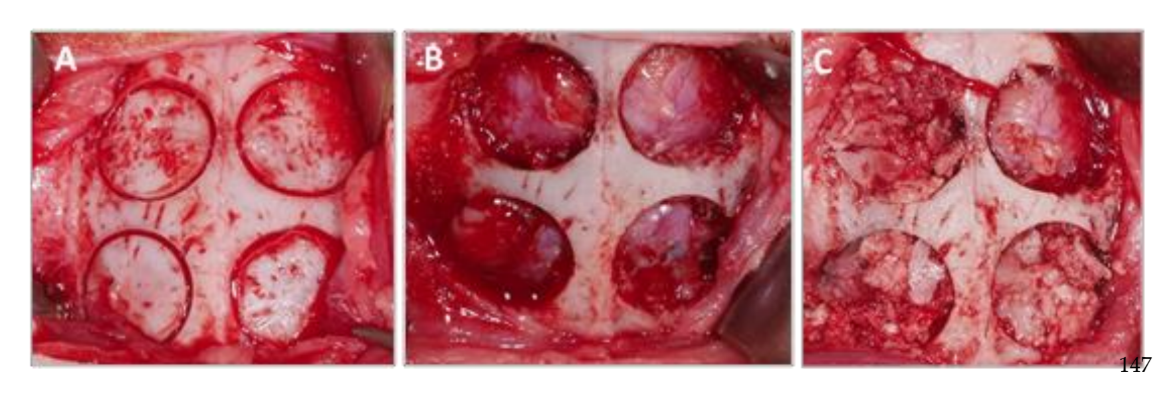
Nach dem Nähen wurden entzündungshemmende und schmerzlindernde Mittel verabreicht (Carprofen 1 ml / 12,5 kg und Buprenorphin 0,05 mg / kg). Schließlich wurden die Tiere nach 3 Wochen mit einer intravenösen Überdosis von Kaliumchlorid getötet. Der chirurgische Eingriff ist in Abbildung 1 zu sehen.
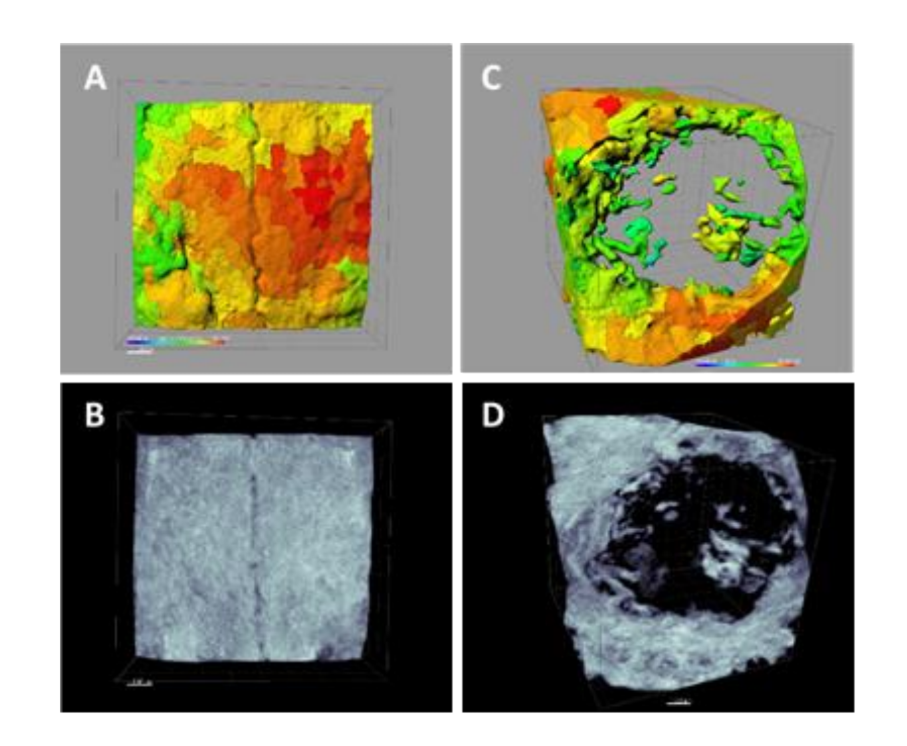
Die Proben, die aus dem Schädeldach jedes Exemplars entnommen wurden, wurden im anatomischen sagittalen Schnitt geschnitten, und nach der Trennung von der Gehirnmasse und dem Waschen in physiologischer Kochsalzlösung wurden die Stücke einzeln geschnitten und markiert. Jede der Proben wurde in einer 10%igen Formalinlösung für tomografische und histomorphometrische Analysen eingetaucht.
Micro-Computertomographie (Micro-CT)
Die Proben wurden mit Computertomographie (CT) unter Verwendung eines CT Bruker Albira Scanners (Bruker Co., Billerica, MA, USA) analysiert. Die Aufnahmen wurden mit den folgenden Parametern durchgeführt: 1000 Bilder, in 360° radiografischer Projektion, bei 45 kV und 30 Minuten Aufnahmezeit. Die tomografische Rekonstruktion wurde mit der Albira Suite Software (Bruker Co., Billerica, MA, USA) und standardmäßigen Rekonstruktionsparametern durchgeführt, um 2D- und 3D-Volumina mit einer Auflösung von 8,3 Voxeln/mm zu erzeugen. Die durchschnittliche Knochendichte, gemessen in Hounsfield-Einheiten (HU), wurde mit der PMOD-Software (Bruker Co., Billerica, MA, USA) bewertet, indem sphärische Volumina von Interesse [VOI] mit 2 mm in einer Rosettenformation innerhalb jeder Läsion positioniert wurden. Hochauflösende Rekonstruktionen eines 10 mm3 Volumens wurden in jeder Läsion unter Verwendung der Albira Suite Software durchgeführt, was zu Volumina mit einer Auflösung von 20 Voxeln/mm führte. Für jedes der Volumina wurden die folgenden Variablen bewertet: (1) Die Gesamtsumme der Hounsfield-Werte aller Voxel (GESAMTSUMME), (2) der Durchschnitt aller Hounsfield-Werte der Voxel (Durchschnitt) in Hounsfield-Einheiten und (3) der Prozentsatz des gesunden Knochens (%).
Diese gleichen Variablen wurden für Luft ̶ als Maß zur Feststellung des Hintergrundgeräuschs der Bilder ̶ und für das umgebende Knochengewebe bewertet, bei dem der Prozentsatz des erwarteten gesunden Knochens 100% beträgt.
Histologische Verarbeitung der Probe
Proben wurden aus dem Schädel jeder Probe entnommen, indem entlang der anatomischen sagittalen Ebene geschnitten wurde. Die getrockneten Proben wurden sofort in eine Lösung aus 4% Formaldehyd und 1% Calcium, eingebettet in Acrylharz, eingetaucht und sie wurden nach der Methode von Donath und Breuner zur Herstellung histologischer Schnitte mit einer Dicke von 5 µm verarbeitet. Die Proben wurden mit Von Kossa (VK) 5% Silbernitrat (Sigma-Aldrich Chemical Co., Poole, Vereinigtes Königreich) gefärbt, um den mineralisierten Knochen nach 3 Wochen zu betrachten, und sie wurden mit einem Olympus BXB61-Optikmikroskop (Olympus, Tokio, Japan) mit 1,5- und 20-fach Vergrößerung beobachtet. Die Bilder wurden mit einem DSP DS-Fi1 digitalen Signalprozessor (Nikon, Tokio, Japan) in Verbindung mit der NIS-Elements 4.0 BR-Software (Nikon, Tokio, Japan) aufgenommen. Von jedem Knochendefekt wurde ein Bild aufgenommen. Eine Woche vor der Opferung der Proben (nach 2 Wochen) wurde den Kaninchen ein fluoreszierender Marker verabreicht, um die Calceinablagerung auf der kürzlich abgelagerten Knochenmatrix zu beobachten. Die fluoreszierenden Bilder wurden mit einer DSP DS-Fi1-Kamera [Nikon, Tokio, Japan] in Verbindung mit der NIS-Elements 4.0 BR-Software [Nikon, Tokio, Japan] aufgenommen.
Für beide Arten von Färbungen (VK und Immunfluoreszenz) wurden vier Variablen analysiert: Knochenhöhe (nur bei VK) (mm) (BH), Knochenfläche (µm2) (BA), Prozentsatz der Knochenfläche (%) (BA) und Knochenumfang (µm) (BP).
Statistische Analyse
Für die statistische Analyse der erhaltenen Ergebnisse wurde der ANOVA t-Test angewendet, gefolgt von einem Bonferroni-Test, um die in beiden Studiengruppen erhaltenen Ergebnisse zu vergleichen, unter Verwendung der Software STATVIEW F-4.5. Die Ergebnisse wurden als Median ± Standardabweichung für alle analysierten Variablen ausgedrückt. Das Signifikanzniveau wurde auf p ≤ 0,05 festgelegt.
Ergebnisse
Ergebnisse für radiologische Variablen
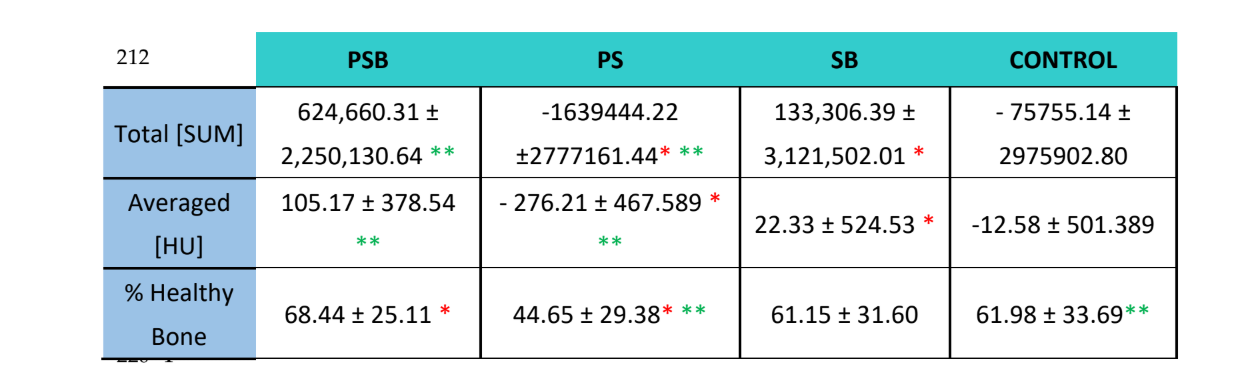
Mit der Albira Suite-Software wurden hochauflösende 2D- und 3D-Rekonstruktionen erstellt (Abbildung 2) und die Variablen zur Knochenquantifizierung gemessen, bei denen nach 3 Wochen keine statistisch signifikanten Unterschiede zwischen den Gruppen PSB, SB und CONTROL in den Variablen Total SUM, Durchschnitt und % Gesundes Knochen festgestellt wurden. Die PS-Gruppe erzielte die am wenigsten signifikanten Werte für diese drei Variablen (Tabellen 2 und 3).
Drei Wochen später wurden histologische Bewertungen der vier Gruppen vorgenommen (Tabelle 4). Die Variable der Knochenhöhe zeigte nach 3 Wochen Heilung keine statistisch signifikanten Unterschiede zwischen den Gruppen.
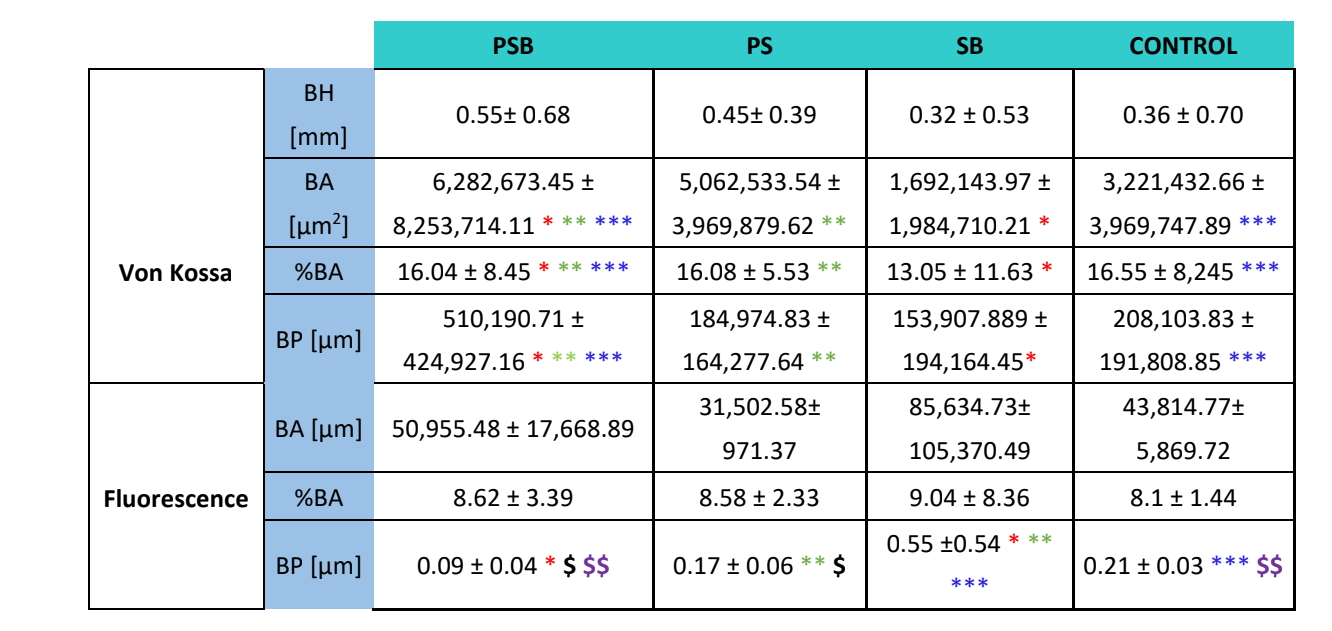
Es wurden zwei histologische Färbungen, Von Kossa und Fluoreszenz, durchgeführt (Abbildung 4). Die erste wurde verwendet, um mineralisierten Knochen zu beobachten. Die Knochenfläche [BA], der Flächenanteil [%BA] und der Knochenumfang [BP] wurden beobachtet. Die Von Kossa-Färbung zeigte, dass die PSB-Gruppe statistisch höhere BA und BP als die anderen Gruppen aufwies. Der %BA war in der CONTROL-Gruppe höher, jedoch nicht signifikant im Vergleich zu allen Gruppen, da die Stichprobengröße sehr klein war.
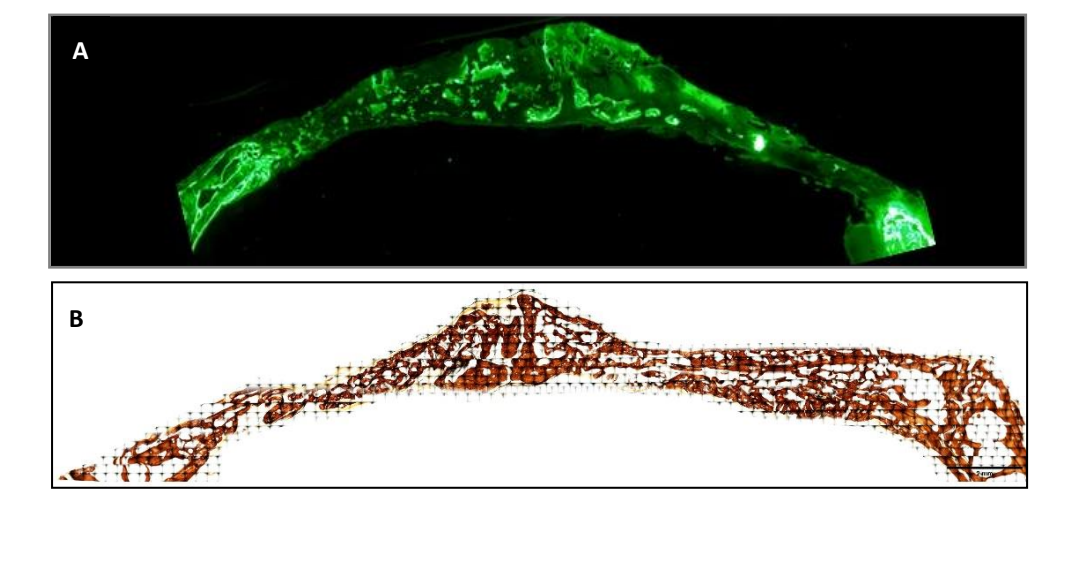
Die Fluoreszenzfärbung wurde verwendet, um die oben genannten Variablen im neu abgelagerten Knochen zu messen. Es wurden nach 3 Wochen keine statistisch signifikanten Unterschiede zwischen den Gruppen für die BA- und %BA-Variablen beobachtet. In der SB-Gruppe war der Knochenumfang signifikant höher, während die PSB-Gruppe den signifikant niedrigeren Wert aufwies.
Diskussion
In dieser radiologischen und histologischen Studie haben wir den Knochen beobachtet, der nach der Platzierung verschiedener knochenregenerativer Materialien gebildet wurde, zu denen Silikon hinzugefügt wurde, um seine Rolle als Stimulator der Knochenbildung zu bewerten.
In der radiologischen Studie (Tabelle 2) wurde beobachtet, dass die Gruppen PSB und SB höhere Werte hinsichtlich der Menge und des Prozentsatzes des beobachteten gesunden Knochens aufwiesen. Diese Unterschiede waren jedoch im Vergleich zur Kontrollgruppe nicht statistisch signifikant. Andererseits wies die PS-Gruppe signifikant niedrigere Werte im Vergleich zu den anderen Gruppen auf.
Die histologische Studie (Tabelle 4) zeigte, dass die PSB-Gruppe die größte Fläche, den größten Prozentsatz und den größten Umfang von mineralisiertem Knochen im Vergleich zu den anderen Gruppen aufwies. Im Gegensatz dazu wurde bei der Bewertung der Calceinablagerung in der Knochenmatrix kein Unterschied zwischen den Gruppen hinsichtlich der Knochenfläche und des Flächenprozentsatzes beobachtet. Die SB-Gruppe wies einen signifikant größeren Knochenumfang auf. Die Variable Knochenhöhe zeigte keine Unterschiede zwischen den Gruppen.
Silizium ist ein bioanorganisches Ion, das in mehreren Studien als regeneratives Material eingesetzt wurde, normalerweise zusammen mit anderen anorganischen Biomaterialien wie Calciumphosphat oder Hydroxylapatit. Die Vorteile, die sie bieten, sind niedrige Kosten und eine längere Lebensdauer. Die Bioaktivität von Silizium hängt von der Ansammlung von Siliziumionen ab, wenn es Körperflüssigkeiten wie Blut ausgesetzt ist, wie im Fall dieser Studie. Dieses Phänomen sollte zur Bildung einer Schicht führen, die biologisch aktivem Apatit ähnlich ist.
Soweit wir wissen, gibt es in der Literatur keine Hinweise auf die Verwendung von Siliziumversenat als regeneratives Material, daher muss der Vergleich mit anderen Studien mit Vorsicht vorgenommen werden.
Die üblicherweise angewandte Methode besteht darin, Hydroxylapatit oder Calciumphosphat durch Silizium mittels Fällungsmethoden zu ersetzen, wodurch regenerative Biomaterialien mit besseren Eigenschaften gewonnen werden können. Mehrere in vitro-Studien haben gezeigt, dass Silizium ein biokompatibles und bioinertes Element ist. Darüber hinaus fördert es die Angiogenese, die osteoblastische Differenzierung und erhöht die Knochendichte, indem es dessen Bildung beschleunigt. In einer aktuellen Studie wurden Defekte an den Schädeldecken von Ratten regeneriert und nach 4 Wochen wurde beobachtet, dass eine signifikant größere Knochenbildung im Vergleich zu einer ähnlichen Mischung, der kein Silizium hinzugefügt wurde, stattfand.
Ebenso wurden gemischte in vitro- und in vivo-Studien durchgeführt, in denen das Verhalten von Silizium in beiden Situationen verglichen werden konnte. Mao et al führten eine Studie durch, in der Silizium einer Mischung aus Calciumphosphat und Glas-Keramik hinzugefügt wurde, um Defekte an den Schädeldecken von Kaninchen zu regenerieren. Die Zellviabilität war ähnlich der, die im spongiösen Rinderknochen beobachtet wurde, jedoch mit einer höheren Rate an Zellproliferation. All dies wurde der Einbeziehung von Siliziumionen zugeschrieben, die auch andere Zellfunktionen wie die Zelladhäsion fördern sollten. In der durchgeführten histologischen Studie wurde eine erhöhte Neubildung von Knochen in der experimentellen Gruppe beobachtet.
Gemäß der überprüften Literatur wäre zu erwarten, dass in den Gruppen mit Silizium eine größere Menge mineralisierten Knochens gefunden wird. In unserer Studie zeigten die PS- und SB-Gruppen keinen Unterschied im Vergleich zur Kontrollgruppe, wobei die Kombination aus Silizium, plättchenreichem Fibrin und autologem Knochen [der PSB-Gruppe] diejenige war, die ein signifikant höheres Niveau an mineralisiertem Knochen als die anderen ermöglichte.
Autologer Knochen wird nach wie vor als das Goldstandardmaterial für die Regeneration angesehen, da er das einzige Material mit osteogenen, osteoinduktiven und osteokonduktiven Eigenschaften ist, was ihm einen Vorteil im Vergleich zu den anderen verfügbaren Materialien verschafft. Nichtsdestotrotz haben seine begrenzte Verfügbarkeit, Morbidität und die höhere Resorptionsrate die Suche nach neuen Biomaterialien angestoßen.
In unserer Studie zeigte autologer Knochen in Kombination mit Silizium [SB] keinen signifikanten Unterschied im Vergleich zu den PS- und Kontrollgruppen hinsichtlich des verkalkten Knochens. Er war jedoch, nach der PSB-Gruppe, diejenige, die eine größere Menge an Knochen präsentierte und die einen größeren Knochenumfang von osteoidem Knochen aufwies. Es gibt keine Publikationen, in denen eine der Studiengruppen autologen Knochen mit Silizium verwendet hat; und unsere vorläufigen Ergebnisse deuten darauf hin, dass wir beobachten müssten, wie sich der autologe Knochen über längere Zeiträume verhält.
Fibrinreiches Plasma wurde zuvor in der Knochenregeneration als einziges Füllmaterial oder in Kombination mit autologem Knochen, Xenotransplantaten oder alloplastischen Transplantaten verwendet, was bessere Ergebnisse hinsichtlich der Knochenregeneration und schnellere Heilung im Vergleich zu negativen Kontrollgruppen lieferte. Es gibt jedoch nur begrenzte Beweise für die Kombination von Silizium und plättchenreichen Konzentraten. In der Literatur wurden nur zwei Studien gefunden, die beide Materialien kombinieren. Ihre Ergebnisse unterscheiden sich und auch von unseren. In der ersten Studie wurde eine Kombination von PRP/Silizium anschließend mit Calciumchlorid geliert. Es wurde auf einer Zellkultur von Osteoblasten angewendet, und eine größere Proliferation, höhere Zellviabilität und größere Zellablagerung von Calcium wurde in der Versuchsgruppe im Vergleich zur Gruppe ohne Silizium beobachtet. Im Gegensatz dazu wurde in der zweiten Studie ein zellgenerierender Faktor (CGF) mit Natriumorthosilikat auf menschlichen Osteoblasten kombiniert. Es wurden keine statistisch signifikanten Unterschiede in Bezug auf die Zellproliferation oder das Wachstum im Vergleich zu den Gruppen beobachtet, in denen nur Orthosilikat oder nur plättchenreiches Konzentrat verabreicht wurde. Im Gegensatz dazu wurde eine größere Produktion von Typ-I-Kollagen beobachtet. In beiden Studien wurde festgestellt, dass die osteokonduktiven Eigenschaften des Siliziums durch die Wachstumsfaktoren im CGF verstärkt würden. Beide Ergebnisse unterschieden sich in unserer Studie, in der die PS-Gruppe die signifikant niedrigeren radiologischen Werte erzielte, obwohl histologisch kein Unterschied zur Kontrollgruppe festgestellt wurde. Der Vergleich mit beiden Publikationen muss mit Vorsicht erfolgen, da es sich um in vitro-Studien mit einem anderen Material handelte. Nichtsdestotrotz würden unsere Ergebnisse mit zwei Versuchen an Kaninchenknochen übereinstimmen, in denen beobachtet wurde, dass das PRF die Knochenregeneration im Vergleich zur negativen Kontrollgruppe nicht signifikant verbesserte.
In unserer Studie trat eine stärkere Bildung von mineralisiertem Knochen in der PSB-Gruppe auf, was auf zwei Faktoren zurückzuführen sein könnte: Der erste ist, dass das Silizium und das PRF ihre osteokonduktive Kapazität durch die Kombination miteinander steigern und gleichzeitig die Knochenmineralisation beschleunigen würden. Dies könnte die bessere Leistung der PSB-Gruppe in unserer Studie erklären. Der zweite Faktor ist die Zugabe von autologem Knochen zu dem Biomaterial, das, wie bereits erwähnt, als Referenzmaterial in der Knochenregeneration angesehen wird.
Als Einschränkungen der Studie ist es erwähnenswert, dass die Anzahl der Proben in der Stichprobe gering war, sowie der bewertete Zeitraum. Die PSB- und SB-Studiengruppen zeigten gute Regenerationsresultate, jedoch wiesen sie radiologisch keinen signifikanten Unterschied im Vergleich zur Kontrollgruppe auf. Eine Möglichkeit zur Verbesserung der Studie wäre, längere Zeiträume zu bewerten, die möglicherweise aufschlussreichere Ergebnisse über das Verhalten dieser regenerativen Materialien bieten würden. Darüber hinaus hätte die Verwendung einer positiven Kontrollgruppe (das Füllen des Defekts mit autologem Knochen ohne Silizium oder eine Mischung aus nur autologem und heterologem Knochen) in Betracht gezogen werden können. Eine weitere Einschränkung der Studie ist die Schwierigkeit des Vergleichs aufgrund der Art des verwendeten Materials (Siliziumversenat). Silizium ist ein Element, das in sehr unterschiedlichen Formen in der Literatur verwendet wird, wie Siliziumdioxid, Siliziumacetat und Natriumsilikat, und es gibt noch kein validiertes Protokoll. Granuliertes Silizium wurde in unserer Studie verwendet. Unter physiologischen Bedingungen ist bioverfügbares Silizium in Form von Orthosilikat-Säure zu finden, während in den Studien, in denen mit Silizium substituiertes Hydroxylapatit verwendet wurde, das verwendete Silizium in Form von SiO4 vorliegt, obwohl andererseits kürzlich gezeigt wurde, dass Silizium in seiner physiologischen Form nicht in der anorganischen Mineralphase des Knochens konzentriert werden kann, ohne es zuvor zu Orthosilikat zu metabolisieren.
In der radiologischen Studie wurde kein statistisch signifikanter Unterschied zwischen den Studiengruppen im Vergleich zur Kontrollgruppe beobachtet, was auf das Fehlen von Membranen oder Fixiermitteln zur Beschichtung des Defekts zurückzuführen sein könnte, um die Koagulation zu stabilisieren und eine Verzögerung der vollständigen Ossifikation des Bereichs zu verhindern, obwohl der untersuchte Zeitraum (3 Wochen) möglicherweise nicht ausreicht, um dies zu beobachten.
Fazit
Silizium ist ein vielversprechendes Element als Material, das zusammen mit anderen knochenregenerativen Materialien aufgrund seiner geringen Kosten und der beobachteten guten Eigenschaften in vitro und in vivo einbezogen werden kann, obwohl die Definition seiner Eigenschaften und optimalen Anwendungsbedingungen noch untersucht wird. Die Kombination aus plättchenreichem Fibrin, autologem Knochen und Silizium bietet nach 3 Wochen gute Ergebnisse. Die PSB- und SB-Gruppen zeigen gute Ergebnisse, wobei die PSB-Gruppe eine schnellere Knochenmineralisation im Vergleich zur SB-Gruppe aufweist, was auf die Einbeziehung von plättchenreichem Plasma und Silizium zurückzuführen sein könnte. Die in dieser Studie erzielten Ergebnisse zeigen die Bedeutung von autologem Knochen als Teil des Transplantatmaterials, damit der Knochen mineralisieren kann.
Im Rahmen dieser Forschung könnte die histologische Analyse regenerierter Gewebe nützliche Informationen über die Art und Menge des mit Hilfe von Silizium, plättchenreichem Fibrin und autologem Knochen gebildeten Knochens liefern. Weitere Studien sind erforderlich, um das tatsächliche regenerative Potenzial von bioanorganischen Ionen wie Silizium zu verstehen.
Autoren: Argimiro Hernández-Suarez, María Rizo-Gorrita, Dubraska Suárez-Vega, Gladys Velazco, Ivan Rodriguez Gelfenstein, María-Ángeles Serrera-Figallo und Daniel Torres-Lagares
Referenzen:
- Ferres E. Studie über die Wirkung der Zugabe von Silizium zu Beta-Tricalciumphosphat und Hydroxylapatit bei der Neubildung von Knochen in kritischen Defekten in Schädeldecken und Kaninchen. Doktorarbeit. Universität Murcia. 2017.
- Morales D. Gewebeengineering als Stütze der regenerativen Medizin in der Stomatologie. Revista Cubana de Estomatología 2014;51(3):288-304
- Oppenheimer AJ, Tong L, Buchman SR. Craniofaciale Knochenverpflanzung: Wolffs Gesetz neu betrachtet. Craniomaxillofac Trauma Reconstr. 2008;1(1):49-61.
- Henkel J, Woodruff MA, Epari DR, Steck R, Glatt V, Dickinson IC, Choong PF, Schuetz MA, Hutmacher DW. Knochenregeneration basierend auf Konzepten des Gewebeengineerings - Eine Perspektive des 21. Jahrhunderts. Bone Res. 2013 Sep 25;1(3):216-48.
- Mordenfeld A, Johansson CB, Albrektsson T, Hallman M. Eine randomisierte und kontrollierte klinische Studie zu zwei verschiedenen Zusammensetzungen von deproteinisiertem bovinem Knochen und autogenem Knochen, die zur lateralen Ridge-Augmentation verwendet werden. Clin Oral Implants Res. 2014 Mar;25(3):310-320.
- Masoudi E, Ribas J, Kaushik G, Leijten J, Khademhosseini A. Plättchenreiche Blutderivate für das auf Stammzellen basierende Gewebeengineering und die Regeneration. Curr Stem Cell Rep. 2016 Mar;2(1):33-42.
- Anitua E, Sánchez M, Nurden AT, Nurden P, Orive G, Andía I. Neue Erkenntnisse und neuartige Anwendungen für Therapien mit plättchenreichem Fibrin. Trends Biotechnol. 2006 May;24(5):227-34.
- Amaral Valladão CA Jr, Freitas Monteiro M, Joly JC. Geführte Knochenregeneration bei gestaffelter vertikaler und horizontaler Knochenaugmentation unter Verwendung von plättchenreichem Fibrin in Verbindung mit Knochenverpflanzungen: Eine retrospektive klinische Studie. Int J Implant Dent. 2020 Oct 17;6(1):72.
- Cho YS, Hwang KG, Jun SH, Tallarico M, Kwon AM, Park CJ. Radiologische vergleichende Analyse zwischen Kochsalzlösung und plättchenreichem Fibrinfüllung nach hydraulischem transkrestalem Sinuslifting ohne ergänzende Knochenverpflanzung: Eine randomisierte kontrollierte Studie. Clin Oral Implants Res. 2020 Nov;31(11):1087-1093.
- Areewong K, Chantaramungkorn M, Khongkhunthian P. Plättchenreiches Fibrin zur Erhaltung der Alveolarknochenhöhlen nach Zahnextraktion: Eine randomisierte kontrollierte Studie. Clin Implant Dent Relat Res. 2019 Dec;21(6):1156-1163.
- de Almeida Barros Mourão CF, de Mello-Machado RC, Javid K, Moraschini V. Die Verwendung von leukozyten- und plättchenreichem Fibrin bei der Behandlung von Weichgewebeheilung und Schmerzen in post-extraktionshöhlen: Eine randomisierte klinische Studie. J Craniomaxillofac Surg. 2020 Apr;48(4):452-457.
- Castro AB, Herrero ER, Slomka V, Pinto N, Teughels W, Quirynen M. Antimikrobielle Kapazität von Leukozyten- und plättchenreichem Fibrin gegen parodontalpathogene. Sci Rep. 2019 Jun 3;9(1):8188.
- Schuldt L, Bi J, Owen G, Shen Y, Haapasalo M, Häkkinen L, Larjava H. Dekontamination von rauen Implantatoberflächen, die von einem multigenen oralen Biofilm kolonisiert sind, durch Anwendung von leukozyten- und plättchenreichem Fibrin. J Periodontol. 2020 Aug 27.
- Zofková I, Nemcikova P, Matucha P. Spurenelemente und Knochengesundheit. Clin Chem Lab Med. 2013 Aug;51(8):1555-61.
- Zhang D, Wong CS, Wen C, Li Y. Zelluläre Reaktionen von osteoblastenähnlichen Zellen auf 17 elementare Metalle. J Biomed Mater Res A. 2017 Jan;105(1):148-158.
- Arora M., Arora E. Das Versprechen von Silizium: Knochenregeneration und erhöhte Knochendichte. J Arthroscopy and Joint Surgery 2017;4(3):103-105.
- Carlisle EM. Silizium. Ein möglicher Faktor bei der Knochenverkalkung. Science 1970;167:279–280.
- Carlisle EM. Silizium als essentielles Spurenelement in der Tierernährung. Ciba Found Symp. 1986;121:123-39.
- Schwarz K, Milne DB. Wachstumsfördernde Effekte von Silizium bei Ratten. Nature. 1972 Oct 6;239(5371):333-4.
- Dong M, Jiao G, Liu H, Wu W, Li S, Wang Q, Xu D, Li X, Liu H, Chen Y. Biologisches Silizium stimuliert die Synthese von Kollagen Typ 1 und Osteocalcin in menschlichen osteoblastenähnlichen Zellen über den BMP-2/Smad/RUNX2-Signalweg. Biol Trace Elem Res. 2016 Oct;173(2):306-15.
- Price CT, Koval KJ, Langford JR. Silizium: Eine Übersicht über seine potenzielle Rolle bei der Prävention und Behandlung von postmenopausaler Osteoporose. Int J Endocrinol. 2013;2013:316783.
- Zou S, Ireland D, Brooks RA, Rushton N, Best S. Die Auswirkungen von Silikat-Ionen auf die Adhäsion, Proliferation und Differenzierung von menschlichen Osteoblasten. J Biomed Mater Res B Appl Biomater. 2009 Jul;90(1):123-30. Uribe P, Johansson A, Jugdaohsingh R, Powell JJ, Magnusson C, Davila M, Westerlund A, Ransjö M. Lösliches Siliziumdioxid stimuliert die osteogene Differenzierung und Gap-Junction-Kommunikation in menschlichen Zahnd Folikelzellen. Sci Rep. 2020 Jun 18;10(1):9923.
- Kim, E. J., Bu, S. Y., Sung, M. K. & Choi, M. K. Die Auswirkungen von Silizium auf die Osteoblastaktivität und die Knochenmineralisierung von MC3T3-E1-Zellen. Biol. Trace Elem. Res. 2013; 152(1):105–12.
- Hench LL, Xynos ID, Polak JM. Bioaktive Gläser für die in situ Gewebe-Regeneration. J Biomater Sci Polym Ed. 2004;15(4):543-62.
- Chowdhury M. Die auf Silizium basierenden Formulierungen für die Arzneimittelabgabe, Knochenbehandlung und Knochenregeneration. ChemBioEng Rev 2016; 3(5):229-246.
- Byun IS, Sarkar SK, Anirban Jyoti M, Min YK, Seo HS, Lee BT, Song HY. Erste Biokompatibilität und verbesserte Osteoblastenreaktion durch Si-Dotierung in einem porösen BCP-Knochenersatzmaterial. J Mater Sci Mater Med. 2010 Jun;21(6):1937-47.
- Mao Z, Gu Y, ZhangJ, Shu W.W., Cui Y. Überlegene biologische Leistung und osteoinduktive Aktivität von Si-haltigen bioaktiven Knochenregenerationspartikeln für die Rekonstruktion des Alveolarknochens. Ceram. Int. 2020. 46(2020):353-364.
- Wang X, Ito A, Sogo Y, Li X, Oyane A. Silikat-Apatit-Verbundschichten auf externen Fixationsstangen und in vitro Bewertung unter Verwendung von Fibroblasten und Osteoblasten. J Biomed Mater Res A. 2010 Mar 1;92(3):1181-9.
- Roh J, Kim JY, Choi YM, Ha SM, Kim KN, Kim KM. Knochenregeneration unter Verwendung einer Mischung aus siliziumsubstituiertem Korallen-HA und β-TCP in einem Rattenmodell für Knochendefekte. Materials (Basel). 2016 Feb 6;9(2):97.
- Toledano M, Toledano-Osorio M, Osorio R, Carrasco-Carmona Á, Gutiérrez-Pérez JL, Gutiérrez-Corrales A, Serrera-Figallo MA, Lynch CD, Torres-Lagares D. Doxycyclin- und Zinkbeladene Silica-Nanofaser-Polymere als Biomaterialien für die Knochenregeneration. Polymers (Basel). 2020 May 25;12(5):1201.
- Sánchez F, Orero A, Soriano A, Correcher C, Conde P, González A, Hernández L, Moliner L, Rodríguez-Alvarez MJ, Vidal LF, Benlloch JM, Chapman SE, Leevy WM. ALBIRA: ein PET∕SPECT∕CT-Bildgebungssystem für kleine Tiere. Med Phys. 2013 May;40(5):051906.
- Donath K, Breuner G. Eine Methode zur Untersuchung von unentkalkten Knochen und Zähnen mit angehängten Weichgeweben. Die Säge-Schliff-Technik. J Oral Pathol. 1982 Aug;11(4):318-26.
- Garbo C, Locs J, D'Este M, Demazeau G, Mocanu A, Roman C, Horovitz O, Tomoaia-Cotisel M. Fortschrittliche Mg, Zn, Sr, Si mehrfach substituierte Hydroxylapatite für die Knochenregeneration. Int J Nanomedicine. 2020 Feb 13;15:1037-1058.
- Wang W, Yeung KWK. Knochenverpflanzungen und Biomaterialersatzstoffe zur Reparatur von Knochendefekten: Eine Übersicht. Bioact Mater. 2017 Jun 466 7;2(4):224-247.
- Götz W, Tobiasch E, Witzleben S, Schulze M. Auswirkungen von Siliziumverbindungen auf Biomineralisation, Osteogenese und Bildung von Hartgewebe. Pharmaceutics. 2019 Mar 12;11(3):117.
- Gibson IR, Best SM, Bonfield W. Einfluss der Siliziumsubstitution auf das Sintern und die Mikrostruktur von Hydroxylapatit. J Am Ceram Soc. 2002;85(11):2771–2777
- Porter AE, Botelho CM, Lopes MA, Santos JD, Best SM, Bonfield W. Ultrastruktureller Vergleich der Auflösung und Apatitniederschlag auf Hydroxylapatit und siliziumsubstituiertem Hydroxylapatit in vitro und in vivo. J Biomed Mater Res A. 2004 Jun 15;69(4):670-9.
- Li H, Chang J. Bioaktive silikathaltige Materialien stimulieren die Angiogenese in einem Co-Kultur-System von Fibroblasten und Endothelzellen durch parakrine Wirkung. Acta Biomater. 2013 Jun;9(6):6981-91.
- Shie MY, Ding SJ, Chang HC. Die Rolle von Silizium in der Proliferation und Apoptose von osteoblastenähnlichen Zellen. Acta Biomater. 2011 477 Jun;7(6):2604-14.
- Thian E.S., Huang J., Best S.M., et al., Die Reaktion von Osteoblasten auf nanokristallines siliziumsubstituiertes Hydroxylapatit-Dünnfilm. Biomaterials 2006; 27(13):2692–2698
- Lee, S. H., Kim, S. W., Lee, J. I., Yoon, H. J. Die Wirkung von plättchenreichem Fibrin auf die Knochenregeneration und Angiogenese in Ratten-Schädeldefekten. Tissue Engineering and Regenerative Medicine 2015. 12(5):362-370.
- Jeon YR, Kim MJ, Kim YO, Roh TS, Lee WJ, Kang EH, Yun IS. Scaffoldfreie Knochenregeneration unter Verwendung von plättchenreichem Fibrin in einem Kalvarienmodell. J Craniofac Surg. 2018 Jan;29(1):251-254.
- Sindel A, Dereci Ö, Toru HS, Tozoğlu S. Histomorphometrischer Vergleich der Knochenregeneration in kritischen Knochendefekten unter Verwendung von demineralisierter Knochenmatrix, plättchenreichem Fibrin und Hyaluronsäure als Knochenersatzstoffe. J Craniofac Surg. 2017 Oct;28(7):1865-1868.
- Kökdere NN, Baykul T, Findik Y. Die Verwendung von plättchenreichem Fibrin (PRF) und PRF-mischtem partikulärem autogenem Knochenersatz bei der Behandlung von Knochendefekten: Eine experimentelle und histomorphometrische Studie. Dent Res J (Isfahan). 2015 Sep-Oct;12(5):418-24.
- Karayürek F, Kadiroğlu ET, Nergiz Y, Coşkun Akçay N, Tunik S, Ersöz Kanay B, Uysal E. Kombination von plättchenreichem Fibrin mit verschiedenen Knochenersatzmaterialien: Eine experimentelle Studie zu den histopathologischen und immunhistochemischen Aspekten der Knochenheilung. J Craniomaxillofac Surg. 2019 May;47(5):815-825.
- Knapen M, Gheldof D, Drion P, Layrolle P, Rompen E, Lambert F. Einfluss von leukozyten- und plättchenreichem Fibrin (L-PRF) auf die Knochenregeneration: Eine Studie an Kaninchen. Clin Implant Dent Relat Res. 2015 Jan;17 Suppl 1:e143-52.
- Sani F, Mehdipour F, Talaei-Khozani T, Sani M, und RazbanV. Herstellung von plättchenreichem Plasma/Silica-Gerüsten für das Knochengewebeengineering Bioinspired, Biomimetic und Nanobiomaterialien 2018 7:2, 74-81.
- Bonazza V, Borsani E, Buffoli B, Parolini S, Inchingolo F, Rezzani R, Rodella LF. In vitro Behandlung mit konzentrierten Wachstumsfaktoren (CGF) und Natriumorthosilikat wirkt sich positiv auf die Zellneuerung in drei verschiedenen menschlichen Zelllinien aus. Cell Biol Int. 2018 Mar;42(3):353-364.
- Faot F, Deprez S, Vandamme K, Camargos GV, Pinto N, Wouters J, van den Oord J, Quirynen M, Duyck J. Der Einfluss von L-PRF-Membranen auf die Knochenheilung in Knochendefekten der Tibia von Kaninchen: Mikro-CT- und Biomarkerergebnisse. Sci Rep. 2017 Apr 12;7:46452.
- Fielding GA, Smoot W, Bose S. Auswirkungen von SiO2, SrO, MgO und ZnO-Dopanten in Tricalciumphosphaten auf die osteoblastische Runx2-Expression. J Biomed Mater Res A. 2014 Jul;102(7):2417-26.
- Kamitakahara M, Tatsukawa E, Shibata Y, Umemoto S, Yokoi T, Ioku K, Ikeda T. Einfluss der Silikat-Einbringung auf die in vivo-Reaktionen von α-Tricalciumphosphat-Keramiken. J Mater Sci Mater Med. 2016 May;27(5):97.
- Chappell HF, Jugdaohsingh R, Powell JJ. Physiologische Siliziumeinlagerung in Knochenmineral erfordert den Metabolismus von Orthosiliciumsäure zu SiO44. J R Soc Interface. 2020 Jun;17(167):20200145.
- Gutiérrez-Prieto SJ, Fonseca LF, Sequeda-Castañeda LG, Díaz KJ, Castañeda LY, Leyva-Rojas JA, Salcedo-Reyes JC, Acosta AP. 508 Ausarbeitung und Biokompatibilität eines aus Eierschalen abgeleiteten Hydroxylapatitmaterials, das mit Si/PLGA für die Knochenregeneration modifiziert wurde. Int J Dent. 2019 Dec 5;2019:5949232.
- Szurkowska K, Szeleszczuk Ł, Kolmas J. Auswirkungen der Synthesebedingungen auf die Bildung von Si-substituierten Alpha-Tricalciumphosphaten. Int J Mol Sci. 2020 Dec 1;21(23):9164.
