Charakterisierung der Balzgeräusche von Arten der Untergruppe Fasciola (Diptera, Drosophilidae, Drosophila repleta-Gruppe): interspezifische und interpopulationale Analysen
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziel dieser Arbeit war es, das Muster des männlichen Balzgesangs verschiedener Arten der fasciola-Untergruppe zu charakterisieren und das Ausmaß der Variation sowohl innerhalb als auch zwischen den Arten zu bestimmen. Die analysierten Parameter waren Intervall innerhalb eines Pulses (PI), Intervall zwischen den Pulsen (IPI) und Frequenz innerhalb eines Pulses (IF). Sechs verschiedene Arten wurden analysiert: D. coroica (drei Populationen), D. ellisoni, D. fascioloides, D. moju, D. onca und D. rosinae (jeweils eine Population). Es gab signifikante Unterschiede zwischen den sechs Arten hinsichtlich dieser drei Parameter des Balzgesangs. Der IPI war der variabelste Parameter unter diesen Arten, was darauf hindeutet, dass dieser Parameter für die weibliche Diskriminierung wichtig ist. Vier verschiedene Hypothesen könnten diese Variation erklären: 1. unterschiedliche Selektionsdrücke bei Abwesenheit von Genfluss; 2. intraspezifische sexuelle Selektion; 3. sympatrische Effekte auf die Evolution des Gesangs; und 4. genetische Drift. Der PI war der einzige Parameter, der signifikant zwischen den drei Populationen von D. coroica unterschiedlich war. Eine geringe Variabilität zwischen Populationen innerhalb derselben Art wurde bereits für andere Untergruppen beobachtet und könnte durch folgende Hypothesen erklärt werden: starker Selektionsdruck auf die Gesangsparameter, Genfluss oder kürzliche Kolonisierung aus einer gemeinsamen Quelle. Zusätzliche Studien zum Balzgesang anderer Arten der fasciola-Untergruppe sowie für andere Untergruppen der repleta-Gruppe und Studien, die molekulare Marker verwenden und sich auf die genetische Basis der Unterschiede zwischen diesen Arten im Balzgesang konzentrieren, würden es uns ermöglichen, die Assoziation zwischen Balzgesang und sexueller Isolation bei diesen Arten zu bewerten und würden uns auch helfen, die Evolution dieser Verhaltensunterschiede zu verstehen.
Einführung
Werbungsgeräusche
Das Werbeverhalten von Fliegen der Gattung Drosophila ist wichtig für die Artenerkennung. Nachdem Shorey (1962) zeigte, dass D. melanogaster-Männchen während der sexuellen Werbung Geräusche erzeugten, wurden viele Studien mit den verschiedenen Gruppen und Untergruppen der Gattung Drosophila durchgeführt, die die spezifische Natur der Geräuscharten beschreiben. Diese Studien haben Beweise erbracht, dass Geräusche sowohl eine Funktion als sexueller Stimulator als auch in der sexuellen Isolation haben. Diese Geräusche variieren signifikant zwischen den verschiedenen Arten der affinis (Chang & Miller, 1978), melanogaster (Cowling & Burnet, 1981), virilis (Hoikkala et al., 1982; Hoikkala & Isoherranen, 1997), mercatorum (Ikeda & Maruo, 1982), repleta (Ewing & Miyan, 1986), auraria (Tomaru & Oguma, 1994), planitibia (Hoikkala et al., 1994), willistoni (Ritchie & Gleason, 1995), quinaria (Neems et al., 1997) und obscura (Noor & Aquadro, 1998) Gruppen.
Die interspezifischen Unterschiede in den Drosophila Balzgeräuschen sind durch ein oder mehrere Klangparameter gekennzeichnet, wie: Interpulse-Intervall (IPI), das die Zeit vom Beginn eines Pulses bis zum Beginn des nächsten ist; Intrapulse-Intervall (PI), das die Pulsdauer ist; Intrapulse-Frequenz (IF), die akustisch die stärkste Frequenz innerhalb des Pulses ist; Anzahl der Pulse pro Serie; und Dauer jedes Intervalls innerhalb einer Serie (Hoikkala & Lumme, 1987; Wheeler et al., 1988). Obwohl nicht festgelegt ist, welche Klangparameter Spezifität verleihen, gibt es Hinweise darauf, dass IPI wichtig ist. Laut Ritchie & Kyriacou (1996) variiert das IPI der Drosophila Balzgeräusche innerhalb natürlicher Populationen sehr wenig und ist wichtig für den Fortpflanzungserfolg der Männchen.
Es ist jedoch klar, dass viele Drosophila Arten komplexe Geräusche mit verschiedenen Eigenschaften erzeugen, von denen eines oder mehrere zur Identifizierung von Arten von Wert sein können. Diese Spezifität in den Drosophila Balzgeräuschen kann durch Selektion zur Unterscheidung zwischen Arten (Tomaru & Oguma, 1994) der verschiedenen Arten von Geräuschen erklärt werden, die sich durch intraspezifische sexuelle Selektion entwickelt haben könnten (Ritchie & Gleason, 1995). Auch die verschiedenen Arten von Geräuschen, die in den verschiedenen Drosophila Arten vorkommen, könnten einfach phylogenetische Divergenzen widerspiegeln.
Die Fasciola-Untergruppe
Die Arten der Untergruppe fasciola kommen in feuchten Wäldern vor, hauptsächlich in Mittel- und Südamerika sowie auf den Karibikinseln. In Brasilien wurden sie im atlantischen Regenwald sowie in Wäldern der Bundesstaaten São Paulo, Paraná, Mato Grosso do Sul und Bahia gesammelt (Vilela, 1983; Vilela et al., 1983; Tidon-Sklorz & Sene, 1992).
Die meisten Arbeiten zu dieser Untergruppe waren zytologisch und wurden zu Beginn der 60er Jahre durchgeführt. Sie zeigten, dass sich die Arten dieser Gruppe von allen anderen Arten der Gruppe repleta durch die homozygoten Inversionen: 2o2, 2e3 und 2l3 unterscheiden. Wasserman (1982) schlug eine gemeinsame Abstammung der Untergruppen fasciola und mulleri vor, da sie die 3c-Inversion gemeinsam haben. Kürzlich zeigte jedoch Diniz (1998), dass die 3c-Inversion der Untergruppe fasciola sich von der in der Untergruppe mulleri unterscheidet und schlug vor, dass die Untergruppe fasciola direkt von primitiven I abgeleitet ist und nicht mehr mit der Untergruppe mulleri verbunden werden kann. Kuhn et al. (1995) führten eine karyotypische Studie einiger Arten der Untergruppe fasciola durch und fanden interspezifische Variationen in der Größe des Mikrochromosoms und in der Chromosomenzahl.
Laut Wasserman (1992) besteht die fasciola-Untergruppe aus neun Arten: D. pictilis und D. pictura, die den pictilis-Komplex bilden; D. paraguttata; D. mojuoides und D. moju, die den moju-Komplex bilden; sowie D. fulvalineata, D. fasciola, D. coroica und D. fascioloides, die in keinem Komplex vorkommen. Vilela (1983) stellte bei der Untersuchung der Morphologie der männlichen Genitalien fest, dass die von Wasserman (1962) untersuchte Art D. fascioloides tatsächlich nicht zu dieser Art gehörte und benannte sie in D. ellisoni um. Er fügte auch die Arten D. linearepleta und D. onca zur Untergruppe fasciola hinzu und beschrieb D. carolinae, D. hermionae, D. ivai, D. querubimae, D. rosinae und D. senei als neue Arten, wodurch die Anzahl der Arten in dieser Untergruppe auf 18 erhöht wurde.
In dieser Arbeit beschreiben wir die Balzgeräuschmuster von sechs Arten der Untergruppe fasciola: D. ellisoni, D. fascioloides, D. moju, D. onca, D. rosinae und D. coroica. Neben den interspezifischen Analysen untersuchten wir auch die Unterschiede in den Geräuschmustern von drei verschiedenen Populationen von D. coroica.
Materialien und Methoden
Einrichtung und Pflege von Isolinen
Isolinen wurden aus einzelnen Weibchen erzeugt, die bereits in der Natur gepaart waren. Diese Isolinen wurden durch morphologische Analyse der Genitalien von F1-Männchen identifiziert (Vilela, 1983). Dritte Larvenstadien der Untergruppe fasciola versuchen normalerweise, aus dem Kulturgefäß zu kriechen. Um dieses Problem zu vermeiden, wurden die Kulturgefäße geöffnet und auf feuchtem Sand innerhalb von Plastikflaschen platziert, damit die Larven im Sand verpuppen konnten. Eclosierte Fliegen wurden mit einem Aspirator entfernt und in Gefäße mit Kulturmedium transferiert, wo sie heranreiften, paarten und Eier legten, wodurch der Zyklus neu gestartet wurde.
Tonaufnahmen
Kürzlich eclosierte, jungfräuliche Fliegen wurden in 35 ml Kulturgefäßen isoliert und 7-10 Tage lang gelassen, um Zeit für die sexuelle Reifung zu ermöglichen. Anschließend wurde ein Männchen und ein Weibchen derselben Linie in eine Tonaufzeichnungskammer eingeführt, die von Sene & Manfrin (1998) beschrieben wurde. Um den Ton aufzunehmen, wurde die Kammer mit dem Fliegenpaar auf das Diaphragma eines ultrasensiblen Mikrofons platziert, wie von Manfrin et al. (1997) beschrieben. Die Fliegen wurden maximal 10 Minuten lang beobachtet oder bis zur Paarung. Alle Aufnahmen wurden bei 25 ± 1ºC gemacht.
Klanganalyse
Die elektromagnetischen Signale der analogen Aufnahmen wurden mit einer Frequenz von 5 kHz in digitale Signale umgewandelt, mit einem analog-digitalen Wandlerkreis CAD 12/36-60 k (Lynx) und dem Programm AqDADOS 4 (Lynx).
Die Balzgeräuschmuster von sechs verschiedenen Arten der Untergruppe fasciola werden in Tabelle 1 beschrieben. Die Klangmuster von D. coroica Männchen aus drei verschiedenen Standorten wurden ebenfalls analysiert, um interpopulationale Unterschiede zu untersuchen.
Die für vergleichende Studien der Klangmuster verwendeten Parameter waren das Intrapulsintervall (PI), das Interpulsintervall (IPI) und die Intrapulsfrequenz (IF). Die PI- und IPI-Werte wurden direkt aus den Abbildungen entnommen. Die IFs wurden mit Hilfe der MATLAB-Software (MathWorks, Inc.) unter Verwendung der schnellen Fourier-Transformationen (FFT) ermittelt. Diese Analyse zerlegt das Tonsignal in eine Reihe von Wellen (Sinus- und Kosinuswellen) unterschiedlicher Frequenzen und Amplituden. Die IF eines Klangs wird als die Frequenz der Welle mit der höchsten Amplitude im Tonsignal definiert.
Die FFT kann Klänge analysieren, die Tausende von Punkten pro Millisekunde enthalten, aber die maximale Analyseeffizienz wird erreicht, indem die Anzahl der Punkte auf Potenzen von zwei beschränkt wird. Aus diesem Grund wurden alle Intervalle, die für die Analyse der IF verwendet wurden, so ausgewählt, dass sie eine Anzahl von Punkten hatten, die Potenzen von zwei entsprach. Daher wurden Intervalle von 64 Punkten für D. moju; 128 Punkte für D. rosinae und D. coroica; 256 Punkte für D. ellissoni; und 512 Punkte für D. onca und D. fascioloides verwendet. Zehn Messungen der Parameter PI, IPI und IF wurden für jeden der 10 Männchen aus jeder der Isolinen durchgeführt.
Statistische Analyse
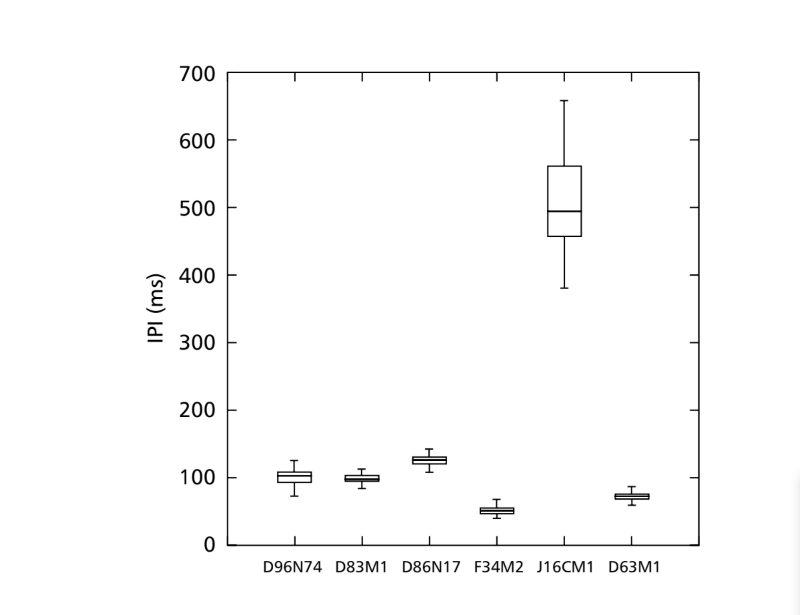
Die in Tabelle 1 beschriebenen Linien wurden mit dem Ziel analysiert, interspezifische Unterschiede zu untersuchen. Die Isoline D96N74 wurde als repräsentativ für D. coroica ausgewählt. Die drei Linien (D96N74, D88M1 und J7C1) von D. coroica wurden separat auf interpopulationale Unterschiede getestet. Die Werte der Parameter Intrapulsintervall (PI), Interpulsintervall (IPI) und Intrapulsfrequenz (IF) wurden separat durch eine Varianzanalyse (EINWEG-ANOVA) auf einem Signifikanzniveau von 0,05 analysiert.
Ergebnisse
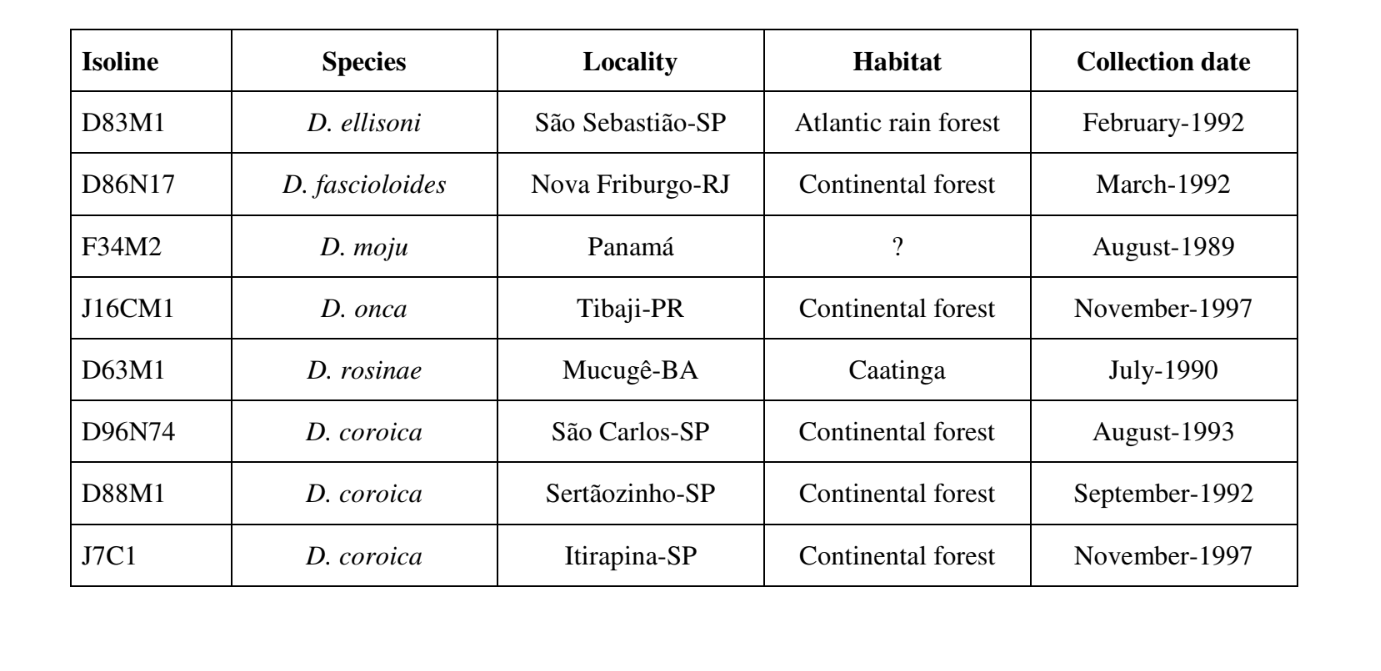
Die Abbildungen 1 bis 6 zeigen die grundlegenden Sonogramme der verschiedenen analysierten Arten. Die Isoline D96N74 wurde gewählt, um die Art D. coroica zu repräsentieren. Diese Sonogramme und die Analyse der Schallpulse ermöglichen eine Unterteilung der Balzgeräusche in drei verschiedene Gruppen: 1. Balzgeräusche der Arten D. onca, D. fascioloides und D. ellisoni, bei denen jede Geräuschsequenz aus einer Folge kurzer Pulse besteht, gefolgt von einem Trill, ähnlich dem, was in einigen Arten der Untergruppe planitibia gefunden wird, die von Hoikkala et al. (1994) als Phrase Song bezeichnet wird. Bei den Arten D. fascioloides und D. onca besteht die Pulssequenz aus vier Pulsen, gefolgt von einem relativ langen Trill, während es bei D. ellisoni nur zwei Pulse gibt, gefolgt von einem kürzeren Trill; 2. der Typ, der typisch für das Sonogramm von D. rosinae ist, mit einem Balzgeräusch, das aus einfachen, aber duplizierten Pulsen besteht, einem Muster, das auch von Ewing & Miyan (1986) in einigen Arten der repleta-Gruppe beobachtet wurde; 3. ein Typ, der auf den Balzgeräuschen der Arten D. moju und D. coroica basiert, mit kurzen Pulsen in Sequenz, ähnlich dem Puls-Song von D. melanogaster (Schilcher, 1976) und dem Geräusch A von D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al., 1997).
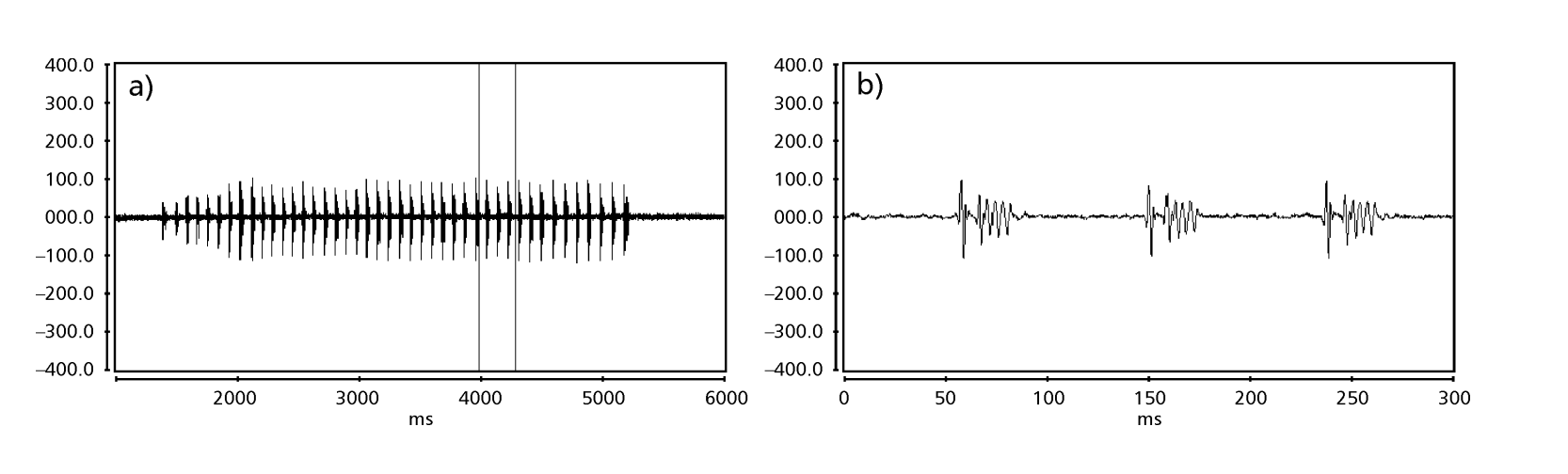
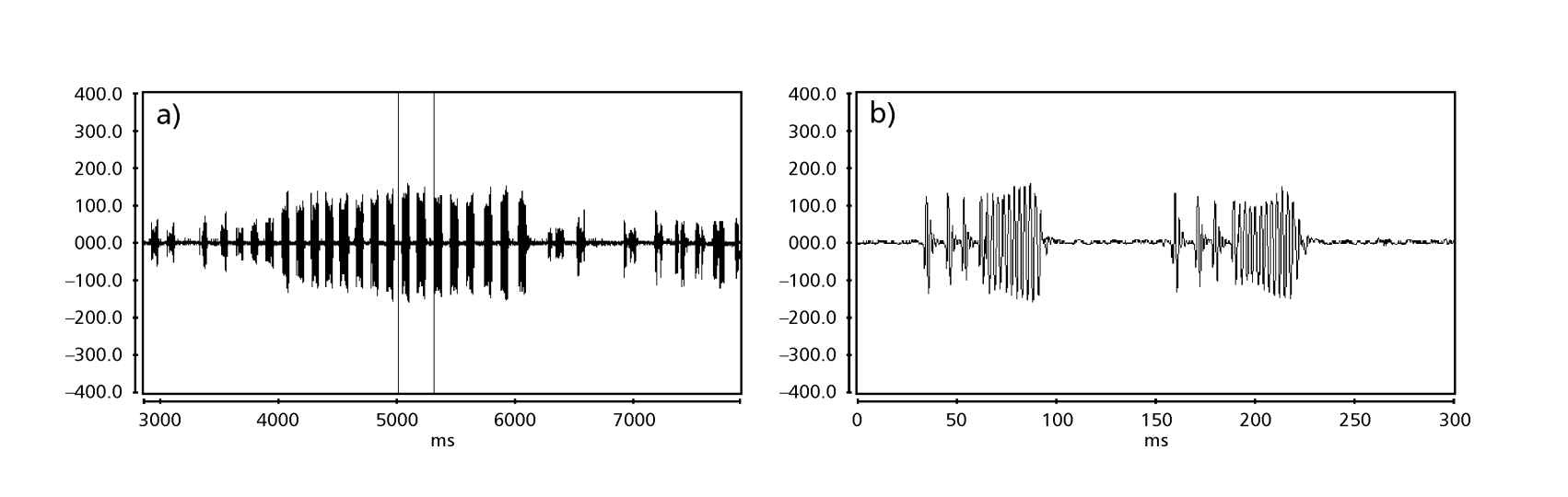
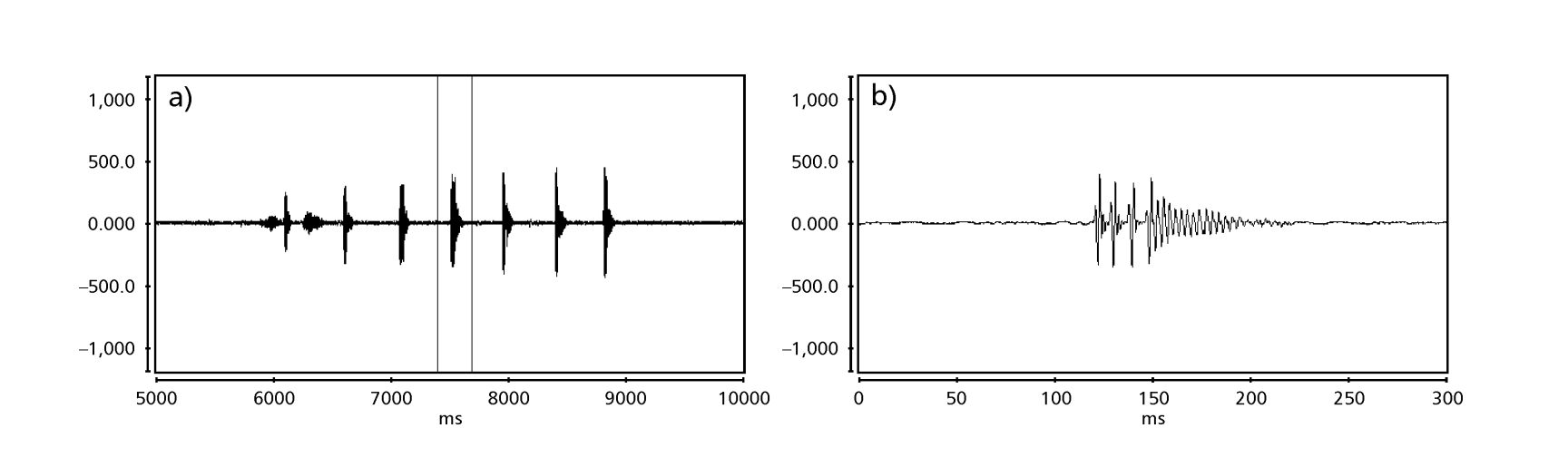
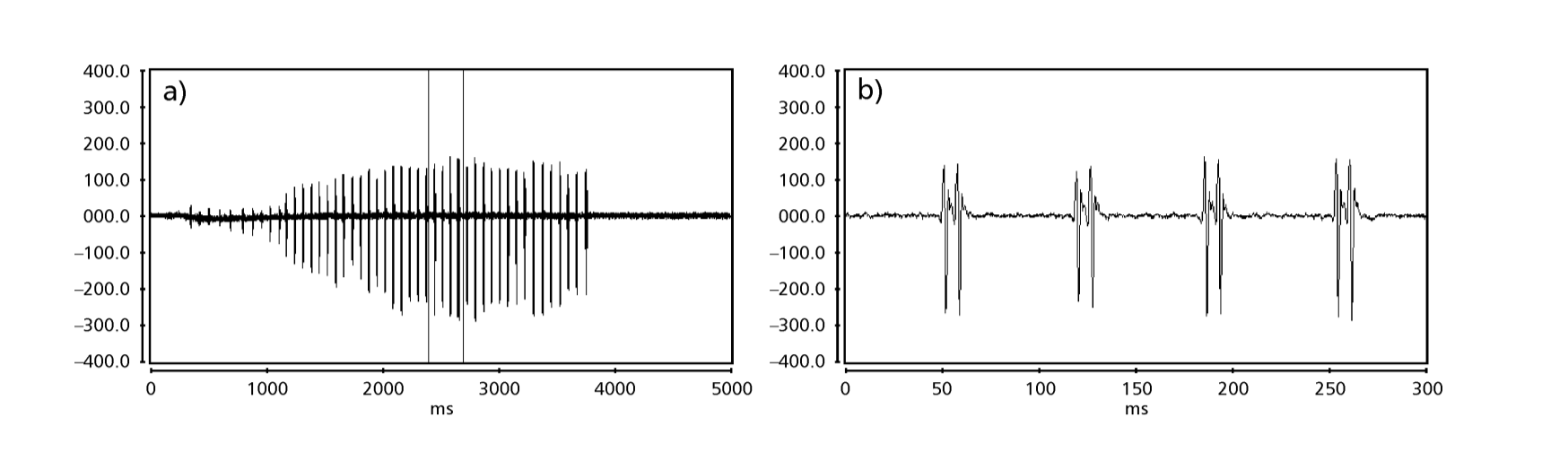
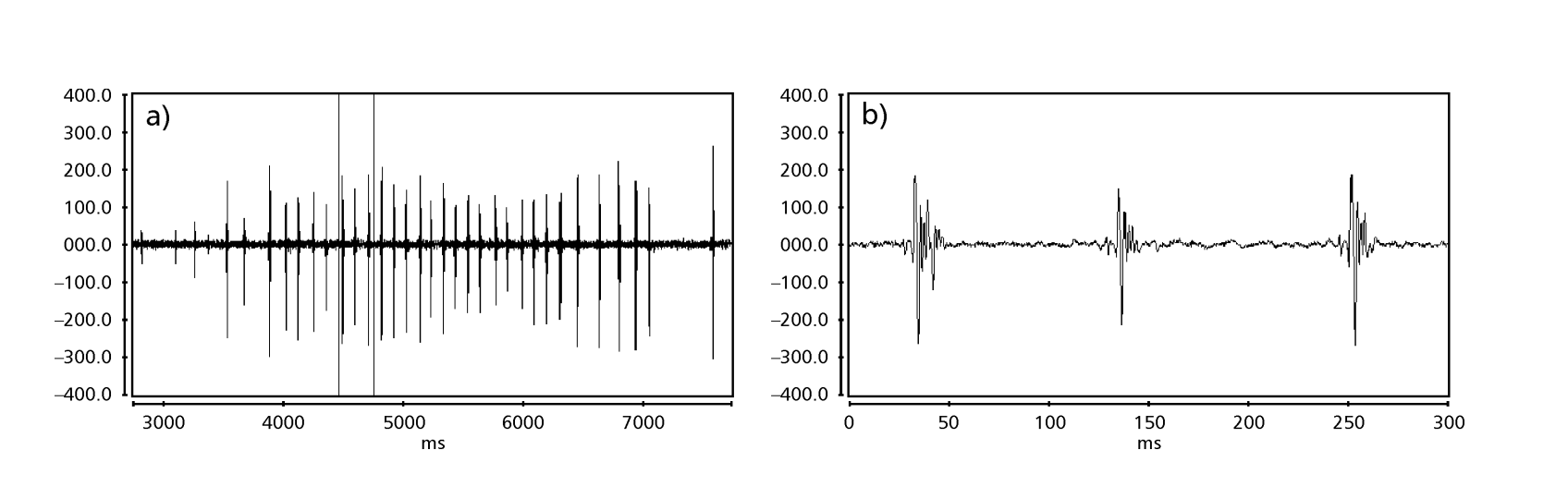
Die Sonogramme jeder der analysierten Arten waren eine Sequenz eines Typs von Schallimpuls. Diese Feststellung unterscheidet sich von den Ergebnissen von Studien an den Arten D. melanogaster (Schilcher, 1976), D. mercatorum (Ikeda & Maruo, 1982; Manfrin et al., 1997) und einigen Arten der Untergruppe repleta (Ewing & Miyan, 1986), bei denen zwei verschiedene Arten von Geräuschen gefunden wurden.
Tabelle 2 zeigt die Mittelwerte für PI (Intervall innerhalb des Impulses), IPI (Intervall zwischen den Impulsen) und IF (Frequenz innerhalb des Impulses) der Isolinen, die in Tabelle 1 beschrieben sind. Ein Vergleich der Standardabweichungen (± sd) zwischen den verschiedenen Arten zeigt, dass D. ellisoni und D. fascioloides die geringste Variation für alle drei Parameter aufweisen: PI (27.470 ± 2.73 und 69.859 ± 6.12), IPI (97.473 ± 5.76 und 125.757 ± 7.87) und IF (251.358 ± 19.36 und 362.901 ± 17.04), was darauf hinweist, dass die Balzgeräusche dieser Arten einheitlich mit wenig intra-spezifischer Variation sind. Andererseits hatte D. onca eine beträchtliche Variation in PI (93.662 ± 31.44) und IPI (508.091 ± 73.06) und eine moderat hohe Variation in IF (289.260 ± 32.71) im Vergleich zu den anderen Arten, was darauf hinweist, dass die Unterschiede in PI und IPI, obwohl groß, nicht ausreichten, um die Pulswellenform signifikant zu verändern. Die Standardabweichungen waren relativ niedrig für PI (7.363 ± 7.36 und 14.673 ± 1.98) und IPI (50.859 ± 5.47 und 72.340 ± 5.68) in D. moju und D. rosinae, aber die IF-Werte waren relativ hoch (412.501 ± 55.63 und 306.624 ± 57.80). In diesem Fall, obwohl die Pulsdauer und die Zeit von einem Puls zum nächsten innerhalb jeder dieser Arten relativ einheitlich waren, variierte die Schallimpulswellenform erheblich.
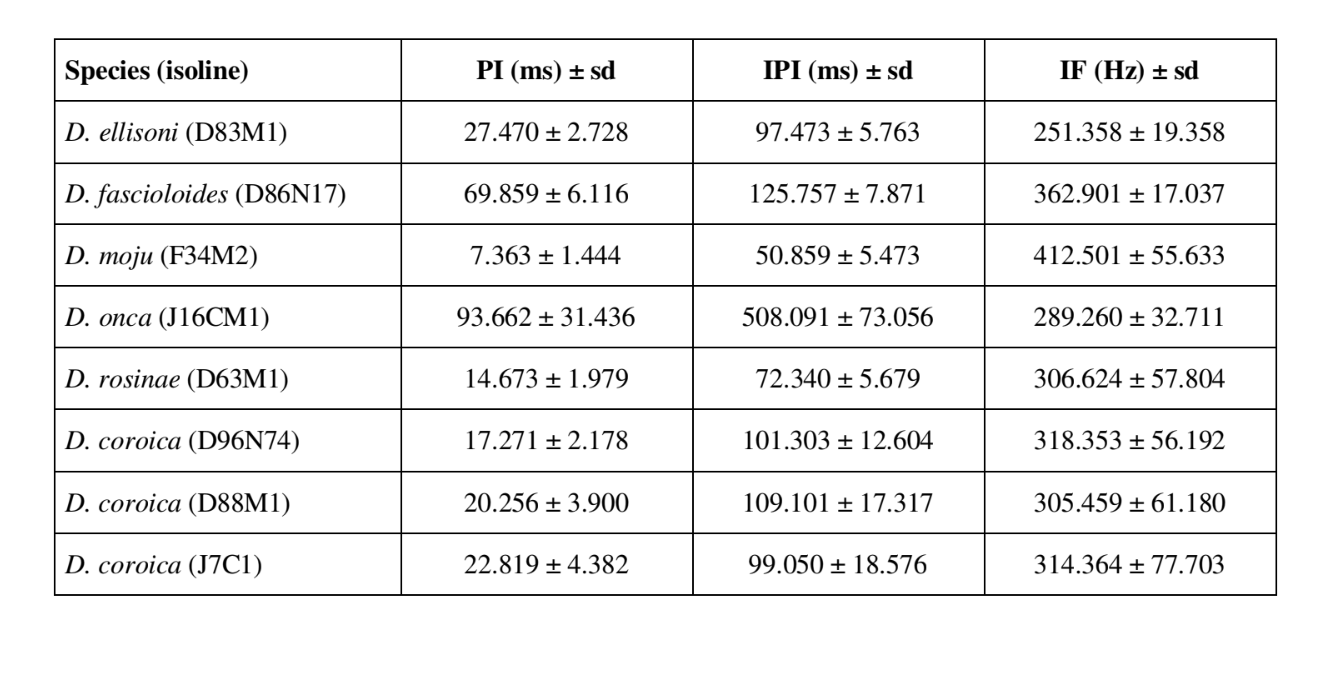
Es gab relativ wenig intrapopulational Variation in den PIs der D. coroica Linien D96N74, D88M1 und J7C1 (17.271 ± 2.18, 20.256 ± 3.90 und 22.819 ± 4.38, jeweils), eine mittlere Variabilität im IPI (101.303 ± 12.60, 109.101 ± 17.32 und 99.050 ± 18.58) und eine hohe Variabilität im IF (318.353 ± 56.19, 305.459 ± 61.18 und 314.364 ± 77.70), was darauf hinweist, dass selbst bei geringer intrapopulationaler Variation in der Länge des Schallpulses eine beträchtliche Variation in der Schallpulswellenform vorlag.
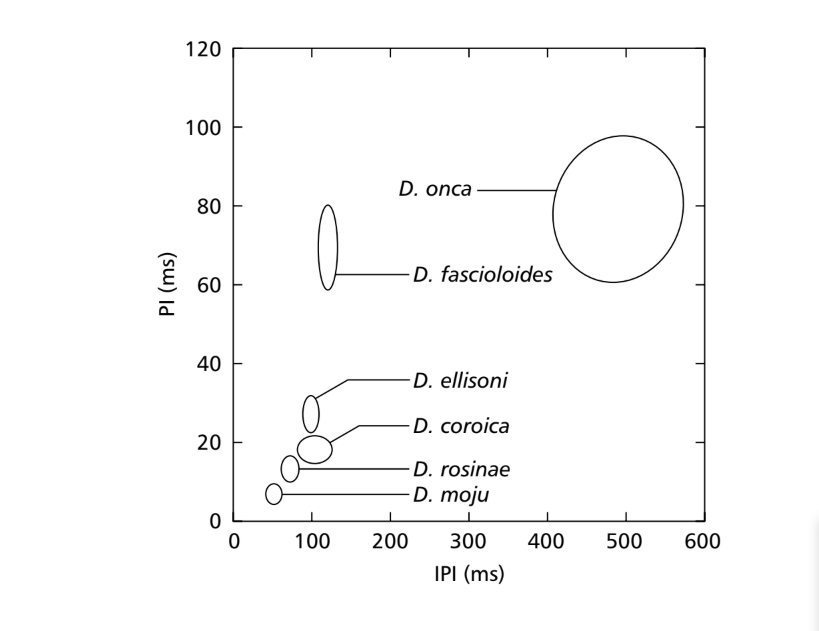
Bei einem Vergleich der Mittelwerte für die Parameter PI und IPI konnten Unterschiede zwischen den Arten der Untergruppe fasciola für mindestens einen dieser Parameter festgestellt werden. Diese Unterschiede in den Balzlauten sind in Abb. 7 zu sehen, in der die Werte für diese beiden Parameter in Form von Ellipsen dargestellt sind, die 75% der Werte für die Parameter PI und IPI umfassen. Signifikante Unterschiede wurden in den PI-Werten (ANOVA, F5,48 = 124.98, p < 0.001) und IPI-Werten (ANOVA, F5,48 = 949.35, p < 0.001) zwischen den Arten gefunden. Die interspezifischen Unterschiede im IF sind in Abb. 8 dargestellt. Auch in den IF-Werten wurden signifikante Unterschiede festgestellt (ANOVA, F5,48 = 23.40, p < 0.001).
Die drei Populationen von D. coroica unterschieden sich signifikant im PI (ANOVA, F2,24 = 8.75, p < 0.05), jedoch nicht im IPI (ANOVA, F2,24 = 1.72, p > 0.10) und IF (ANOVA, F2,24 = 0.15, p > 0.25).
Diskussion
Hoikkala et al. (1994) entdeckten in ihrer Analyse des Balzgeräuschs verschiedener Arten der Untergruppe planitibia, dass es häufig vorkommt, die gleichen Arten von Geräuschen bei phylogenetisch nah verwandten Arten zu finden. Außerdem beobachteten Hoikkala & Kaneshiro (1993), dass einige eng verwandte Arten in dieser Untergruppe, die sympatrisch sind, unterschiedliche Arten von Geräuschen in der Balzzeit verwenden.
Noor & Aquadro (1998) fanden signifikante Unterschiede in den Balzgeräuschen bei zwei eng verwandten Arten der Untergruppe obscura: D. pseudoobscura und D. persimilis. Einige Experimente mit Kreuzungen zwischen diesen beiden Arten deuteten darauf hin, dass Weibchen von D. pseudoobscura wahrscheinlich ihre Diskriminierung gegenüber Männchen von D. persimilis in sympatrischen Populationen erhöhten. Dies könnte durch Selektion gegen die Produktion schlecht angepasster Hybriden geschehen sein, was zu einer Veränderung des Balzgeräuschs in diesen sympatrischen Populationen führte.
Ewing & Miyan (1986), die mit Arten der repleta-Gruppe arbeiteten, fanden keine Beziehung zwischen einer Phylogenie, die auf zytologischen Daten basierte, und einer anderen, die aus Schall-Daten erstellt wurde. Dennoch erlauben einige der Merkmale, die die meisten der untersuchten Arten gemeinsam haben und die auch in Arten anderer Gruppen vorkommen, uns, einen ancestral courtship sound für die repleta-Gruppe vorzuschlagen. Dieser Klang hätte aus zwei verschiedenen Komponenten bestanden: dem anfänglichen Klang A, der aus maximal 10 kurzen und regelmäßigen monocyklischen Pulsen besteht, mit einem Intervall zwischen den Pulsen von 8 bis 15 ms; und Klang B, der aus einer Reihe von regelmäßigen und monocyklischen Pulsen besteht, jedoch mit einer größeren Anzahl von Pulsen und einem längeren Intervall zwischen den Pulsen am Ende des Werbens. Während der Evolution der repleta-Gruppe hätten einige Arten Klang A verloren, und andere Klang B, und bei vielen hätte Klang B weniger regelmäßig und komplexer geworden.
Basierend auf diesen Annahmen und der Beobachtung der Sonogramme, die für die sechs Arten der fasciola-Untergruppe in dieser Studie erhalten wurden, können wir schließen, dass in all diesen Arten ein Verlust von Klang A stattgefunden hat, da die Intervalle zwischen den Pulsen immer viel länger als 15 ms sind. D. coroica hat unregelmäßige Pulse, mit einem durchschnittlichen Intervall zwischen den Pulsen von 101,3 ms, während die Werbe-Klänge von D. moju aus regelmäßigeren Pulsen besteht, mit einem durchschnittlichen Intervall zwischen den Pulsen von
50,9 ms. D. rosinae hat ein Sonogramm, das aus duplizierten Pulsen besteht, einem Schalltyp, der auch von Ewing & Miyan (1986) gefunden wurde, mit einem durchschnittlichen Intervall zwischen den Pulsen von 72,3 ms. D. ellisoni, D. fascioloides und D. onca haben Balzlaute, die aus polyzyklischen Pulsen bestehen, wahrscheinlich das Ergebnis einer Fusion der Töne A und B, mit durchschnittlichen Intervallen zwischen den Pulsen von 97,4, 125,7 und 508,0 ms, jeweils. Diese Ähnlichkeiten in den Klangtypen dieser drei Arten sind nicht eng mit zytologischen Daten korreliert, außer für D. ellisoni und D. fascioloides, die in einer Phylogenie basierend auf zytologischen Merkmalen nahe beieinander platziert wurden; sie haben zwei Chromosomenfusionen gemeinsam: 2-4F und 3-5F (Diniz, 1998). Wie im Fall von morphologischen Merkmalen wird erwartet, dass eng verwandte Arten einige Klangparameter teilen. Dennoch sind die evolutionären Tendenzen basierend auf Klangmerkmalen, selbst wenn die phylogenetischen Beziehungen zwischen den Arten bekannt sind, nicht gut etabliert.
Obwohl der Balzton kein Beispiel für zirkadianes Verhalten ist, wurde dieses Verhalten mit der Expression des Gens period (per), das sich auf dem X-Chromosom befindet und auf molekularer Ebene gut charakterisiert ist, in Verbindung gebracht. Mutationen in diesem Gen können den zirkadianen Rhythmus von Drosophila verändern. Eine genetische Analyse von Konopka et al. (1996) zeigte, dass der Klangrhythmus des Intervall zwischen den Pulsen ebenfalls von Mutationen im Gen per betroffen ist. Kyriacou & Hall (1980) berichteten von einer rhythmischen Modulation des Intervals zwischen den Pulsen mit spezifischen Perioden in D. melanogaster und D. simulans von 55 bzw. 35 Sekunden. Diese Unterschiede wurden als mit einigen Variationen im per-Gen verbunden gezeigt. Mutationen in diesem Gen, die ursprünglich von Konopka & Benzer (1971) in einer Analyse abnormaler zirkadianer Rhythmen untersucht wurden, verursachten entsprechende Effekte in den Intervallrhythmen der Balzgeräusche. Die Mutation perShort (perS), mit einem zirkadianen Rhythmus von etwa 19-20 Stunden, hatte eine mittlere Periode von 41,5 Sekunden; die Mutation perLong (perL), deren zirkadianer Rhythmus 28-30 Stunden betrug, hatte eine mittlere Periode von 82,1 Sekunden; und die Mutation per0 hatte keinen Rhythmus des Intervals zwischen den Pulsen.
In dieser Forschung fanden wir signifikante Unterschiede in den Parametern Intrapulsintervall, Interpulsintervall und Intrapulsfrequenz in den analysierten fasciola-Arten. Unter diesen Parametern war das Interpulsintervall das, das am meisten variierte, mit wenig Überlappung und geringer intra-spezifischer Variation, was darauf hindeutet, dass dieses Parameter Teil eines Artenerkennungssystems sein könnte. Dieses hohe Maß an Differenzierung in den männlichen Geräuschen steht im Einklang mit dem allgemeinen Konsens, dass das Balzverhalten sich mehr unterscheiden kann als morphologische Merkmale oder andere Eigenschaften verwandter Arten. Es ist jedoch im Moment unmöglich zu wissen, in welche Richtung sich diese verschiedenen Arten von Geräuschen in der fasciola-Untergruppe entwickelt haben. Genetische Studien haben gezeigt, dass interspezifische Unterschiede in den Interpulsintervallen häufig auf additive und polygenetische Faktoren zurückzuführen sind. Diese Unterschiede können auch durch Anpassung an unterschiedliche Umgebungen in Abwesenheit von Genfluss erklärt werden. Es ist bekannt, dass es im Quartärzeitraum wechselnde Zyklen zwischen kalt-trocken und heiß-feucht gab. In einem kalt-trockenen Klimazyklus breitete sich die an die trockenen Bedingungen angepasste Vegetation aus, während sich der Wald zurückzog. Während des anschließenden heiß-feuchten Zyklus kehrte sich die Situation um (Ab’ Saber, 1977; Vanzolini, 1981). Es wird angenommen, dass die Fliegen diesen Prozessen der Waldverkleinerung und -ausdehnung folgten, was zu langen Perioden geografischer Isolation während der kalt-trockenen Zyklen und zu einigen Gebieten der Sympatrie während der heiß-feuchten Zyklen führen würde.
Obwohl das Intervall zwischen den Impulsen bei verschiedenen Arten der Gattung Drosophila stark variieren kann, wird dies im Allgemeinen nicht beobachtet, wenn Populationen derselben Art analysiert werden (Costa et al., 2000; Ritchie et al., 1994). Die drei analysierten Populationen von D. coroica wiesen signifikante Unterschiede nur im Intervall innerhalb der Impulse auf, ohne Unterschiede im Intervall zwischen den Impulsen und in der Impulsfrequenz. Es ist möglich, dass ein starker Selektionsdruck auf das Intervall zwischen den Impulsen und die Impulsfrequenz wirkt. Diese geringe Variabilität könnte auch auftreten, wenn geografisch getrennte Populationen aufgrund konstanten Genflusses genetisch homogen sind oder wenn ein gemeinsamer Vorfahr kürzlich diese Populationen kolonisiert hat. Die PI-Daten zeigen jedoch, dass dies nicht der Fall ist.
Es ist wenig über die genetischen Mechanismen bekannt, die an den Speziationsprozessen beteiligt sind, jedoch ist es zunächst notwendig, die Genetik und Evolution der Mechanismen zu verstehen, die den Genfluss behindern. Sterile und instabile Hybriden gelten als starke Barrieren für den Genfluss, aber diese Arten von postzygotischen Mechanismen können hohe Kosten in Form von Gameten und Energie verursachen. Daher können Unterschiede in den Balzgeräuschen ein wichtiges isolierendes Merkmal sein, da sie solche Verluste einschränken oder verhindern würden (Welbergen et al., 1992). Die Analyse dieser Signale, die für den Fortpflanzungserfolg wichtig sind, ist von erheblichem Interesse für die Evolutionsbiologie, und das Wissen über die Architektur der Geräusche könnte helfen, verschiedene Modelle der sexuellen Selektion und Speziation zu beweisen.
Autoren: Costa, C. T. A. und Sene, F. M.
Referenzen:
- Ab’ Saber, A. N., 1977, Räume, die durch die Ausbreitung der trockenen Klimazonen Südamerikas während der quartären Eiszeiten besetzt sind. Paleoclimas, 3: 1-19.
- Chang, H. C. & Miller, D. D., 1978, Balz- und Paarungstöne bei Arten der Drosophila affinis-Untergruppe. Evolution, 32: 540-550.
- Costa, C. T. A., Kuhn, G. C. S. & Sene, F. M., 2000, Geringe Variation des Balzlieds in süd- und südöstbrasilianischen Populationen von D. meridionalis (Diptera, Drosophilidae). Rev. Brasil. Biol., 60: 53-61.
- Cowling, D. E. & Burnet, B., 1981, Balzlieder und genetische Kontrolle der akustischen Eigenschaften bei Geschwisterarten der Drosophila melanogaster-Untergruppe. Anim. Behav., 29: 924-935.
- Diniz, N. M., 1998, Chromosomale Phylogenie von Arten der fasciola-Untergruppe der repleta-Gruppe des Gattungs Drosophila. Dissertation, Medizinische Fakultät von Ribeirão Preto der Universität São Paulo.
- Ewing, A. W. & Miyan, J. A., 1986, Sexuelle Selektion, sexuelle Isolation und die Evolution des Liedes in der Drosophila repleta-Gruppe von Arten. Anim. Behav., 34: 421-429.
- Hoikkala, A. & Lumme, H., 1987, Die genetische Grundlage der Evolution der männlichen Balzlaute der Drosophila virilis-Gruppe. Evolution, 41: 827-845.
- Hoikkala, A. & Kaneshiro, K. Y., 1993, Veränderung in der Signal-Antwort-Sequenz, die für die asymmetrische Isolation zwischen Drosophila planitibia und D. silvestris verantwortlich ist. Proc. Natn,. Acad. Sci., 90: 5813-5817.
- Hoikkala, A. & Isoherranen, E., 1997, Variation und Wiederholbarkeit der Merkmale des Balzlieds bei wild gefangenen und im Labor gezüchteten Drosophila montana und D. littoralis Männchen (Diptera-Drosophilidae). Journal of Insect Behavior, 10: 193-202.
- Hoikkala, A., Lakovaara, S. & Romppainen, E., 1982, Paarungsverhalten und männliche Balzlaute in der Drosophila virilis-Gruppe. In: Lakovaara, S. (Hrsg.), Fortschritte in Genetik, Entwicklung und Evolution von Drosophila. Plenum, New York.
- Hoikkala, A., Kenneth, Y. & Hoy, R. H., 1994, Balzlieder der bildflügeligen Drosophila planitibia-Untergruppenarten. Anim. Behav., 47: 1363-1374.
- Ikeda, H. & Maruo, O., 1982, Richtungsselektion für die Pulswiederholrate des Balzlauts und korrelierte Reaktionen, die in mehreren Merkmalen bei Drosophila mercatorum auftreten. Jnp. J. Genet., 57: 241-258.
- Konopka, R. J. & Benzer, S., 1971, Uhrmutanten von Drosophila melanogaster. Proc. Natl. Acad. Sci., 68: 2112-2116.
- Konopka, R. J., Kyriacou, C. P. & Hall, J. C., 1996, Mosaikanalyse im Drosophila-ZNS von circadianen Balzliedrhythmen, die durch eine Perioden-Uhrmutation beeinflusst werden. J. Neurogenet., 11: 117-140.
- Kuhn, G. C. S., Diniz, N. M., Alves, M. A. R. & Sene, F. M., 1995, Karyotypische Konstitution von Arten der fasciola-Untergruppe der repleta-Gruppe des Gattungs Drosophila. Rev. Bras. Gen., 18 supplement: 282.
- Kyriacou, C. P. & Hall, J. C., 1980, Circadiane Rhythmusmutationen in Drosophila melanogaster beeinflussen kurzfristige Schwankungen im Balzlied des Männchens. Proc. Natl. Acad. Sci., 77: 6729-6733.
- Manfrin, M. H., Prado, P. R. R. & SENE, F. M., 1997, Analyse der Klangkomponenten der sexuellen Balz von zwei Unterarten von Drosophila mercatorum (Diptera, Drosophilidae). Rev. Brasil. Biol., 57: 349-355.
- Neems, R. M., Dooher, K., Butlin, R. K. & Shorrocks, B., 1997, Unterschiede im Balzlied der Männchen unter den Arten der quinaria-Gruppe von Drosophila. Journal of Insect Behavior, 10: 237-246.
- Noor, M. A. & Aquadro, C. F., 1998, Balzlieder von Drosophila pseudoobscura und D. persimilis: Analyse der Variation. Anim. Behav., 56: 115-125.
- Ritchie, M. G. & Gleason, J. M., 1995, Schnelle Evolution des Musters des Balzgesangs bei Drosophila willistoni-Arten. J. Evol. Biol., 8: 463-479.
- Ritchie, M. G. & Kyriacou, C. P., 1996, Künstliche Selektion für ein Balzsignal in Drosophila melanogaster. Anim. Behav., 52: 603-611.
- Ritchie, M. G., Yate, V. H. & Kyriacou, C. P., 1994, Genetische Variabilität des Intervall zwischen den Pulsen des Balzgesangs unter einigen europäischen Populationen von Drosophila melanogaster. Heredity, 72: 459-464.
- Schilcher, F. V., 1976, Die Rolle akustischer Reize in der Balz von Drosophila melanogaster. Anim. Behav., 24: 18-26.
- Sene, F. M. & Manfrin, M. H., 1998, Eine Kammer zur Aufzeichnung des Balzgesangs in Drosophila. D. I. S., 81: 203-204.
- Shorey, H. H., 1962, Die Natur des Geräuschs, das von Drosophila melanogaster während der Balz erzeugt wird. Science, 137: 677-678.
- Tidon-Sklorz, R. & Sene, F. M., 1992, Vertikale und zeitliche Verteilung von Drosophila (Diptera, Drosophilidae) Arten in einem bewaldeten Gebiet im Bundesstaat São Paulo, Brasilien. Rev. Brasil. Biol., 52: 311-317.
- Tomaru, M. & Oguma, Y., 1994, Unterschiede im Balzlied bei den Arten des Drosophila auraria-Komplexes. Anim. Behav., 47: 133-140.
- Vanzolini, P. E., 1981, Ein quasi-historischer Ansatz zur Naturgeschichte der Differenzierung von Reptilien in tropischen geografischen Isolaten. Papeis Avulsos Zool., 34: 189.
- Vilela, C. R., 1983, Eine Revision der Drosophila repleta-Artengruppe (Diptera, Drosophilidae). Revta. Bras. Ent., 27: 1-114.
- Vilela, C. R., Pereira, M. A. Q. R. & Sene, F. M., 1983, Vorläufige Daten zur geografischen Verteilung von Drosophila-Arten innerhalb morphoklimatischer Domänen Brasiliens. II. Die repleta-Gruppe. Cienc. Cult., 35: 66-70.
- Wasserman, M., 1962, Zytologische Studien der repleta-Gruppe der Gattung Drosophila. VI. Die fasciola-Untergruppe. Univ. Texas Public., 6205: 119-134.
- Wasserman, M., 1982, Evolution der repleta-Gruppe. In: M. Ashburner, H. L. Carson & J. N. Thompson (Hrsg.), Die Genetik und Biologie von Drosophila, Bd. 3b. Academic Press, London, S. 61-139.
- Wasserman, M., 1992, Zytologische Evolution der Drosophila repleta-Artengruppe: VI. Die fasciola-Untergruppe. In: Studien in der Genetik II. Forschungsberichte über Drosophila-Genetik, Taxonomie und Evolution. CRC Press, Inc., M. R. der Universität von Texas, Austin.
- Welbergen, P., Van Duken, F. R., Scharloo, W. & Köhler, W., 1992, Die genetische Grundlage der sexuellen Isolation zwischen Drosophila melanogaster und D. simulans. Evolution, 46: 1385-1398.
- Wheeler, D. A., Fields, W. L. & Hall, J. C., 1988, Spektralanalyse der Drosophila-Balzlieder: D. melanogaster, D. simulans und ihre interspezifischen Hybriden. Behav. Genet., 18: 675-703.
