Polyetheretherketon in der Implantatprothetik: Eine Überblicksübersicht
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zweck: Durchführung eines Scoping-Reviews der verfügbaren Forschung zur Anwendung von Polyetheretherketon (PEEK) in der Implantat-Prothetik, Kartierung der verfügbaren Literatur, um mögliche Wissenslücken hervorzuheben und, wenn möglich, klinische Richtlinien zu extrahieren.
Materialien und Methoden: Die Literatur zu PEEK in der Implantat-Prothetik, die bis August 2018 veröffentlicht wurde, wurde durch eine Online-Suche in den Datenbanken MEDLINE (über PubMed), Science Direct, Embase (über Ovid) und Google Scholar identifiziert. Qualitative und quantitative Synthesen wurden für originale Forschungsstudien durchgeführt.
Ergebnisse: Die Anzahl der veröffentlichten originalen Forschungsstudien stellte sich als begrenzt heraus. PEEK wurde als Material in der Herstellung von implantatgetragenen festen Zahnprothesen (IFDP) Rahmen (43%), prothetischen Implantatabutments (35%), Implantatabutmentschrauben (15%) und Halteclips an Implantatschienen (7%) verwendet. Nur 38% der Studien waren klinische Studien, während 15% Beobachtungsstudien und 47% in vitro waren. Die identifizierten Studien erlaubten keine Schätzung der langfristigen Überlebens- oder Erfolgsraten für irgendeine der prothetischen Komponenten. Die Ergebnisse ermöglichten lediglich eine vorläufige kurzfristige Bewertung von PEEK IFDP-Rahmen, die ein zufriedenstellendes Überleben, aber alarmierende Erfolgsraten im ersten Jahr des Einsatzes aufwiesen.
Fazit: Angesichts der spärlichen Beweise für die Eignung von PEEK als implantat-prothetisches Material kann dessen Verwendung noch nicht befürwortet werden. Kliniker sollten die vorgeschlagenen Protokolle beachten, um die mechanische Leistung zu verbessern und die Häufigkeit von prothetischen Komplikationen zu verringern. Weitere hochwertige Forschung ist erforderlich, um ein besseres Verständnis der Eignung des Materials zu erlangen.
Kunststoffe haben heute ein breites Anwendungsspektrum, und es gibt viele verschiedene Kategorien von Polymeren. Hochleistungs-Polymere sind Kunststoffe, die strenge Anforderungen an Temperaturstabilität, chemische Beständigkeit und mechanische Eigenschaften erfüllen. Da ihre Formulierungen nach Bedarf verändert werden können, können diese Materialien so gestaltet werden, dass sie eine dieser Eigenschaften gegenüber den anderen begünstigen, um spezifische Ziele zu erreichen. Hochleistungs-Polymere finden in vielen verschiedenen Bereichen, wie Ingenieurwesen, Industrie und Medizin (z. B. medizinische Geräte), zahlreiche Anwendungen.
Polyetheretherketon (PEEK) ist ein polyaromatisches, halb-kristallines, thermoplastisches Polymer mit mechanischen Eigenschaften, die für biomedizinische Anwendungen vorteilhaft sind. Durch die Einbringung von Hydroxylapatit-Partikeln in eine PEEK-Matrix haben einige Autoren ein Verbundpolymer erhalten, das eine Zugfestigkeit von 49,0 bis 83,3 MPa aufwies, was den unteren Grenzen von kortikalem Knochen (50 bis 150 MPa) entspricht. Dank seines elastischen Verhaltens, das dem menschlichen Knochen ähnlich ist, wird PEEK häufig in der Wirbelsäulenchirurgie, der orthopädischen Chirurgie und der kraniofazialen Chirurgie als Knochen- und Knorpelersatz verwendet.
PEEK wurde zunächst in drei Formen von ungefüllten Versionen eingeführt: PEEK-LT1, PEEK-LT2 und PEEK-LT3. Anschließend wurden Füllstoffe wie Keramiken, Hydroxylapatit, Beta-Calciumphosphat und Kohlenstofffasern zur PEEK-Formel hinzugefügt, um seine Bioaktivität zu erhöhen und seine mechanischen Eigenschaften zu verbessern, was zu Materialien wie BioHPP (Bredent) führte. Viele gefüllte PEEK-Versionen werden jetzt zur Herstellung biomedizinischer Implantate verwendet. Aufgrund seiner vorteilhaften mechanischen Eigenschaften hat PEEK auch den Bereich der Zahnmedizin erreicht, wo es in mehreren Bereichen implementiert wurde. Durch die Kombination seiner Eigenschaften mit der fortschreitenden Verbreitung der CAD/CAM-Technologie können PEEK-Komponenten jetzt digital entworfen und dann 3D-gedruckt werden, um eine hohe Präzision zu erreichen, die den klinischen Anforderungen entspricht.
Eine Vielzahl von Rezensionen hat die Anwendungen von PEEK in der oralen Implantologie und zahngetragenen Prothetik diskutiert, zu denen Komponenten für zahngetragene festsitzende Zahnprothesen (FDPs), zahngetragene herausnehmbare Zahnprothesen (RDPs), bioaktive Nanokomposite und Zahnimplantate gehören.
PEEK wurde ursprünglich im Bereich der Implantatprothetik als Material für die Herstellung von Komponenten für interimistische Restaurationen wie Implantatabutments eingeführt, dank seiner Herstellbarkeit mit CAD/CAM, seines erschwinglichen Preises und seiner besseren mechanischen Eigenschaften im Vergleich zu gängigen Harzmaterialien. Es wurden jedoch keine Übersichtsartikel identifiziert, die sich ausschließlich auf die Rolle von PEEK in der Implantatprothetik konzentrieren. Mehrere Autoren haben berichtet, dass die Beweise bezüglich PEEK in der Zahnheilkunde in der Menge noch begrenzt sind; daher scheint eine Scoping-Überprüfung die geeignetste Art von Übersichtsartikel zu sein, um zu beurteilen, ob eine weitere systematische Überprüfung zur Anwendung dieses Polymers in der Implantatprothetik angezeigt wäre. Daher wurde die vorliegende Scoping-Überprüfung durchgeführt, um die in diesem Bereich durchgeführte Forschung systematisch zu erfassen und bestehende Wissenslücken bezüglich des Verhaltens von PEEK-Materialien bei der Anwendung als implantatprothetische Komponente zu identifizieren. Die folgende Forschungsfrage wurde formuliert: Was ist aus der Literatur über die Anwendung von PEEK in der Implantatprothetik bekannt?
Materialien und Methoden
Eine Literaturrecherche wurde in den folgenden Datenbanken durchgeführt: MEDLINE über PubMed, Science Direct und Google Scholar.
Die folgende Schlüsselwortsuche wurde angewendet: PEEK ODER polyetheretherketon ODER poly-ether-ether-keton ODER Hochleistungs-polymer ODER Hochleistungs-Polymer ODER BioHPP UND (Zahnmedizin ODER Implantat-Prothetik). Als Suchfilter wurden nur Artikel berücksichtigt, die bis zum 31. August 2018 veröffentlicht wurden. Darüber hinaus wurden auch die Referenzlisten und frühere Übersichtsartikel auf relevante Artikel überprüft. Bezüglich der Google Scholar-Datenbank wurden nur die ersten 300 Ergebnisse berücksichtigt, wie von Haddaway et al. vorgeschlagen. Es wurde kein Prüfprotokoll für diese Arbeit registriert.
Die PRISMA-Erweiterung für Scoping-Reviews (PRISMA-ScR) Checkliste wurde als Leitfaden für die korrekte Berichterstattung der für diese Art von Review erforderlichen Punkte befolgt. Eine erste Bewertung der Artikelberechtigung wurde durch das Screening von Titeln und Abstracts durchgeführt, gefolgt von einer Volltextanalyse. Die Titel und Abstracts der Suchergebnisse wurden zunächst von zwei Gutachtern (A.P. und G.P.) auf mögliche Aufnahme überprüft. Um auszuschließen, dass potenziell relevante Artikel ausgeschlossen werden, wurden Abstracts mit unklaren Ergebnissen in die Volltextanalyse einbezogen. Die Volltexte aller möglicherweise relevanten Studien wurden für eine unabhängige Bewertung durch die beiden Gutachter gemäß den angegebenen Einschlusskriterien beschafft.
Meinungsverschiedenheiten wurden einem unabhängigen Gutachter (M.G.) vorgelegt und durch Diskussionen gelöst.
Um in die vorläufige Bewertung aufgenommen zu werden, mussten die folgenden Kriterien vom Artikel erfüllt sein: Abstract vorhanden; bezogen auf PEEK in seinen ungefüllten und gefüllten Präsentationen; und bezogen auf die Zahnheilkunde.
Um in die qualitativen und quantitativen Synthesen aufgenommen zu werden, mussten die folgenden Kriterien erfüllt sein: Artikel, die die Anwendungen von PEEK in der Implantatprothetik diskutieren und Variablen registrieren, die mit dem relevanten prothetischen Bestandteil verbunden sind.
Es wurden keine Diskriminierungen hinsichtlich des Herstellungsprozesses des Materials, seiner Zusammensetzung, seiner Oberflächenmodifikation oder seiner Verblendungsverfahren vorgenommen. Nur Originalforschungsarbeiten und Fallberichte wurden für die qualitativen und quantitativen Analysen berücksichtigt. Historische und systematische Übersichten, Buchkapitel und Leserbriefe wurden von den Analysen ausgeschlossen; jedoch wurden sie, wenn sie als relevant erachtet wurden, zur Kontextualisierung des Hintergrunds des Materials verwendet.
Ein unabhängiger Autor führte die Datenerhebung durch, mit dem Ziel, Informationen über die Stichprobengröße, den Nachbeobachtungszeitraum, die Überlebensrate, die Erfolgsrate, die Bruchfestigkeit der Restauration, die Bruchfestigkeit der prothetischen Komponente und Komplikationen zu extrahieren. Eine deskriptive statistische Analyse wurde für die als geeignet erachteten Daten durchgeführt. Für human- und tierexperimentelle Studien, die die erforderlichen Informationen berichteten, wurden gewichtete arithmetische Mittel für Überlebens- und Erfolgsraten berechnet. Überleben wurde als das Vorhandensein der prothetischen Komponente im Mund zum Zeitpunkt der Beobachtung betrachtet. Erfolg wurde als Abwesenheit von Komplikationen zum Zeitpunkt der Beobachtung betrachtet. Falls Überlebens- und Erfolgsraten bezüglich derselben Anwendung des Materials aus mehreren Studien verfügbar waren, wurden die human- und tierexperimentellen Daten separat zusammengefasst. Die Übereinstimmung zwischen den Prüfern wurde unter Verwendung von κ-Statistiken berechnet.
Ergebnisse
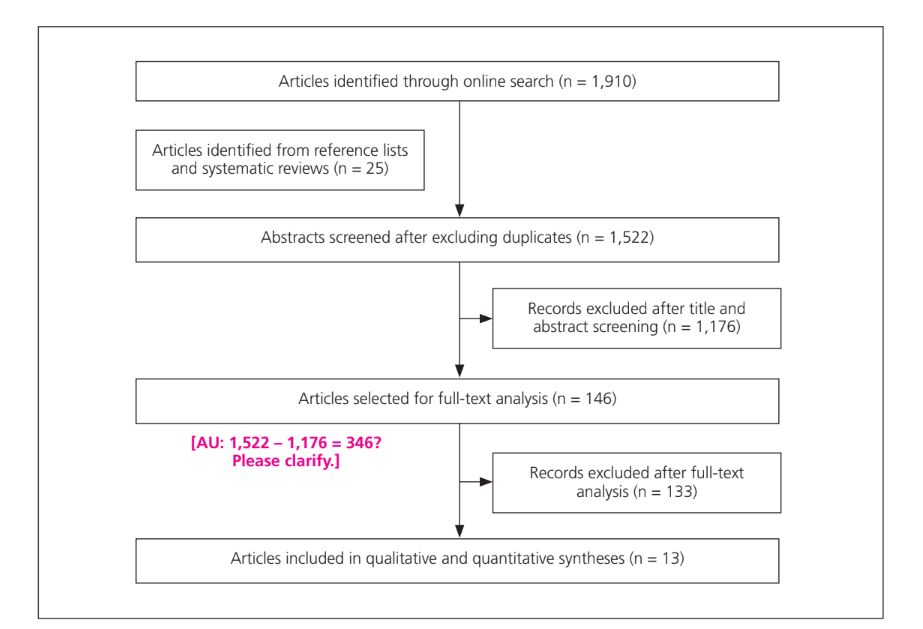
Insgesamt wurden 1.910 Artikel aus den drei durchsuchten Datenbanken (MEDLINE, Science Direct und Google Scholar) identifiziert (Abb. 1). Nach Überprüfung auf Duplikate wurden die Titel und Abstracts von 1.522 Artikeln gesichtet. Von diesen Artikeln wurden 146 für eine Volltextbewertung ausgewählt; davon wurden 13 nach einer Volltextprüfung in die qualitativen und quantitativen Zusammenfassungen aufgenommen (Tabelle 1). Während der Sichtung der Abstracts wurde ein κ-Wert von 0,91 für die Übereinstimmung zwischen den Prüfern berechnet, und während der Volltextanalyse wurde ein κ-Wert von 0,83 beobachtet. Meinungsverschiedenheiten wurden durch Diskussionen zwischen den Gutachtern gelöst. Verschiedene Studiendesigns wurden identifiziert. In vivo klinische Studien machten 38 % (5 Studien) des Gesamtanteils aus, aber nur 2 hatten ein kontrolliertes Design, und nur 1 war randomisiert. In vivo Beobachtungsstudien machten 15 % (2 Studien) des Gesamtanteils aus, während die in vitro Forschung 47 % (6 Studien) des Gesamtanteils ausmachte.
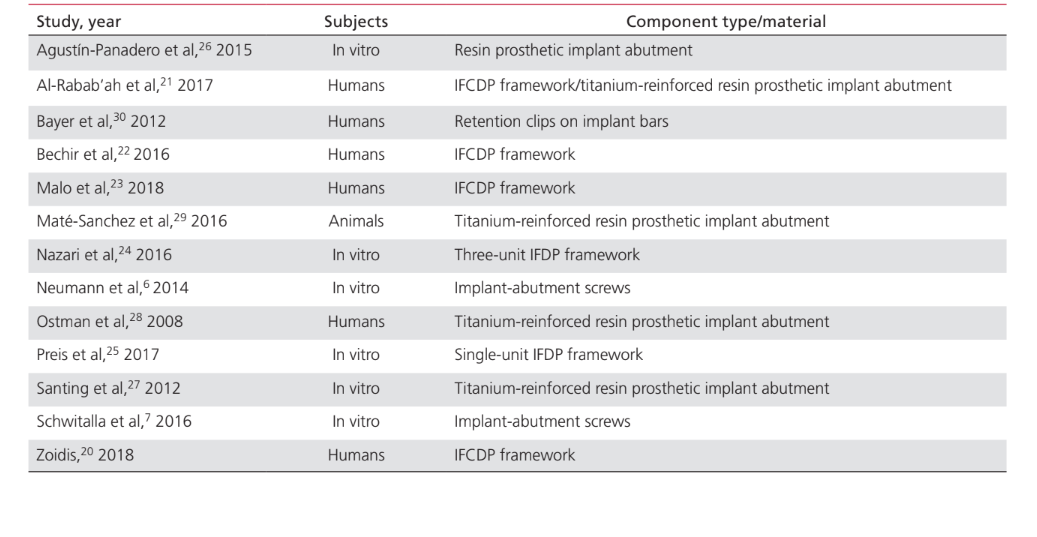
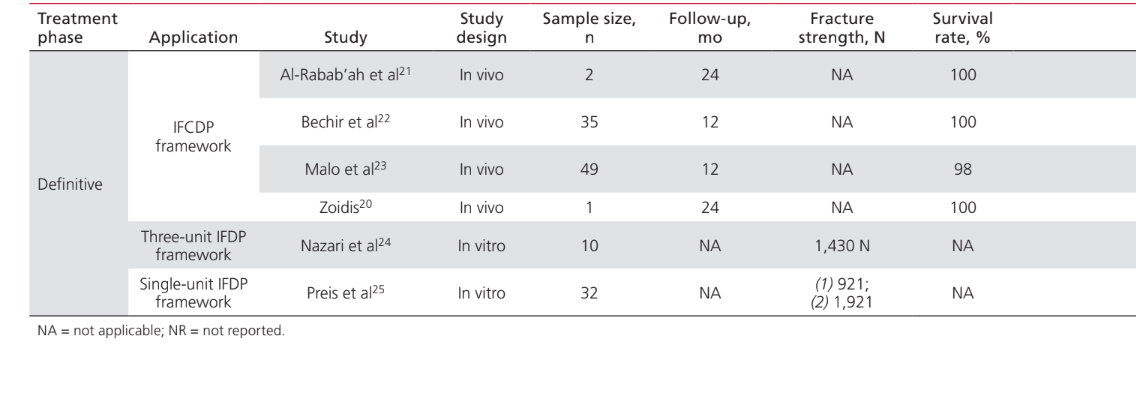
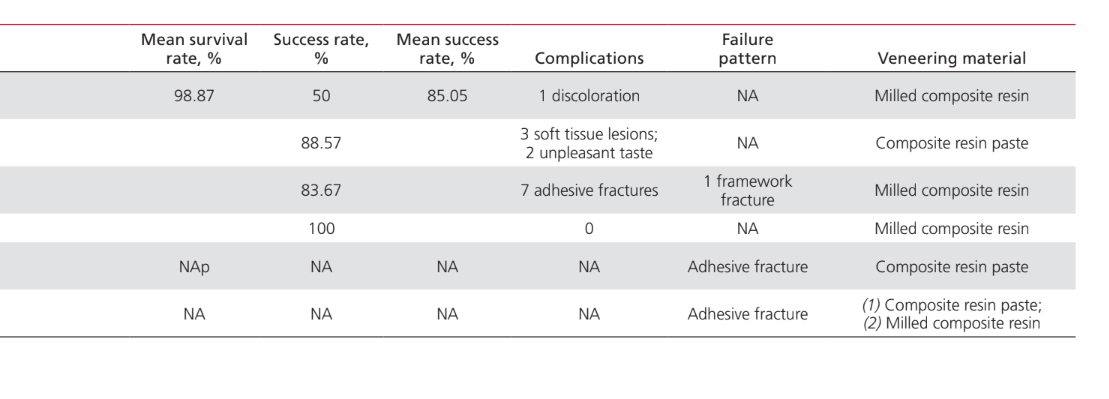
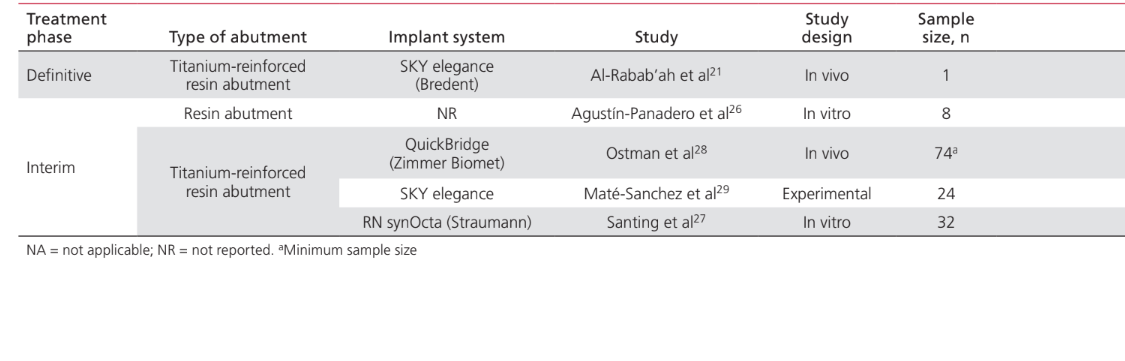
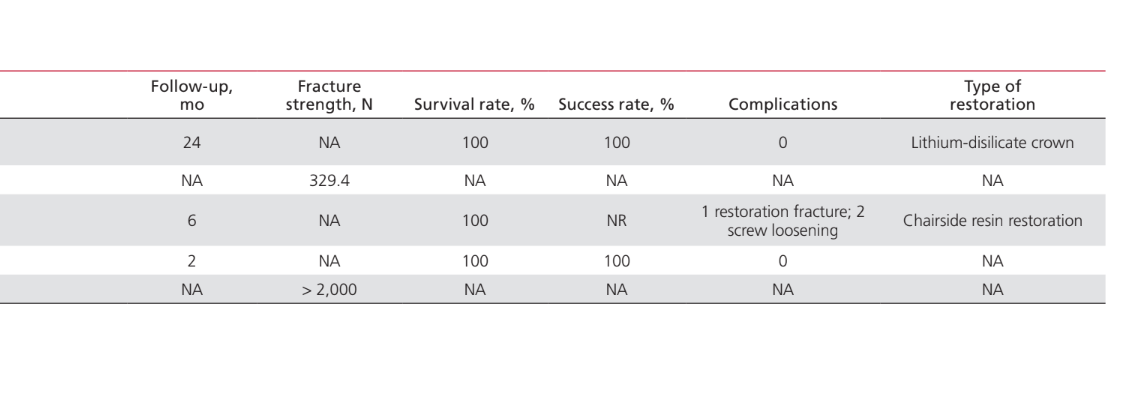
Die Anwendungen von PEEK als Material für die Herstellung von Komponenten, die an implantat-prothetischen Rehabilitationverfahren beteiligt sind, waren: IFDP-Rahmen (43%); prothetische Implantat-Abutments (35%); Implantat-Abutment-Schrauben (15%); und Halteclips zur Befestigung von Zahnprothesen an Implantatstangen (7%). Studien zur Anwendung von PEEK als Material für die Herstellung von Implantat-Heil-Abutments wurden in diesem Papier nicht berücksichtigt, da sie als enger mit dem chirurgischen als dem prothetischen Aspekt der Behandlung verbunden angesehen wurden. Tabelle 2 listet die Studien auf, die PEEK als Rahmenmaterial für IFDPs betreffen. Es wurden keine in vivo-Studien mit einer Kontrollgruppe gefunden; nur 2 Fallserien. Zwei unkontrollierte klinische Studien und 2 in vitro-Studien wurden identifiziert. Die identifizierten prothetischen Design-Einheiten waren implantatgestützte festsitzende vollständige Zahnprothesen (IFCDP); drei-Einheiten-IFDPs; und Einzel-Einheiten-IFDPs. Einzel-Einheiten- und drei-Einheiten-IFDPs, die posterior lokalisiert waren, lieferten Informationen nur über die Bruchfestigkeit, während keine Informationen über die Bruchfestigkeit für anterior gelegene Elemente oder für IFCDPs aufgezeichnet wurden. Bei partiellen IFDPs wurde festgestellt, dass das Versagensmuster in allen getesteten Proben für die Bruchfestigkeit auf einem adhäsiven Bruch zwischen dem Rahmen und den Verblendmaterialien beruhte. Von den vier in vivo-Studien, die Informationen über IFCDPs berichteten, wurden 87 Prothesen identifiziert. Die gewichteten arithmetischen Mittel zeigten, dass IFCDPs in den ersten 12 Monaten nach der prothetischen Rehabilitation eine durchschnittliche Überlebensrate von 98,87% und eine durchschnittliche Erfolgsquote von 85,05% hatten. Eine Inzidenzrate von 16% wurde für das Auftreten von Komplikationen in den ersten 12 Monaten festgestellt. Von diesen Komplikationen waren 64,28% mechanischer Natur, während 35,72% biologisch waren. Unter den mechanischen Komplikationen betrafen 77,8% adhäsive Brüche zwischen dem Rahmen und den Verblendmaterialien, 11,1% betrafen Brüche des Rahmenmaterials, und 11,1% waren Berichte über Verfärbungen der Prothese. Zu den biologischen Komplikationen gehörten das Auftreten von Weichgewebeläsionen und unangenehmer Geschmack. Tabelle 3 listet die Studien auf, die PEEK-Anwendungen als Material für prothetische Implantat-Abutments diskutieren. Ein Fallbericht wurde für die Anwendung von PEEK als definitives prothetisches Implantat-Abutment identifiziert, während zwei in vitro-Studien und zwei klinische Studien für PEEK-interim prothetische Implantat-Abutments identifiziert wurden. Die Verwendung von PEEK in einem definitiven, titanverstärkten Harzprothetischen Implantat-Abutment hatte nur einen Fallbericht, der eine Überlebens- und Erfolgsquote von 100% über 24 Monate zeigte. Eine in vivo kontrollierte Tierstudie, die 24 Probanden umfasste, berichtete über eine Überlebensrate von 100% über einen Zeitraum von 2 Monaten, in dem PEEK in einem interim titanverstärkten Harzprothetischen Implantat-Abutment verwendet wurde. Studien, die PEEK als Material für die Herstellung von Implantat-Abutment-Schrauben und runden Clips zur Prothesenretention über Implantatstangen betreffen, sind in Tabelle 4 aufgeführt. Es wurden nur zwei in vitro-Studien gefunden, die PEEK als Material für Implantat-Abutment-Schrauben betreffen. Die Verwendung von PEEK für Halteclips zur Befestigung der Prothese an runden Implantatstangen wurde nur in einer randomisierten klinischen Studie diskutiert, die eine Erfolgs- und Überlebensrate von 100% über die ersten 6 Monate zeigte.
Diskussion
Die Einschränkungen dieser Überprüfung umfassen die für die analysierten Datenbanken ausgewählte Suchstrategie, die absichtlich allgemeiner gestaltet wurde, da eines der Ziele darin bestand, alle möglichen Anwendungen des Materials im Interessensgebiet zu identifizieren. Aus demselben Grund kann eine weitere Einschränkung in Bezug auf die Reproduzierbarkeit der Online-Suche die Einbeziehung von Google Scholar unter den analysierten Datenbanken sein. Seine Suchalgorithmen führen oft zu einer Vielzahl von Ergebnissen; jedoch machte dies möglich, die in den anderen in dieser Überprüfung durchsuchten Datenbanken nicht indizierte Literatur abzubilden.
Nach den gewonnenen Erkenntnissen können die Anwendungen von PEEK in der Implantatprothetik wie folgt zusammengefasst werden.
IFDP-Material
Die Rolle von PEEK als IFDP-Komponente wurde am häufigsten berichtet. Alle Studien, die PEEK als definitives IFDP-Material diskutierten, verwendeten das Polymer zur Herstellung von Gerüsten, die anschließend mit Harzmaterialien verblendet wurden.
Die Bruchfestigkeit von PEEK-IFDPs wurde als geringer im Vergleich zu Nickel-Chrom und Zirkonia beschrieben, jedoch klinisch akzeptabel. Es sollte jedoch erwähnt werden, dass die in dieser Übersicht enthaltenen Informationen aus den in vitro-Studien sich auf statische Ermüdungslasten beziehen und keine Informationen über ihre Leistung unter zyklischen Ermüdungsbelastungen bereitgestellt wurden, was ein relevanterer Indikator für das Verhalten von oralen Rehabilitationen ist. Das Fertigungsdesign und die Art der Harzverblendung beeinflussten ebenfalls die Bruchfestigkeit, wobei zementierte Restaurationen gegenüber schraubengehaltenen bevorzugt wurden und die Verblendung mit gefrästem Verbundharz über Verbundpaste.
Daher wird in Situationen, in denen die Wahl zwischen schraubengehaltenen oder zementierten Designs gleichermaßen angezeigt ist, angenommen, dass zementierte Restaurationen eine bessere mechanische Leistung bieten, und hinsichtlich der Wahl des Verblendverfahrens und -materials sollte gefräster Verbundwerkstoff bevorzugt werden. Verschiedene Fertigungsverfahren haben ebenfalls gezeigt, dass sie die mechanischen Eigenschaften der Prothese beeinflussen. Restaurationen, die mit CAD/CAM-gefrästem PEEK hergestellt wurden, scheinen widerstandsfähiger gegen Brüche zu sein als Elemente, die mit anderen Fertigungsmethoden hergestellt wurden.
PEEK IFCDPs haben sich als äußerst erfolgreiche Behandlung für Patienten mit Edentulismus erwiesen. PEEK IFCDPs könnten einen angemessenen Kompromiss zwischen der Erschwinglichkeit und der Reparaturfreundlichkeit von Metall-Acryl IFDPs und der besseren mechanischen Leistung von Zirkonia- und Metall-Porzellan IFCDPs bieten.
Trotz der begrenzten Anzahl an berichteten Fällen scheinen PEEK IFCDPs basierend auf den in diesem Review diskutierten Ergebnissen zufriedenstellende Überlebensraten (98,87%) nach 12 Monaten zu haben. Neben der Tatsache, dass diese Aussage nur auf vier Studien basiert, sollte auch angemerkt werden, dass alle einbezogenen Studien kurze Nachbeobachtungszeiträume aufweisen; die Ergebnisse sind jedoch mit denen von Metall-Acryl-, Metall-Porzellan- und Zirkonia IFCDPs vergleichbar. Andererseits zeigten die Erfolgsraten für PEEK IFCDPs alarmierendere Daten, da eine Inzidenzrate von 16% für das Auftreten von Komplikationen nach 12 Monaten beobachtet wurde. Mit Harz verblendete polymethylmethacrylat (PMMA) und keramikverblendete Zirkonia IFCDPs wurden mit jährlichen Komplikationsraten von 6,6% und einer Überlebensrate von 90,6%, frei von Komplikationen, nach 12 Monaten berichtet. Diese Zahlen deuten darauf hin, dass PEEK IFCDPs ein höheres Risiko aufweisen. Die hier berichtete Inzidenz von Komplikationen sollte jedoch unter Berücksichtigung bestimmter Einschränkungen interpretiert werden – nämlich, dass nur 87 PEEK IFCDPs identifiziert wurden, mit einer Nachbeobachtung von 12 Monaten für 84 Prothesen und von 24 Monaten für 3 Prothesen. Neben der begrenzten Anzahl an Fällen bietet der Nachbeobachtungszeitraum von 12 Monaten eine begrenzte klinische Bedeutung im Falle von definitiven Prothesen.
Biologische Komplikationen, die sich in unangenehmen Geschmäckern und Weichgewebeläsionen äußerten, machten 35,72 % der insgesamt beobachteten Fälle aus. Es sollte jedoch angemerkt werden, dass die Autoren der Studie, die über Geschmacksveränderungen berichteten, feststellten, dass einige der Patienten zum Zeitpunkt der Bewertung auch an systemischen Erkrankungen litten, was eine weitere Verzerrung der Inzidenzrate für Komplikationen hinzufügt. PEEK wurde zuvor als bioinertes Material bezeichnet; jedoch beobachteten Trindade et al. kürzlich, dass dieses Material während des Prozesses der Osseointegration eine höhere Immunaktivierung im Vergleich zu Titan auslöst. Die Autoren schlugen vor, dass das Wissen über die chemische Inertheit des Materials höchstwahrscheinlich auf In-vitro-Studien basierte, da Informationen über die Rolle des Immunsystems bei der Herunterregulierung des Entzündungsprozesses während der PEEK-Wirt-Interaktion nicht verfügbar waren. Es ist noch unklar, ob die in dieser Übersicht beobachteten Weichgewebeläsionen mit der Interaktion von PEEK mit den Wirtsgeweben oder mit Störfaktoren aus den Designs der einbezogenen Studien in Zusammenhang stehen; jedoch könnte dies angesichts der oben genannten Ergebnisse einer weiteren Untersuchung wert sein.
Bezüglich mechanischer Ausfälle bestanden 77,8% aus adhäsiven Brüchen zwischen dem Gerüst und den Verblendmaterialien. Die Ausfallmuster bei Einzel- und Mehr-Einheiten-IFDPs bestanden ebenfalls hauptsächlich aus adhäsiven Brüchen zwischen dem Gerüst und dem Verblendmaterial, was die Beobachtungen für IFCDPs bestätigt. Dies sollte auf eine zufriedenstellende Widerstandsfähigkeit des Gerüsts hinweisen, obwohl bis heute keine dauerhafte und vorhersehbare Bindungsstrategie zwischen einem PEEK-Gerüst und einer Verbundverblendung gefunden wurde. Zukünftige Untersuchungen sollten sich darauf konzentrieren, das richtige Gleichgewicht zwischen der Ergänzung der PEEK-Formel mit Füllstoffen und der Wahl des richtigen Oberflächenbehandlungsprotokolls sowie des Verblendverfahrens zu finden, um eine optimale mechanische Leistung zu erzielen.
Implantat-Abutment-Material
Mehrere in vitro und in vivo Studien berichteten über die Verwendung von prothetischen Implantat-Abutments, die ganz oder teilweise aus PEEK bestehen. Allerdings diskutierten nur fünf Studien abutmentbezogene Variablen, die für dieses Papier von Interesse waren.
In Bezug auf die mechanische Leistung wurden PEEK-Harzimplantat-Abutments als signifikant weniger bruchfest im Vergleich zu Titan-Abutments beschrieben. Ihre höhere Stoßdämpfungsfähigkeit wirkt sich nicht negativ auf die Spannungsverteilung im Implantat oder im peripheren Knochen aus, wenn man sie mit anderen Restaurations- und Abutmentmaterialien vergleicht. Dennoch zeigten diese Abutments eine höhere Spannungs Konzentration in den Restauration-Kronen, was besonders relevant ist im Fall von zentralen Schneidezähnen, wo die Restauration dünner ist, was darauf hindeutet, dass PEEK-Harzimplantat-Abutments spezifische Vorsichtsmaßnahmen in Bezug auf das Design einer Kronenrestauration erfordern könnten.
PEEK-titanverstärkte Harzimplantat-Abutments wurden in Fällen von sofortiger Belastung von mehreren Autoren verwendet. Diese Systeme bestehen aus einem Titan-Kern und einer darüber liegenden PEEK-Hülse, die je nach Design des Elements abnehmbar oder nicht abnehmbar sein kann. Neuerdings wurde ein Abutment, das aus einem Titan-Kern mit einer keramikverstärkten PEEK-Hülse besteht, auf den Markt eingeführt. Auch wenn es nur durch eine Tierstudie unterstützt wird, scheint die Evidenz darauf hinzudeuten, dass dieses Abutment in Bezug auf die Anpassung an Weichgewebe überlegen ist im Vergleich zu Titan. Dieses Abutment ist auch geeignet für das Konzept „ein Abutment – einmal“, was bedeutet, dass titanverstärkte PEEK-Abutments sowohl als provisorische als auch als definitive Abutments verwendet werden könnten.
Eine In-vitro-Studie von Santing et al. berichtete, dass Verbundharzkrone, die von titanverstärkten PEEK-Abutments unterstützt werden, in der Lage sind, statische Lasten von bis zu 2.000 N zu tragen.
Zu den Einschränkungen dieses Papiers gehörte die Unmöglichkeit, Erfolgs- und Überlebensraten für PEEK-prothetische Implantat-Abutments zu schätzen, aufgrund der geringen Menge an in vivo Informationen und der Heterogenität der identifizierten Systeme. Es kann jedoch aus den Ergebnissen geschlossen werden, dass titanverstärkte PEEK-Implantat-Abutments überlegene Ergebnisse in Bezug auf die mechanische Widerstandsfähigkeit bieten könnten, wenn sie entweder als interimistisches oder als definitives Abutment angewendet werden. Daher wird die Verwendung eines Titan-Kerns der reinen Harzversion des Bauteils vorgezogen. Die Dicke und der Herstellungsprozess der interimistischen Restauration könnten für das Behandlungsergebnis mit PEEK-Abutments bedeutender sein als für Titan-Abutments. Zukünftige Forschungen sollten sich auf die mechanische Widerstandsfähigkeit von titanverstärkten PEEK-Abutments sowie auf langfristige in vivo-Ergebnisse konzentrieren.
Implantat-Abutment-Schrauben
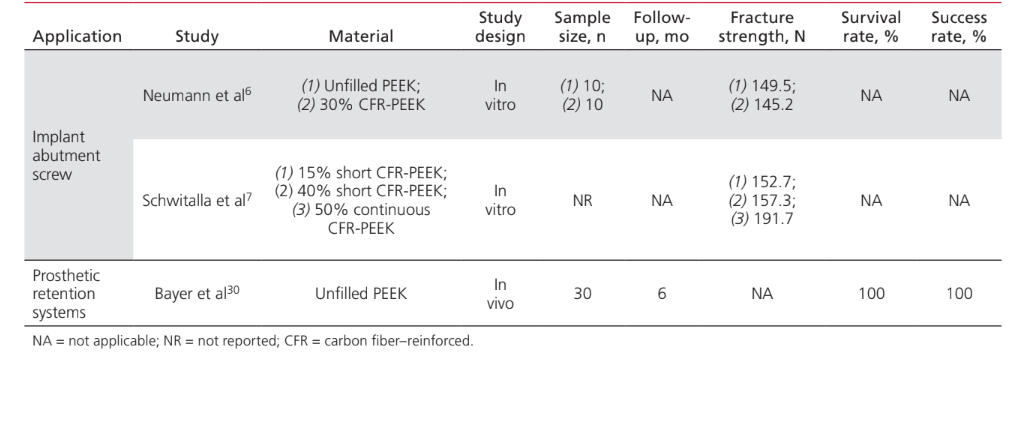
Die proportionalen Vorteile von PEEK-Abutment-Schrauben hängen mit ihren Stoßdämpfungseigenschaften sowie ihrer einfacheren Entfernung im Falle eines Bruchs aufgrund ihrer niedrigeren Reibungskoeffizienten zusammen. Bei Tests zur Bruchfestigkeit im Vergleich zu Titan erwiesen sich PEEK-Schrauben als 5-mal weniger widerstandsfähig, und es wurden keine Unterschiede zwischen den ungefüllten und mit Kohlenstofffasern gefüllten Versionen des Materials festgestellt. Allerdings wurde von den Autoren keine Beschreibung des Kohlenstofffaser-Designs bereitgestellt. In einer neueren Studie berichteten Schwitalla et al., dass PEEK-Schrauben, die mit kurzen Kohlenstofffasern (mit einem Anteil von bis zu 40%) gefüllt sind, ein ähnliches mechanisches Verhalten zeigten wie von Neumann et al. berichtet, und beobachteten auch einen Anstieg der Zugfestigkeit um 20%, wenn das PEEK mit einer kontinuierlichen Kohlenstofffaserzusammensetzung von mindestens 50% gefüllt war.
Es wurde nachgewiesen, dass die Zugabe von PMMA-Zement die mechanische Widerstandsfähigkeit von mit Kohlenstofffasern verstärkten PEEK-Schrauben verbessert.
Das Design der Verbindung zwischen dem Implantat und der Restauration ist ein weiterer Faktor, der die mechanische Leistung der Abutmentschraube beeinflussen könnte. Da PEEK-Abutmentschrauben eine höhere Neigung zur plastischen Verformung als Titan aufweisen, sollten die Beziehungen zwischen verschiedenen Implantatverbindungen und Schraubendesigns weiter untersucht werden.
Die bevorstehende Herausforderung für PEEK-Abutmentschrauben wird darin bestehen, das richtige Gleichgewicht in der Füllstoffzusammensetzung hinsichtlich Menge und Struktur, dem Abutmentmaterial und dem Design der Implantatverbindung zu finden. Bis heute fehlt es an wissenschaftlichen Beweisen, die die Konsistenz aufweisen, die erforderlich ist, um sie für den klinischen Einsatz zu empfehlen.
Prothetische Retentionssysteme
Kunststoff-Retentionsclips wurden in mehreren Szenarien untersucht, um ihre Retention von zahngetragenen RDPs zu analysieren. Sie wurden als weniger retentiv beschrieben als gängige Materialien wie Kobalt-Chrom, sind jedoch immer noch ausreichend retentiv, um ihren klinischen Zweck zu erfüllen. PEEK-Harzclips haben sich als potenziell zuverlässig als Retentionsverschluss zur Verankerung zahngetragener RDPs mit einer Lebensdauer von 10 Jahren erwiesen; es scheint jedoch notwendig zu sein, ihren Durchmesser auf das Doppelte der Metallverschlüsse zu erhöhen, um eine ausreichende langfristige Retention zu erzielen. In Fällen von implantatgetragenen Prothesen gibt es begrenzte Beweise für die Verwendung von PEEK für Retentionsclips. Bayer et al. berichteten in einer randomisierten klinischen Studie am Menschen, dass PEEK-Clips, die als Retentionsvorrichtungen über runden Implantatstangen angewendet wurden, eine ausreichende Retentionskraft aufwiesen, mit einem klinisch akzeptablen Retentionsverlust von 20 % nach 6 Monaten.
Ein neuerer Hochleistungs-Polymer namens Polyetherketonketon (PEKK) soll im Vergleich zu anderen Mitgliedern der Familie der Polyaryletherketone (PAEKs) vielversprechende mechanische Eigenschaften bieten. Seine günstigen mechanischen Eigenschaften ergeben sich aus einer höheren Druckfestigkeit, einem elastischen Modul, der dem menschlichen Knochen ähnlich ist, und einer höheren Polierfähigkeit. In Bezug auf die bakterielle Haftung hat PEKK ebenfalls vergleichbare Ergebnisse im Vergleich zu konventionellem PEEK gezeigt. PEKK ist derzeit für die Herstellung von Retentionsvorrichtungen für implantatgestützte Suprakonstruktionen angezeigt. Weitere Untersuchungen sind erforderlich, um ein besseres Verständnis der Biokompatibilität und der Machbarkeit dieses Materials für implantatprothetische Behandlungen zu gewinnen.
Weitere Forschungen sind auch notwendig, um durchmesser- und formbezogene Spezifikationen für verschiedene Designs von Implantatstangen zu klären, sowie deren langfristige Retentionsfähigkeit, da diese Parameter bis heute noch unbekannt sind.
Fazit
Obwohl PEEK für die Herstellung mehrerer Komponenten, die an der implantatprothetischen Rehabilitation beteiligt sind, verwendet wird, ist die verfügbare wissenschaftliche Evidenz in Menge und Qualität begrenzt. Der Mangel an Evidenz bedeutet, dass eine systematische Überprüfung nicht angemessen oder notwendig ist, sondern fordert weitere, besser gestaltete klinische Forschung. Die Verwendung von PEEK in der implantatprothetischen Versorgung sollte noch nicht befürwortet werden; jedoch sollten Kliniker, wenn sie es verwenden, die empfohlenen Protokolle bezüglich dieser Wahl des prothetischen Bauteils sowie des Herstellungsverfahrens und des Verblendmaterials oder der überlagernden Restauration beachten, wobei zu berücksichtigen ist, dass die langfristigen Ergebnisse noch ungewiss sind.
Autoren: Andrea Paratelli, Giammarco Perrone, Rocío Ortega, Miguel Gómez-Polo
Referenzen
- Kurtz SM, Devine JN. PEEK-Biomaterialien in Trauma-, Orthopädie- und Wirbelsäulenimplantaten. Biomaterials 2007;28:4845–4869.
- Panayotov IV, Orti V, Cuisinier F, Yachouh J. Polyetheretherketon (PEEK) für medizinische Anwendungen. J Mater Sci Mater Med 2016;27:118.
- Abu Bakar K, Cheang P, Khor K. Mechanische Eigenschaften von spritzgegossenen Hydroxylapatit-Polyetheretherketon-Biokompositen. Composites Sci Technol 2003;65:421-425.
- Almasi D, Iqbal N, Sadeghi M, Sudin I, Abdul Kadir MR, Kamarul T. Herstellungsmethoden zur Verbesserung der Bioaktivität von PEEK für orthopädische und zahnmedizinische Anwendungen: Eine Übersicht. Int J Biomater 2016;2016:8202653.
- Suess O, Schomaker M, Cabraja M, Danne M, Kombos T, Hanna M. Leere Polyetheretherketon (PEEK)-Käfige bei anteriorer zervikaler Diskektomie und Fusion (ACDF) zeigen langsame radiografische Fusion, die die klinische Verbesserung verringert: Ergebnisse aus der prospektiven multizentrischen „PIERCE-PEEK“-Studie. Patient Saf Surg 2017;11:12.
- Neumann EAF, Villar CC, França FM. Bruchfestigkeit von Abutmentschrauben aus Titan, Polyetheretherketon und kohlenstofffaserverstärktem Polyetheretherketon. Braz Oral Res 2014;28:S1806-83242014000100239.
- Schwitalla AD, Abou-Emara M, Zimmermann T, et al. Die Anwendbarkeit von PEEK-basierten Abutmentschrauben. J Mech Behav Biomed Mater 2016;63:244–251.
- Wiesli MG, Özcan M. Hochleistungs-Polymere und ihre potenzielle Anwendung als medizinische und orale Implantatmaterialien: Eine Übersicht. Implant Dent 2015;24:448–457.
- Skirbutis D, Dzinguté A, Masiliénaité V, Sulcaite G, Žilinskas J. Eine Übersicht über die Eigenschaften des PEEK-Polymers und seine Verwendung in der Prothetik. Stomatologija 2017;19:19–23.
- Najeeb S, Zafar MS, Khurshid Z, Siddiqui F. Anwendungen von Polyetheretherketon (PEEK) in der oralen Implantologie und Prothetik. J Prosthodont Res 2016;60:12–19.
- Najeeb S, Bds ZK, Bds SZ, Bds MS. Bioaktivität und Osseointegration von PEEK sind schlechter als die von Titan: Eine systematische Übersicht. J Oral Implantol 2016;42:512–516.
- Manolea HO, Ob dan F, Popescu SM, Rîcé R, Méréescu P, Iliescu AA, et al. Aktuelle Optionen zur Herstellung von implantatgestützten prothetischen Restaurationen zur Minderung der Auswirkungen von okklusalen Kräften. Defect and Diffusion Forum 2017;376:66–77.
- Georgiev J, Vlahova A, Kissov H, Aleksandrov S, Kazakova R. Mögliche Anwendung von BioHPP in der prothetischen Zahnheilkunde: Eine Literaturübersicht. J IMAB 2018;24:1896–1898.
- Schwitalla A, Müller WD. PEEK-Zahnimplantate: Eine Übersicht über die Literatur. J Oral Implantol 2013;39:743–749.
- Schwitalla AD, Spintig T, Kallage I, Müller WD. Druckverhalten verschiedener PEEK-Materialien für Zahnimplantate. J Mech Behav Biomed Mater 2016;54:295–304.
- Zoidis P, Papathanasiou I. Modifizierte PEEK-Harz-gebundene feste Zahnprothese als interimistische Restauration nach Implantatplatzierung. J Prosthet Dent 2016;116:637–641.
- Haddaway NR, Collins AM, Coughlin D, Kirk S. Die Rolle von Google Scholar in Evidenzübersichten und ihre Anwendbarkeit für die Suche nach grauer Literatur. PLoS One 2015;10:e0138237.
- Tricco AC, Lillie E, Zarin W, et al. PRISMA-Erweiterung für Scoping-Reviews (PRISMA-ScR): Checkliste und Erklärung. Ann Intern Med 2018;169:467–473.
- Pjetursson BE, Brägger U, Lang NP, Zwahlen M. Vergleich der Überlebens- und Komplikationsraten für zahnunterstützte feste Zahnprothesen (FDPs) und implantatgestützte FDPs und Einzelkronen (SCs). Clin Oral Implant Res 2007;18(suppl 3):97–113.
- Zoidis P. Der All-on-4 modifizierte Polyetheretherketon-Behandlungsansatz: Ein klinischer Bericht. J Prosthet Dent 2018;119:516–521.
- Al-Rabab’ah M, Hamadneh W, Alsalem I, Khraisat A, Abu Karaky A. Verwendung von Hochleistungs-Polymeren als Zahnimplantat-Abutments und -Rahmen: Ein Fallbericht. J Prosthodont 2019;28:365–372.
- Bechir ES, Bechir A, Gioga C, Manu R, Burcea A, Dascalu IT. Die Vorteile des BioHPP-Polymers als Überstrukturmaterial in der oralen Implantologie. Mater Plast 2016;53:394–398.
- Malo P, de Araújo Nobre M, Moura Guedes C, et al. Kurzzeitbericht einer laufenden prospektiven Kohortenstudie zur Bewertung der Ergebnisse von vollarchigen implantatgestützten festen hybriden Polyetheretherketon-acrylharz-Prothesen und dem All-on-Four-Konzept. Clin Implant Dent Relat Res 2018;20:692–702.
- Nazari V, Ghodsi S, Alikhasi M, Sahebi M, Shamshiri AR. Bruchfestigkeit von dreigliedrigen implantatgestützten festen Teilprothesen mit übermäßiger Kronenhöhe, die aus verschiedenen Materialien gefertigt sind. J Dent (Tehran) 2016;13:400–406.
- Preis V, Hahnel S, Behr M, Bein L, Rosentritt M. In-vitro Ermüdungs- und Bruchprüfung von CAD/CAM-Materialien in implantatgestützten Molarkronen. Dent Mater 2017;33:427–433.
- Agustín-Panadero R, Serra-Pastor B, Roig-Vanaclocha A, Román-Rodriguez JL, Fons-Font A. Mechanisches Verhalten von provisorischen implantatprothetischen Abutments. Med Oral Patol Oral Cir Bucal 2015;20:e94–e102.
- Santing HJ, Meijer HJ, Raghoebar GM, Özcan M. Bruchfestigkeit und Versagensmodus von maxillaren implantatgestützten provisorischen Einzelkronen: Ein Vergleich von Kompositharzkronen, die direkt über PEEK-Abutments und massiven Titan-Abutments gefertigt wurden. Clin Implant Dent Relat Res 2012;14:882–889.
- Ostman PO, Hellman M, Sennerby L, Wennerberg A. Temporäre implantatgestützte Prothese für sofortige Belastung gemäß einem Stuhl-Seiten-Konzept: Technische Anmerkung und Ergebnisse aus 37 aufeinanderfolgenden Fällen. Clin Implant Dent Relat Res 2008;10:71–77.
- Maté Sánchez de Val JE, Gómez-Moreno G, Pérez-Albacete Martínez C, et al. Verhalten des peri-implantären Gewebes um nicht-titanhaltige Materialien: Experimentelle Studie an Hunden. Ann Anat 2016;206:104–109.
- Bayer S, Komor N, Kramer A, Albrecht D, Mericske-Stern R, Enkling N. Haltekraft von Kunststoffklammern auf Implantatstangen: Eine randomisierte kontrollierte Studie. Clin Oral Implants Res 2012;23:1377–1384.
- Taufall S, Eichberger M, Schmidlin PR, Stawarczyk B. Bruchlast und Versagensarten verschiedener verglaster polyetheretherketon-fester Zahnprothesen. Clin Oral Investig 2016;20:2493–2500.
- Stawarczyk B, Eichberger M, Uhrenbacher J, Wimmer T, Edelhoff D, Schmidlin PR. Dreigliedrige verstärkte Polyetheretherketon-Verbund-FDPs: Einfluss der Herstellungsart auf die Tragfähigkeit und Versagensarten. Dent Mater J 2015;34:7–12.
- Papaspyridakos P, Mokti M, Chen CJ, Benic GI, Gallucci GO, Chronopoulos V. Implantat- und prothetische Überlebensraten mit implantatgestützten vollständigen Zahnprothesen im zahnlosen Unterkiefer nach mindestens 5 Jahren: Eine systematische Übersicht. Clin Implant Dent Relat Res 2014;16:705–717.
- Bozini H, Petridis H, Garefis K, Garefis P. Eine Meta-Analyse der prothetischen Komplikationsraten von implantatgestützten festen Zahnprothesen bei zahnlosen Patienten nach einer Beobachtungszeit von mindestens 5 Jahren. Int J Oral Maxillofac Implants 2011;26:304–318.
- Bidra AS, Tischler M, Patch C. Überleben von 2039 vollständigen arch-festen implantatgestützten Zirkonia-Prothesen: Eine retrospektive Studie. J Prosthet Dent 2018;119:220–224.
- Wimmer T, Huffmann AM, Eichberger M, Schmidlin PR, Stawarczyk B. Zwei-Körper-Abnutzungsrate von PEEK, CAD/CAM-Harz-Verbund und PMMA: Einfluss von Probengeometrien, Antagonistenmaterialien und Testaufbau-Konfiguration. Dent Mater 2016;32:127–136.
- Tartaglia GM, Maiorana C, Gallo M, Codari M, Sforza C. Implantatgestützte sofort belastete Vollarch-Rehabilitierungen: Vergleich der klinischen Ergebnisse von Harz und Zirkonia in einer 5-jährigen retrospektiven Nachuntersuchung. Implant Dent 2016;25:74–82.
- Johansson P, Jimbo R, Kjellin P, Currie F, Chrcanovic BR, Wennerberg A. Biomechanische Bewertung und Oberflächencharakterisierung einer nano-modifizierten Oberfläche auf PEEK-Implantaten: Eine Studie im Kaninchen-Schambein. Int J Nanomedicine 2014;9:3903–3911.
- Trindade R, Albrektsson T, Galli S, Prgomet Z, Tengvall P, Wennerberg A. Immunantwort des Knochens auf Materialien, Teil I: Titan, PEEK und Kupfer im Vergleich zu einer Scheinbehandlung nach 10 Tagen im Kaninchen-Schambein. J Clin Med 2018;7:526.
- Trindade R, Albrektsson T, Galli S, Prgomet Z, Tengvall P, Wennerberg A. Immunantwort des Knochens auf Materialien, Teil II: Kupfer und Polyetheretherketon (PEEK) im Vergleich zu Titan nach 10 und 28 Tagen im Kaninchen-Schambein. J Clin Med 2019;8:814.
- Etxeberria M, López-Jiménez L, Merlos A, Escuín T, Viñas M. Bakterielle Haftungseffizienz auf Implantat-Abutments: Eine vergleichende Studie. Int Microbiol 2013;16:235–242.
- Tetelman ED, Babbush CA. Ein neuer Übergangs-Abutment für sofortige Ästhetik und Funktion. Implant Dent 2008;17:51–58.
- Zafiropoulos GG, Deli G, Bartee BK, Hoffmann O. Einzelzahnimplantation und -belastung in frischen und regenerierten Extraktionssocket. Fünf-Jahres-Ergebnisse: Eine Fallserie mit zwei verschiedenen Implantatdesigns. J Periodontol 2010;81:604–615.
- Kaleli N, Sarac D, Külünk S, Özturk Ö. Einfluss verschiedener restaurativer Kronen- und maßgefertigter Abutmentmaterialien auf die Spannungsverteilung in Einzelimplantaten und peripherem Knochen: Eine dreidimensionale finite Elementanalyse. J Prosthet Dent 2018;119:437–445.
- Hahnel S, Wieser A, Lang R, Rosentritt M. Biofilmbildung auf der Oberfläche moderner Implantat-Abutment-Materialien. Clin Oral Implants Res 2015;26:1297–1301.
- Bressan E, Stocchero M, Jimbo R, et al. Mikrobielle Leckage an morse taper konometrischen prothetischen Verbindungen: Eine in vitro Untersuchung. Implant Dent 2017;26:756–761.
- Amato F, Polara G, Spedicato GA. Gewebedimensionale Veränderungen bei der sofortigen Implantation nach Zahnextraktion in der ästhetischen Zone: Eine retrospektive klinische Studie. Int J Oral Maxillofac Implants 2018;33:439–447.
- Maté-Sánchez de Val J, Guirado JC, Ramirez Fernandez M, et al. Klinische und experimentelle Studie eines neuen keramisch verstärkten PEEK-Titan-Hybrid-Abutments, das in postextraktions-Sockets mit sofortiger Restauration platziert wurde. Clin Oral Implants Res 2015;26(suppl 12):356.
- Stoppie N, Van Oosterwyck H, Jansen J, Wolke J, Wevers M, Naert I. Der Einfluss des Young-Moduls von belasteten Implantaten auf die Knochenremodellierung: Eine experimentelle und numerische Studie im Ziegenknie. J Biomed Mater Res A 2009;90:792–803.
- Tannous F, Steiner M, Shahin R, Kern M. Haltekraft und Ermüdungsbeständigkeit von thermoplastischen Harzklammern. Dent Mater 2012;28:273–278.
- Keilig L, Stark H, Bourauel C. Beeinflusst die Materialsteifigkeit neuartiger Hochleistungs-Polymere für feste Teilprothesen ihr biomechanisches Verhalten? Int J Prosthodont 2016;30:595–597.
- Fuhrmann G, Steiner M, Freitag-Wolf S, Kern M. Harzbindung an drei Arten von Polyaryletherketonen (PAEKs): Haltbarkeit und Einfluss der Oberflächenbehandlung. Dent Mater 2014;30:357–363.
- Wang M, Bhardwaj G, Webster TJ. Antibakterielle Eigenschaften von PEKK für orthopädische Anwendungen. Int J Nanomedicine 2017;12:6471–6476.
- Srinivasan M, Kalberer N, Maniewicz S, Müller F. Implantat-retinierte Überdenturen mit einer Verbindung mit echter Ausrichtungs-Korrektur: Eine Fallserie.
