Parodontalerkrankung und altersbedingte Makulopathie: Ein Fallbericht
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Die altersbedingte Makuladegeneration (AMD) ist eine der Hauptursachen für erhebliche Sehbehinderungen bei Personen im Alter von 50 Jahren und älter, die hauptsächlich das zentrale Sehen beeinträchtigt. Diese Studie zielt darauf ab, mögliche Zusammenhänge zwischen Parodontalerkrankungen und altersbedingter Makulopathie im analysierten klinischen Fall zu untersuchen. Ein 66-jähriger männlicher Patient mit altersbedingter degenerativer Makulopathie und schwerer Parodontalerkrankung wurde evaluiert und behandelt. Nach einer initialen Phase der nicht-chirurgischen ursächlichen Parodontaltherapie wurden die parodontalen Indizes erneut bewertet. Darüber hinaus wurde die Extraktion hoffnungsloser Zähne durchgeführt, die durch Zahnimplantate ersetzt wurden. Eine retinale Topographie wurde verwendet, um eine mögliche Regression der Pathologie zu bewerten, und eine angemessene Anti-VEGF-Therapie wurde verabreicht. Die Ergebnisse zeigten eine Regression der Parodontalerkrankung und eine Verbesserung der degenerativen Makulopathie. Diese vorläufigen Ergebnisse, auch wenn sie ermutigend sind, sollten durch größere prospektive Studien unterstützt werden.
Einführung
Parodontalerkrankungen umfassen eine Reihe von entzündlichen Störungen, die die strukturelle Integrität der unterstützenden Gewebe der Zähne, einschließlich des Zahnfleisches, des Alveolarknochens und des parodontalen Ligaments, beeinträchtigen. Diese Zustände können zu Zahnverlust führen und können auch zur systemischen Entzündung beitragen. Ein Ungleichgewicht in der oralen Mikrobiota, die mit dem Immunsystem des Wirts interagiert, um Entzündungen und pathologische Prozesse auszulösen, stellt einen grundlegenden Faktor für den Beginn und die Progression der Parodontalerkrankung dar. Der Schweregrad der Parodontalerkrankung wird von Umwelt- und Wirtsrisikofaktoren beeinflusst, einschließlich Faktoren, die modifiziert werden können, wie Rauchen, und anderen, die nicht modifiziert werden können, wie erbliche Prädisposition. Verschiedene Therapien stehen zur Behandlung der Parodontitis zur Verfügung. Professionelle Zahnreinigung und Wurzelglättung stellen den primären nicht-chirurgischen Ansatz zur Behandlung von Parodontalerkrankungen dar, der die gründliche Entfernung von Zahnbelag und Zahnstein von sowohl supragingivalen als auch subgingivalen Flächen umfasst. Parodontalerkrankungen sind verantwortlich für eine Vielzahl von Problemen wie Zahnverlust, Knochenverlust, Zahnfleischrückgang mit daraus resultierenden ästhetischen und funktionalen Problemen. Wenn die Parodontalerkrankung gestoppt wurde, kann die Wiederherstellung der ästhetischen und kausalen Funktion mit vielen Therapien, einschließlich Perioprothesen, durchgeführt werden. Mehrere Risikofaktoren tragen zum Auftreten und zur Progression der Parodontalerkrankung bei, einschließlich Rauchen, Diabetes und unzureichender Mundhygiene. Ein zusätzlicher Faktor, der derzeit untersucht wird, ist die altersbedingte Makuladegeneration (AMD). AMD ist eine komplexe, multifaktorielle Erkrankung, die häufig zu fortschreitenden und bilateralen Schäden an der Makula führt. Die Makula, der funktionell bedeutendste Bereich der Netzhaut, enthält die höchste Dichte an Photorezeptorzellen, die für das zentrale Sehen verantwortlich sind. Bei AMD entwickeln sich pathologische Veränderungen in der Makula eines ansonsten strukturell normalen Auges, was letztendlich zu irreversiblen Sehverlust führt, insbesondere bei der älteren Bevölkerung.
Periodontal kompromittierte Patienten haben ein höheres Risiko für AMD, aber die ursächliche Beziehung zwischen PD und AMD wurde nicht bestätigt. Ein möglicher Mechanismus, um systemische Erkrankungen zu beeinflussen, ist, dass parodontalen Bakterien und deren Metaboliten (wie Endotoxin) in die systemische Zirkulation gelangen und, wenn sie andere Teile des Körpers erreichen, Monocyten/Makrophagen aktivieren und eine große Anzahl von Entzündungsfaktoren produzieren, was wiederum Entzündungen in anderen Organen verursacht.
Die vorliegende Studie hatte zum Ziel, die Rolle möglicher Korrelationen zwischen degenerativer Makulopathie und Parodontalerkrankung zu untersuchen, eine mögliche Korrelation zu bewerten und die erhaltenen Ergebnisse mit dem folgenden klinischen Fall zu diskutieren und zu analysieren. Diese Studie wurde gemäß den CARE Case Report Guidelines berichtet (https://www.care-statement.org/).
Klinischer Bericht
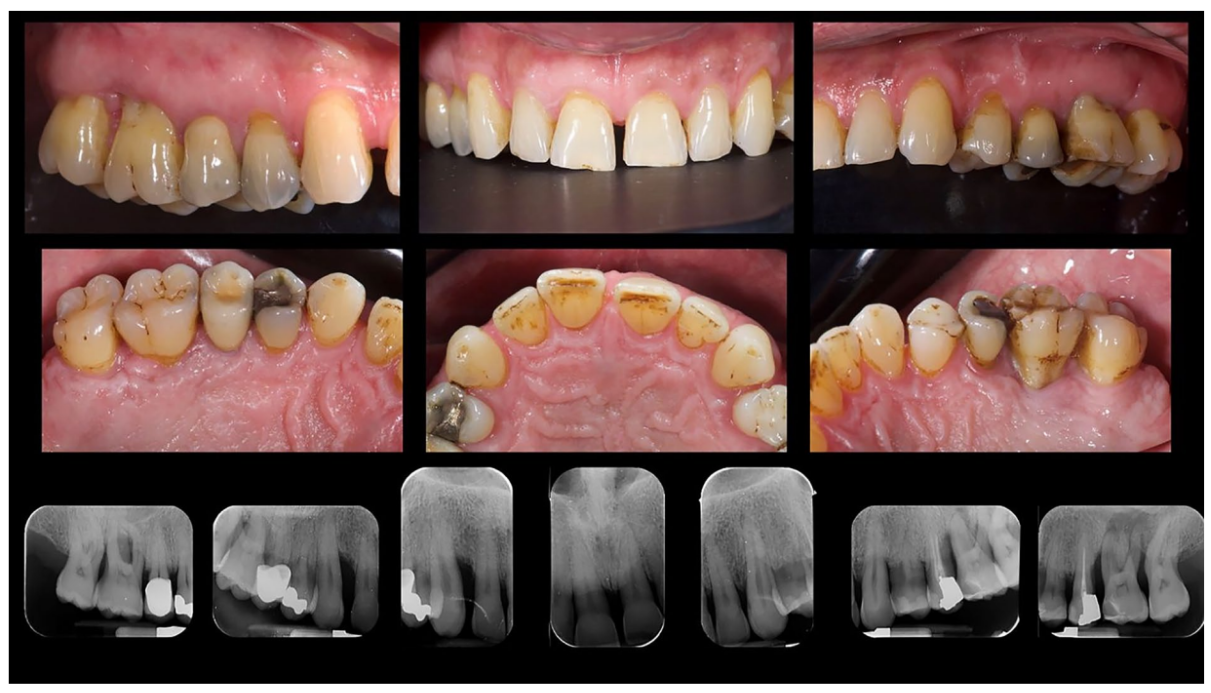
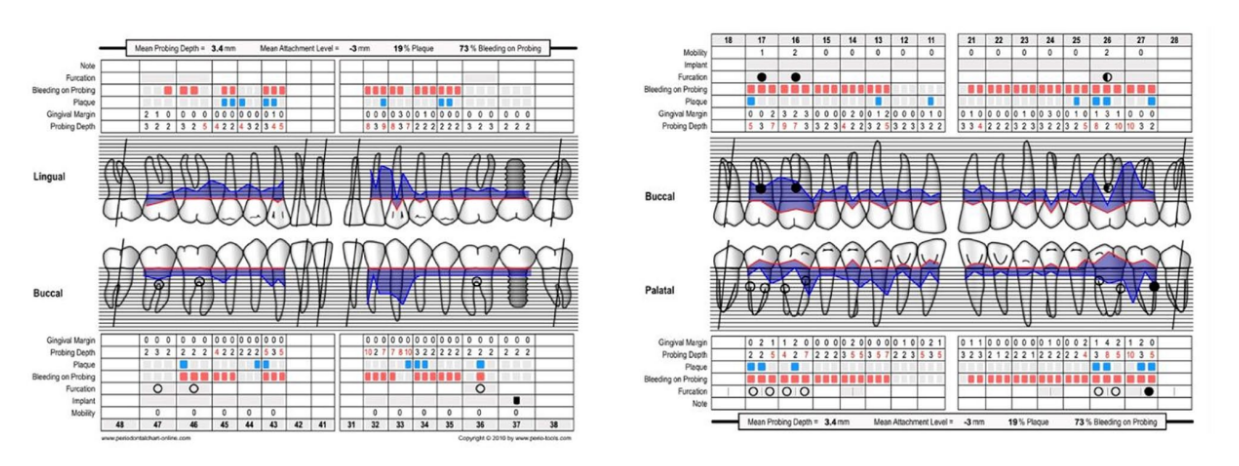
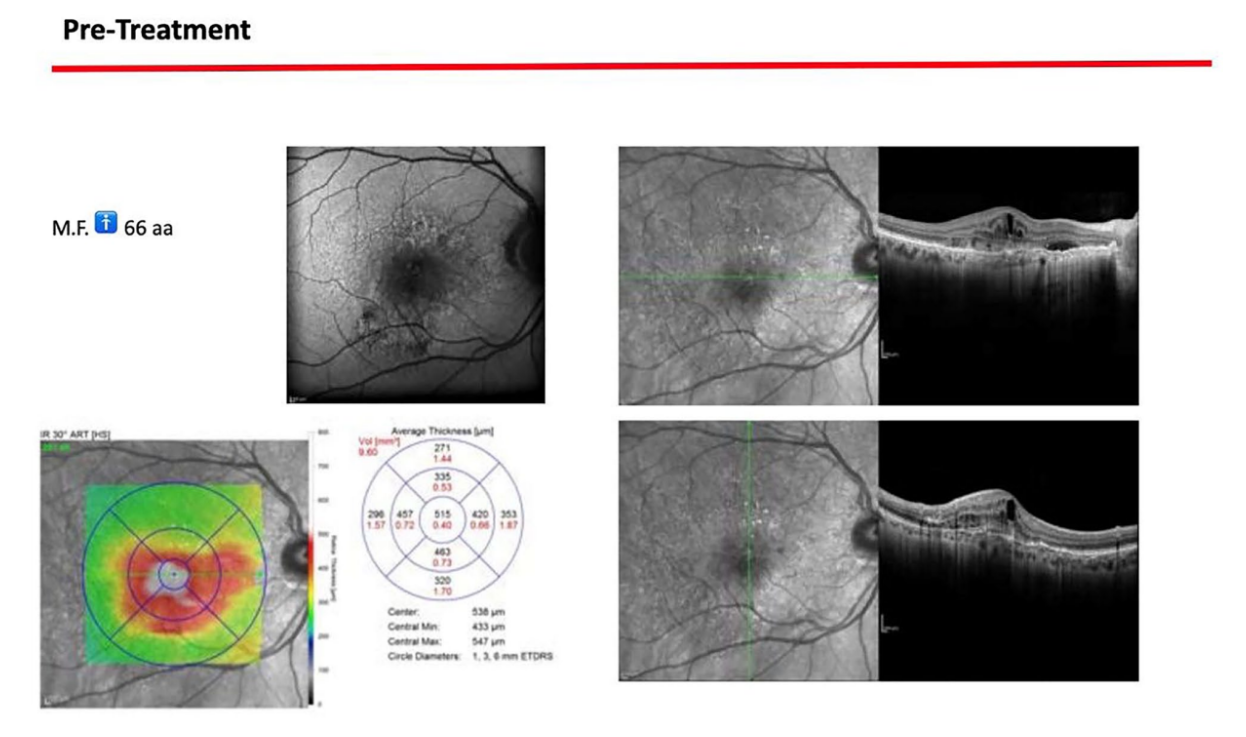
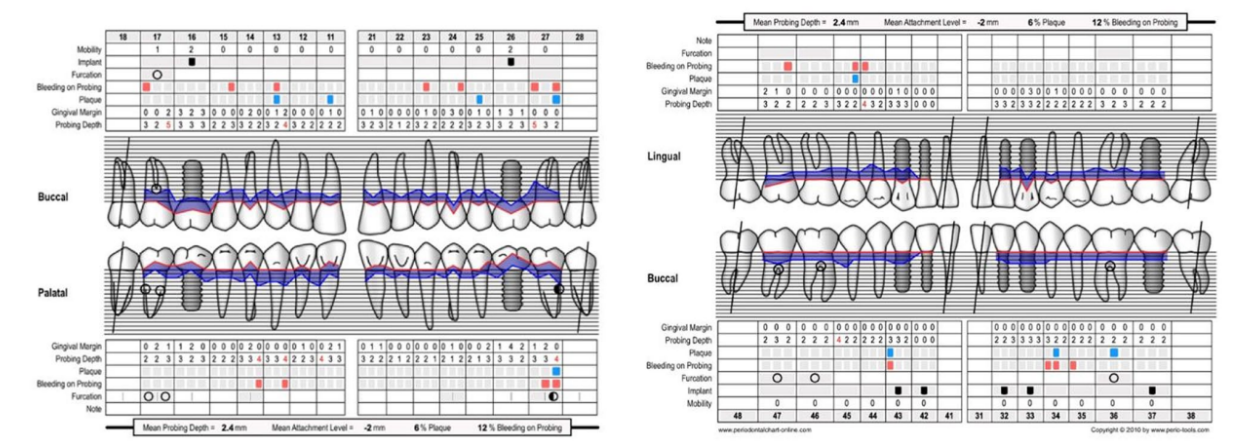
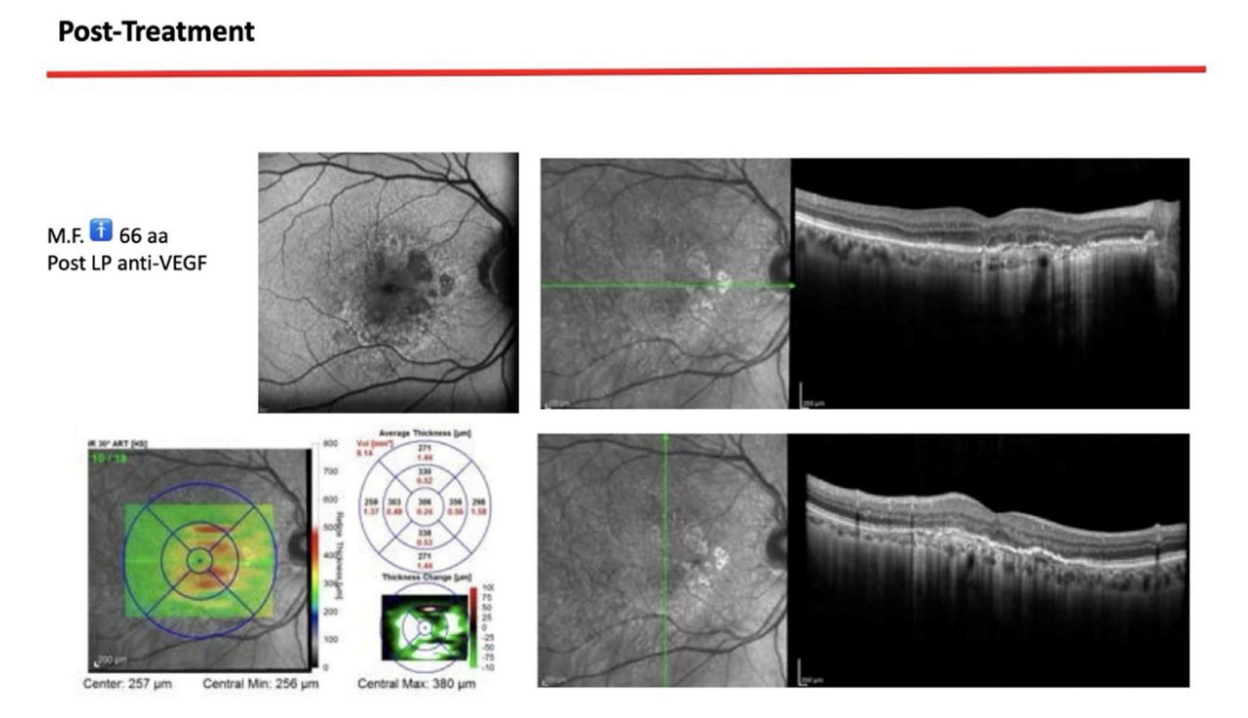
Ein 66-jähriger Patient wurde aufgrund von spontanen Zahnfleischblutungen, Schmerzen beim Essen und dem Vorhandensein eines Abszesses im Bereich des linken mandibulären Caninus an eine Privatklinik überwiesen (Abbildungen 1 und 2). Seine Krankengeschichte wies auf eine familiäre Vorbelastung mit Parodontalerkrankungen, frühere Netzhauterkrankungen, Rauchen (weniger als 15 Zigaretten pro Tag) und kontrollierte Hypertonie mit Medikamenten hin. Zum Zeitpunkt des Besuchs hatte der Patient mit einer 3-monatigen Behandlung mit Anti-VEGF-Therapie begonnen. Die parodontalen Diagnose lautete Stadium IV und Grad C Parodontitis, gemäß der Italienischen Gesellschaft für Parodontologie (SIDP), zusätzlich zur schweren alveolären Knochenschwund (>33%), wies der Patient lokale Komplexitätsparameter auf, wie z.B. Kaudysfunktion, 2° Mobilität bei mehreren zahnmedizinischen Elementen und Beteiligung der Furkation bis Grad 3°. Ein Grad C wurde diagnostiziert aufgrund der Beziehung zwischen dem radiographischen Knochenverlust (RBL) an der Stelle und dem Alter (RBL%/AGE) war >1 (Abbildung 3). Ein parodontaler Befund wurde erstellt (Abbildung 4). Zu Beginn hatte der Patient mehr als 42 Taschen ⩾4 mm mit einer durchschnittlichen Sondierungstiefe von 3,4 mm und einem durchschnittlichen Attachmentverlust von 3 mm. Die parodontalen Bewertungen ergaben einen Vollmund-Plaque-Score (FMPS) von 19% und einen Vollmund-Blutungs-Score (FMBS) von 73%. Nachdem die parodontalen Daten analysiert wurden, wurde die am besten geeignete Behandlung für den Patienten geplant. Die nicht-chirurgische parodontalen Therapie (initiale parodontalen Therapie) zielte darauf ab, den parodontalen Index durch Scaling und Wurzelglättung zu verbessern; Extraktion hoffnungsloser Zähne (1.6; 2.6; V Sextant), gefolgt von der Implantatplatzierung, 4 Monate später, nach parodontaler und radiographischer Bewertung. Der Patient erhielt auch eine topographische makuläre Untersuchung vor und nach der nicht-chirurgischen parodontalen Therapie, um mögliche Veränderungen in seinem pathologischen Bild zu bewerten (Abbildung 5).
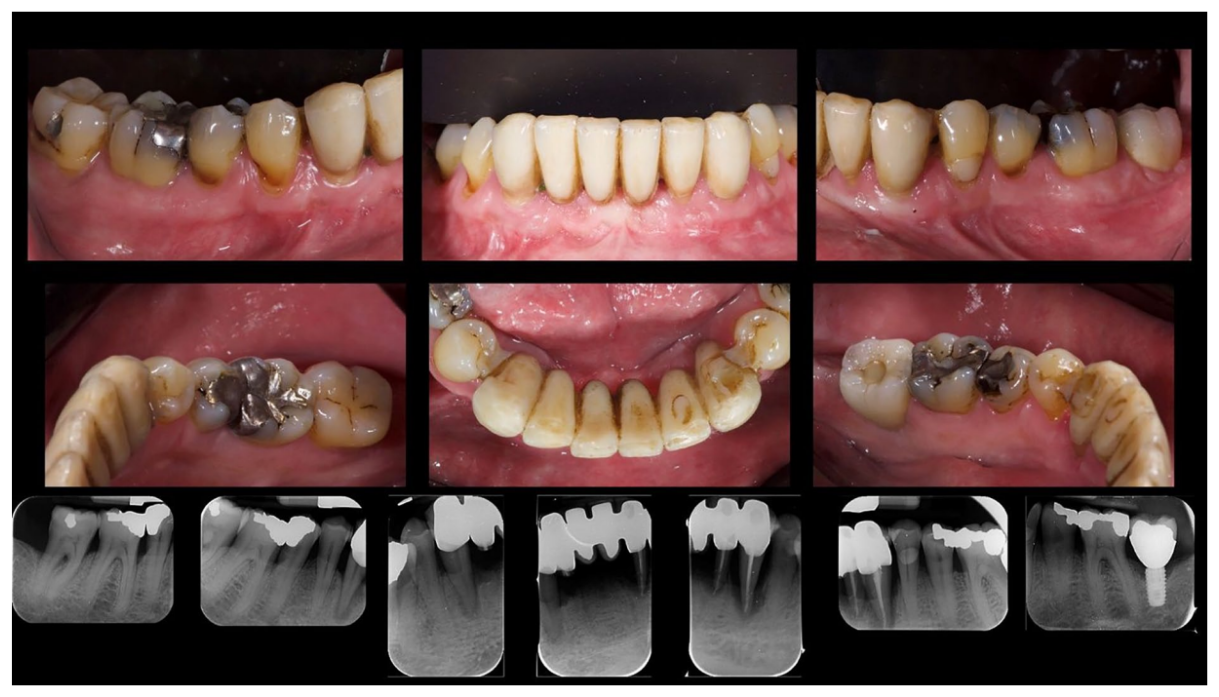
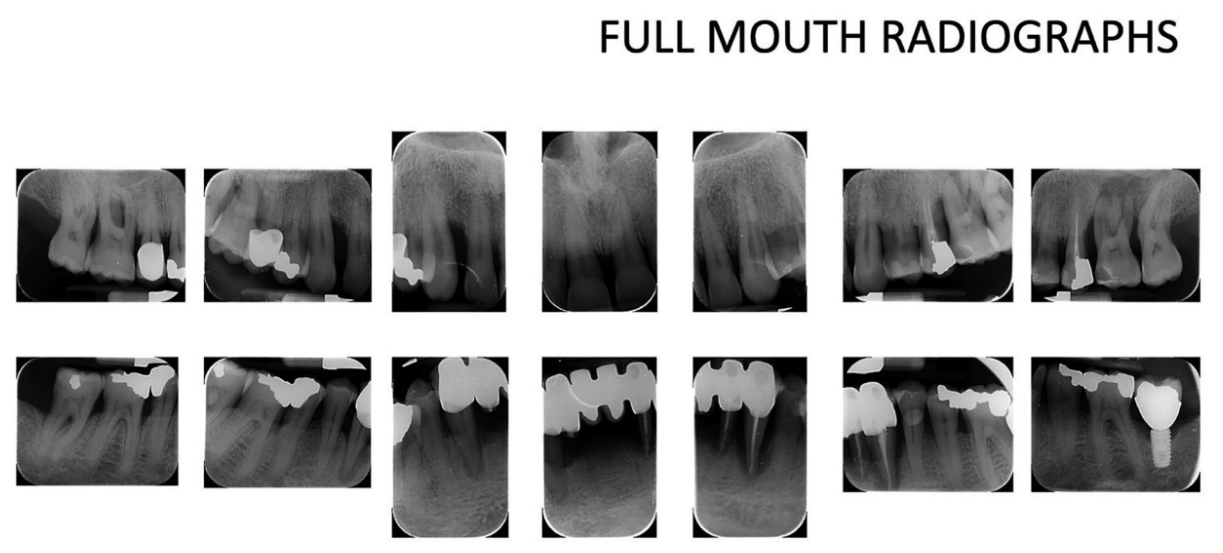
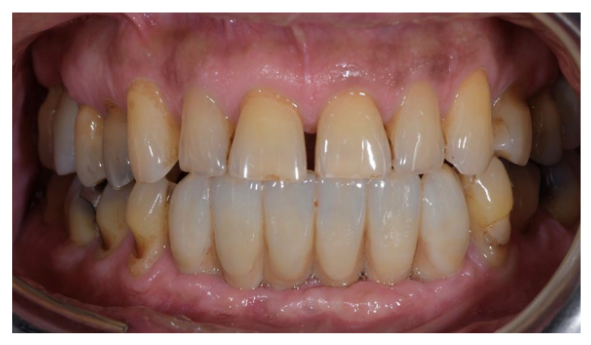
Nach einer Osseointegrationszeit von 6 Monaten wurden die definitiven Prothesen, hergestellt aus monolithischem Zirkon, die auf einer Titanverbindung befestigt sind, durchgeführt (Abbildung 6). Danach wurde der parodontaler Status und die Netzhauterkrankung des Patienten kontinuierlich mit einer parodontalen Erhaltungstherapie alle 4 Monate überwacht, sowie mit einer Anti-VEGF-Therapie gemäß dem Spezialisten. Die klinischen und medizinischen Bedingungen nach der Behandlung sind in den Abbildungen 6 bis 9 dargestellt.
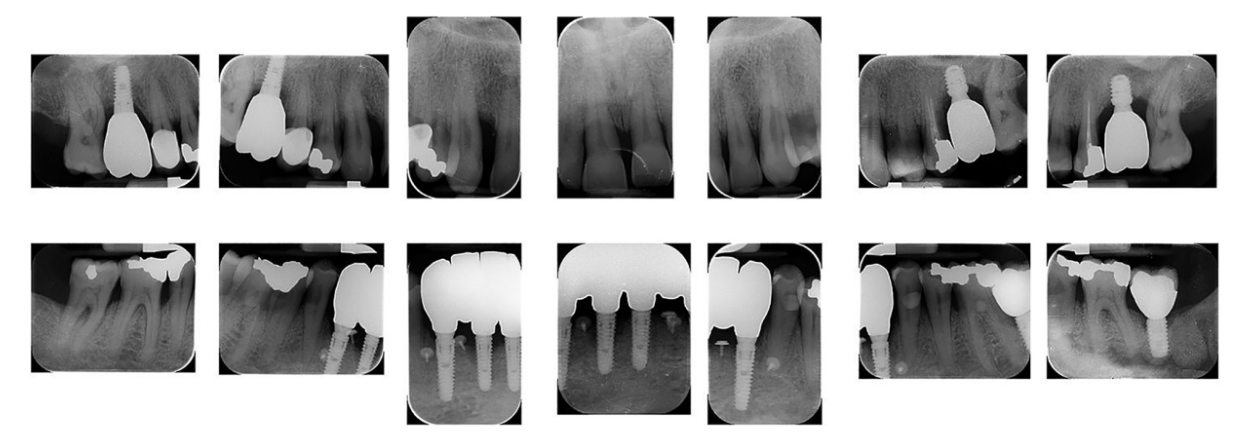
Die Überlebensraten und Komplikationen von Implantaten und Prothesen wurden bewertet. Implantatversagen wurde definiert als die Entfernung eines Implantats aufgrund von Faktoren wie Implantatmobilität, fortschreitendem marginalen Knochenverlust, Infektion oder Implantatfraktur. Die Stabilität einzelner Implantate wurde vom Prothetiker zum Zeitpunkt der definitiven Kronenplatzierung mit einem Entferndrehmoment von 35 Ncm bewertet. Nach der Belastung wurde die Implantatstabilität manuell vom gleichen Prothetiker mit 2 Zahnersatzspiegelgriffen weiter beurteilt. Prothesenversagen wurde als jede Prothese betrachtet, die aus irgendeinem Grund erneuert wurde. Die Variation der Sondierungstiefe (PPD) wird als eine Reduktion der Tiefe des gingivalen Sulcus von der Basislinie bis zur letzten Nachuntersuchung definiert. Die Variation des Bluten bei der Sondierung (BOP) wird als eine Reduktion der Blutungsstellen von der Basislinie bis zur letzten Nachuntersuchung verstanden. Das Vorhandensein von Rezessionen des gingivalen Randes von der Lieferung der endgültigen Prothese bis zur letzten Nachuntersuchung. Komplikationen: verstanden als Frakturen der prothetischen Auskleidung, Frakturen des prothetischen Rahmens und parodontalen Komplikationen.
Nach Abschluss der Behandlung ergab die parodontalen Bewertung eine durchschnittliche Sondierungstiefe von 2,4 mm und einen durchschnittlichen Attachmentverlust von 2 mm. Darüber hinaus zeigte eine topografische Untersuchung der makulären Region, die vor der parodontalen Behandlung mit einer Reihe von horizontalen und vertikalen Scans durchgeführt wurde, im rechten Auge das Bestehen einer atrophisch-narbenbildenden Makulopathie. Das linke Auge zeigte eine Reduktion der subretinalen Bereiche mit hoher Reflektivität über den fovealen Regionen. Eine topografische Untersuchung der makulären Region wurde nach der parodontalen Kausaltherapie und nach der Nachuntersuchung durchgeführt und zeigte im rechten Auge ein anatomisches Bild, das unverändert im Vergleich zum vorherigen war. Das linke Auge zeigte ein verbessertes anatomisches Bild mit dem Bestehen einer leichten subretinalen Exsudation in der fovealen Region. Diese Exsudation wurde beim nächsten Kontrolltermin reduziert. Auf der Ebene des rechten Auges sind intraretinale Exsudate nicht mehr evident, obwohl die atrophisch-narbenbildende Makulopathie weiterhin besteht. Aus diesen Untersuchungen kann geschlossen werden, dass der Narbenstatus wie erwartet bestehen bleibt. Es gab jedoch eine vollständige Remission der damit verbundenen Exsudatphänomene, was auf eine Abnahme des entzündlichen Bildes hinweist.
Bei der 2-Jahres-Nachuntersuchung blieben alle Symptome im Zusammenhang mit der Pathologie konstant. Der Patient war mit den Ergebnissen zufrieden und verstand die Notwendigkeit einer Erhaltungstherapie.
Diskussion
Diese Studie hatte zum Ziel, eine potenzielle Korrelation zwischen altersbedingter degenerativer Makulopathie und Parodontalerkrankungen zu bewerten. Parodontitis ist ein chronischer, multifaktorieller entzündlicher Zustand, der mit einem dysbiotischen Plaque-Biofilm verbunden ist und zur fortschreitenden Zerstörung der zahnstützenden Strukturen führt. Klinisch ist sie durch einen Verlust des klinischen Attachment gekennzeichnet, während die radiografische Bewertung eine Resorption des alveolären Knochens zeigt. Parodontalerkrankungen sind ein bedeutendes Gesundheitsproblem, da sie eine hohe Prävalenz und potenzielle Folgen, einschließlich Zahnverlust, aufweisen, was die Kaafunktion und Ästhetik negativ beeinflusst. Darüber hinaus kann sie zu systemischen Gesundheitskomplikationen beitragen, was ihre klinische Relevanz weiter unterstreicht. Die Bakterien, die an Parodontitis beteiligt sind, können zur Pathogenese degenerativer retinaler Störungen beitragen und möglicherweise deren Entwicklung und Fortschreiten beeinflussen. Die pathologische Mikrobiota der Mundhöhle und eines der Hauptorganismen, die Parodontalerkrankungen verursachen, ist Porphyromonas gingivalis, und Forscher haben ihre Fähigkeit entdeckt, in Epithelzellen, Fibroblasten und dendritische Zellen einzudringen. Altersbedingte Makuladegeneration (AMD) verursacht irreversible Sehverluste bei älteren Menschen, indem sie Läsionen der Makula, dem Zentrum der Netzhaut, in einem zuvor normalen Auge verursacht. Leider gibt es derzeit keine akzeptierte Ursache für AMD und keine wirksame Behandlung für den Zustand. Dennoch bilden die Identifizierung von Risikofaktoren und die Umsetzung palliativer Therapien – wie Laserbehandlung, dynamische Phototherapie, chirurgische Eingriffe und Anti-VEGF-Therapie – das Fundament des Managements von AMD. Jüngste Forschungen haben die Beteiligung systemischer Entzündungsindikatoren an der Pathophysiologie von AMD gezeigt, zusätzlich zu den bereits anerkannten Risikofaktoren, die an ihrer Pathogenese beteiligt sind (Alter, Tabakkonsum, Fettleibigkeit, Polymorphismus des Komplementfaktors, Ernährung). Zu diesem Zeitpunkt ist die Korrelation zwischen Parodontalerkrankungen und AMD nicht ganz klar, aber es gibt zahlreiche Übersichtsarbeiten, die diese mögliche Korrelation analysieren. Darüber hinaus haben andere Autoren, wie Karesvuo, die mögliche Assoziation zwischen PD und AMD nachgewiesen. Es wurde beobachtet, dass Personen mit AMD eine größere Tiefe der parodontalen Taschen (PD) aufwiesen als solche ohne AMD (P = .031). Darüber hinaus hatten Personen mit AMD eine geringere Anzahl verbleibender Zähne (P < .001) und erlitten einen signifikant größeren Verlust des alveolären Knochens (P = .004) als diejenigen ohne die Erkrankung. Ebenso wurde beobachtet, dass Personen mit Parodontitis ein erhöhtes Risiko haben könnten, AMD zu entwickeln, im Vergleich zu Personen ohne Parodontalerkrankung. Laut früheren Literaturübersichten wurde eine potenzielle Assoziation zwischen AMD und Parodontitis vorgeschlagen; jedoch sind weitere Studien erforderlich, um diese Ergebnisse zu validieren und eine klarere kausale Beziehung herzustellen. Die Forschung, die den Zusammenhang zwischen Darmdysbiose und AMD untersucht, wird zusammen mit präklinischen Tiermodellen und Methoden, die geeignet sind, den Einfluss der Darmmikrobiota auf die Entwicklung von AMD zu untersuchen, behandelt. Dies umfasst die Wechselwirkungen mit systemischen Entzündungen, der Immunregulation, der chorioretinalen Genexpression und diätetischen Faktoren. Mit dem wachsenden Wissen über die Darm-Netzhaut-Achse wird auch das Potenzial für zugänglichere und effektivere Strategien zur Prävention und Behandlung dieser sehbedrohenden Erkrankung steigen.
Im Rahmen des vorliegenden Fallberichts, wie die geringe Anzahl der behandelten Patienten, stellt die Parodontalerkrankung einen plausiblen zusätzlichen Risikofaktor für die altersbedingte Makulopathie dar. Der Zusammenhang zwischen den Erkrankungen bleibt unklar. Im präsentierten klinischen Fall, nachdem die parodontalen Indizes erreicht wurden, beobachteten wir eine Abnahme der Entzündungsprozesse in den Augen. Die vorliegende Studie hatte einige Einschränkungen, darunter eine Ein-Personen-Stichprobe und das Fehlen einer Kontrollgruppe. Weitere Studien sind erforderlich, um mögliche Korrekturen zwischen Parodontalerkrankungen und altersbedingter Makulopathie festzustellen. Darüber hinaus sind großangelegte Studien erforderlich, die die biologischen Wege untersuchen, die systemische Entzündungen und Mikrobiota-Dysbiose verbinden, um die Zusammenhänge zwischen den Pathologien besser zu verstehen.
Fazit
Der vorliegende Fallbericht hebt eine potenzielle Korrelation zwischen Parodontalerkrankungen und altersbedingter Makulopathie (AMD) hervor. Der Fall eines 66-jährigen Mannes mit schwerer Parodontalerkrankung und degenerativer Makulopathie wurde bewertet, um diesen möglichen Zusammenhang zu untersuchen. Nach einer anfänglichen Phase der nicht-chirurgischen parodontalen Therapie wurden signifikante Verbesserungen sowohl der parodontalen Indizes als auch des makulären Zustands des Patienten beobachtet. Insbesondere gab es eine bemerkenswerte Reduktion der Entzündungsprozesse in den Augen, wie durch verbesserte anatomische Bilder und eine Abnahme der subretinalen Exsudation belegt.
Francesco Mattia Ceruso, Stephany Gabriela Zambrano Leon, Luca Fiorillo, Gabriele Cervino, Marco Cicciù, Artak Heboyan, Francesco Pernice, Silvio Meloni und Marco Tallarico
Referenzen
- Kinane DF, Stathopoulou PG, Papapanou PN. Parodontalerkrankungen. Nat Rev Dis Primers. 2017;3:17038.
- Jeffcoat MK, Hauth JC, Geurs NC, et al. Parodontalerkrankung und Frühgeburt: Ergebnisse einer Pilotinterventionsstudie. J Periodontol. 2003;74(8):1214-1218.
- Kinane DF, Peterson M, Stathopoulou PG. Umwelt- und andere modifizierende Faktoren der parodontalen Erkrankungen. Periodontol 2000. 2006;40(1):107-119.
- Axelsson P, Lindhe J, Nyström B. Zur Prävention von Karies und parodontalen Erkrankungen: Ergebnisse einer 15-jährigen longitudinalen Studie bei Erwachsenen. J Clin Periodontol. 1991;18(3):182-189.
- Tunkel J, Heinecke A, Flemmig TF. Eine systematische Überprüfung der Wirksamkeit von maschinell betriebenem und manuellem subgingivalem Debridement bei der Behandlung von chronischer Parodontitis. J Clin Periodontol. 2002;29:72-81.
- Badersten A, Nilveus R, Egelberg J. Wirkung der nicht-chirurgischen parodontalen Therapie: II. Schwer fortgeschrittene Parodontitis. J Clin Periodontol. 1984;11(1):63-76.
- Sheiham A, Steele JG, Marcenes W, et al. Prävalenz der Auswirkungen von zahnmedizinischen und oralen Störungen und deren Auswirkungen auf das Essen bei älteren Menschen; eine nationale Umfrage in Großbritannien. Community Dent Oral Epidemiol. 2001;29(3):195-203.
- Coleman HR, Chan C-C, Ferris FL III, Chew EY. Altersbedingte Makuladegeneration. Lancet. 2008;372(9652):1835-1845.
- Klein R, Peto T, Bird A, Vannewkirk MR. Die Epidemiologie der altersbedingten Makuladegeneration. Am J Ophthalmol. 2004;137(3):486-495.
- Srimaneepong V, Heboyan A, Zafar MS, et al. Feste prothetische Restaurationen und parodontaler Gesundheit: eine narrative Überprüfung. J Funct Biomater. 2022;13(1):15.
- Lv X, Li W, Fang Z, Xue X, Pan C. Parodontalerkrankung und altersbedingte Makuladegeneration: eine Meta-Analyse von 112.240 Teilnehmern. Biomed Res Int. 2020;2020:4753645.
- Kalhan AC, Wong ML, Allen F, Gao X. Parodontalerkrankung und systemische Gesundheit: ein Update für medizinische Praktiker. Ann Acad Med Singapore. 2022;51(9):567-574.
- Beck JD, Papapanou PN, Philips KH, Offenbacher S. Parodontalmedizin: 100 Jahre Fortschritt. J Dent Res. 2019;98(10):1053-1062.
- Di Spirito F, La Rocca M, De Bernardo M, et al. Mögliche Assoziation zwischen parodontaler Erkrankung und Makuladegeneration: eine Fall-Kontroll-Studie. Dent J. 2020;9(1):1.
- Hajishengallis G, Maekawa T, Abe T, Hajishengallis E, Lambris JD. Komplementbeteiligung bei Parodontitis: molekulare Mechanismen und rationale therapeutische Ansätze. Adv Exp Med Biol. 2015;865:57-74.
- Cook HL, Patel PJ, Tufail A. Altersbedingte Makuladegeneration: Diagnose und Management. Br Med Bull. 2008;85(1):127-149.
- Bird AC, Bressler NM, Bressler SB, et al. Ein internationales Klassifikations- und Bewertungssystem für altersbedingte Makulopathie und altersbedingte Makuladegeneration. Surv Ophthalmol. 1995;39(5):367-374.
- Pockpa ZAD, Struillou X, Kone D, et al. Parodontalerkrankungen und altersbedingte Makuladegeneration: Gibt es einen Zusammenhang? Perm J. 2019;23:18-260.
- Javed F, Sculean A, Romanos GE. Assoziation zwischen altersbedingter Makuladegeneration und parodontalen sowie peri-implantären Erkrankungen: eine systematische Überprüfung. Acta Ophthalmol. 2021;99(4):351-356.
- Arigbede AO, Babatope BO, Bamidele MK. Parodontitis und systemische Erkrankungen: eine Literaturübersicht. J Indian Soc Periodontol. 2012;16(4):487-491.
- Meduri A, Frisina R, Rechichi M, Oliverio GW. Prävalenz von Meibomdrüsen-Dysfunktion und deren Auswirkungen auf die Lebensqualität und okulären Unbehagen bei Patienten mit prothetischen Augen. Prosthesis. 2020;2(2):91-99.
- Garrido-Hermosilla AM, Martínez-Alberquilla I, Díaz-Ruiz MC, et al. Erfahrung mit einem neuen, auf hochdichtem Polyethylen basierenden porösen orbitalen Implantat: explorative 1-Jahres-Leistungs- und Sicherheitsresultate. Prosthesis. 2024;6(6):1400-1409.
- Xiao J, Zhang JY, Luo W, He PC, Skondra D. Die aufkommende Rolle des Darmmikrobioms bei altersbedingter Makuladegeneration. Am J Pathol. 2023;193(11):1627-1637.
- Lin P, McClintic SM, Nadeem U, Skondra D. Eine Überprüfung der Rolle des intestinalen Mikrobioms bei altersbedingter Makuladegeneration. J Clin Med. 2021;10(10):2072.
