Histologische Analyse der biologischen Breite und der Orientierung der Kollagenfasern um schraubenlose, Morse-Taper, halbkugelförmige Basisabutments 8 und 16 Wochen nach der Implantatfreilegung: Eine beobachtende klinische Studie
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziele: Diese Studie hatte zum Ziel, die histologische Ausrichtung der Kollagenfasern um schraubenlose, Morse-Taper, halbkugelförmige Basis-Abutments bei Menschen zu bewerten.
Methoden: Diese Studie wurde als eine beobachtende, Fall-Kontroll, klinische Studie konzipiert, um die histologische Ausrichtung der Kollagenfasern um Implantate zu bewerten. Biopsien des peri-implantären Gewebes wurden 8 (Gruppe A, Kontrolle) oder 16 (Gruppe B, Test) Wochen nach der Freilegung des Implantats durchgeführt und histologisch unter einem Lichtmikroskop mit Hämatoxylin und Eosin, Masson und Picro Sirius histochemischer Färbung sowie einem Rasterelektronenmikroskop analysiert.
Ergebnisse: Acht Patienten wurden in diese Studie aufgenommen und 16 Biopsien wurden durchgeführt. Alle Biopsien wurden korrekt analysiert. Die histologische Untersuchung von Querschnitten des Gewebes, das 8 Wochen nach der Freilegung des Implantats entnommen wurde, zeigte das nahezu vollständige Fehlen einer epithelialen Auskleidung, während die Bindegewebsbündel im oberflächlichen Bereich ein geringeres zirkuläres Muster aufwiesen. Die histochemische Querschnittsuntersuchung des Gewebes, das 16 Wochen nach der Freilegung des Implantats entnommen wurde, zeigte die partielle Anwesenheit einer nicht-verhornenden epithelialen Auskleidung an der Implantatstelle, und die Kollagenbündel zeigten eine größere Organisation mit einem zirkumferenziellen Verlauf um das Abutment. Nach 8 Wochen zeigte die endgültige histologische Analyse eine durchschnittliche Höhe von 1,01 mm für das verhorntes Epithel, 0,83 mm für das nicht-verhornte Epithel und 1,39 mm für das Bindegewebe. Während die Werte nach 16 Wochen 1,20 mm, 0,48 mm und 1,11 mm betrugen. Es wurden keine statistisch signifikanten Unterschiede zwischen den Gruppen gefunden (p > 0,05).
Fazit: Histologisch gab es keine Unterschiede in der Höhe und dem Profil des Zahnfleisches zwischen 8 und 16 Wochen Heilung nach der Prothesenabgabe. Eine größere Organisation der Kollagenfasern mit einem zirkumferentialen Verlauf um das Abutment wurde in der Testgruppe (16 Wochen) im Vergleich zur Kontrollgruppe (8 Wochen) festgestellt.
Einleitung
Der Erfolg einer Implantatbehandlung wird zunächst durch die Osseointegration bestimmt, ist aber vor allem von der Stabilität sowohl des marginalen Knochens als auch der peri-implantären Weichgewebe über die Zeit abhängig. Eine stabile physiologische Umbau des marginalen Knochens kann im mittel- bis langfristigen Follow-up erwartet werden, wenn moderne Implantatoberflächen und -verbindungen verwendet werden. In den letzten zehn Jahren wurde das Konzept der biologischen Breite in der oralen Implantation intensiv diskutiert. Die Eigenschaften der peri-implantären Mukosa werden während der Etablierung der biologischen Breite bestimmt, die nach mehreren Wochen der Heilung nach dem Verbinden der Heilungsabutments oder prothetischen Komponenten erfolgt. Die biologische Breite um ein Implantat ist ein komplexes System von 3–4 mm Größe. Sie erstreckt sich von der Spitze der peri-implantären Mukosa bis zum ersten Kontakt zwischen Knochen und Implantat und besteht aus sulkularem Epithel, junctionalem Epithel und faserigem Bindegewebe. Es wurde jedoch gezeigt, dass die unterschiedliche Anordnung der Bindegewebsfasern um Implantate im Vergleich zu natürlichen Zähnen variiert, mit kreisförmigen oder ringförmigen Anordnungen parallel zur Längsachse und zum eingesetzten Implantat. Die Rolle der biologischen Breite besteht darin, eine biologische Barriere gegen die toxischen Produkte von Bakterien zu schaffen, die den darunter liegenden Knochen schützt. In den letzten Jahren ist dieses Konzept in der modernen Zahnimplantologie sehr populär geworden, die stärker auf die Bedürfnisse des Weichgewebemanagements ausgerichtet ist. Das Weichgewebemanagement kann mit verschiedenen chirurgischen Techniken und zu unterschiedlichen Zeitpunkten während der Implantatbehandlungen durchgeführt werden, basierend auf dem anfänglichen Defekt, dem anatomischen Bereich und ästhetischen Überlegungen. Kurz gesagt, kann eine Vergrößerung des keratinisierten Gewebes durchgeführt werden, um ein Band von keratinisiertem Gewebe um Implantate zu erhalten, das deren ästhetische Ergebnisse verbessert und das Risiko der Plaqueansammlung verringert. Im Gegensatz dazu kann eine Vergrößerung der Weichgewebedicke durchgeführt werden, um die Dicke der peri-implantären suprakrestalen Weichgewebe zu erhöhen, die entscheidend ist, um ein natürliches Emergenzprofil für die prothetische Restauration zu erhalten und ein zufriedenstellendes ästhetisches Ergebnis zu gewährleisten. Darüber hinaus geht ein dünner Biotyp oder Phänotyp oft gegen die Resorption, um die korrekte biologische Breite wiederherzustellen. Mikrolücken und Mikrobewegungen an der Implantat-Abutment-Schnittstelle spielen ebenfalls eine wichtige Rolle für die Stabilität der peri-implantären harten und weichen Gewebe. Mikroleckagen an der Implantat-Abutment-Schnittstelle können den bakteriellen Durchgang und die Freisetzung kleiner Titanpartikel bestimmen, die Entzündungen im peri-implantären Gewebe hervorrufen. Aus diesen Gründen können heute Implantate mit einer Morse-Taper-Verbindung und ohne Verbindungsschraube eine gute Wahl darstellen.
Der supragingivale Faserapparat besteht aus einem dichten Netzwerk von Kollagenfaserbündeln
, die das Zahnfleisch mit den Zähnen und dem Knochen verbinden und die vestibulären und oralen interdentalen Papillen verbinden [9]. Dieses Fasernetzwerk bietet mechanischen Widerstand und ermöglicht es dem Zahnfleisch, Reibungskräften durch das Kauen standzuhalten. Das junctionale Epithel bildet den koronalen Teil der dentogingivalen Verbindung, während der apikale Teil aus dentogingivalen Bindegewebsfasern besteht, die in das Wurzelzement eindringen und eine Bindung des Bindegewebes gewährleisten. Die peri-implantäre Mukosa um erfolgreiche endosseöse Implantate weist viele Ähnlichkeiten mit den Geweben auf, die natürliche Zähne umgeben. Die Lamina propria erstreckt sich koronial vom Alveolarknochen und ist mit keratinisiertem oralem Epithel bedeckt. Unter gesunden Bedingungen bildet sich ein flacher Sulcus, der von sulkularem Epithel ausgekleidet ist. Unter den Geweben, die mit dem Implantat in Kontakt stehen, ähnelt das junctionale Epithel am meisten dem eines natürlichen Zahns und bildet eine biologische Bindung über die basale Lamina und Hemidesmosomen. Es bestehen jedoch Unterschiede darin, wie Bindegewebe mit Implantaten interagiert, da das Wurzelzement fehlt. Während dentogingivale Fasern in natürlichen Zähnen senkrecht oder schräg an mineralisiertem Zement anhaften, bleibt ihre direkte Anheftung an Implantate umstritten. Die meisten Bindegewebsfasern verlaufen parallel zur Implantatoberfläche, entweder in einer koronalen-apikalen Richtung oder zirkumferentiell. Einige Studien deuten auf das Vorhandensein von Fasern hin, die senkrecht oder schräg zur Implantatoberfläche orientiert sind, insbesondere auf mikrotexturierten anstelle von glatten transmukosalen Oberflächen.
Das Ziel dieser klinischen Studie war es, bei Menschen die biologische Breite zu messen und die Orientierung der Kollagenfasern um schraubenlose, Morse-Taper, halbkugelförmige Basen 8 und 16 Wochen nach der Implantatfreilegung vorläufig zu bewerten. Das folgende Manuskript wurde gemäß den STROBE-Richtlinien für die Berichterstattung über beobachtende klinische Studien verfasst.
Materialien und Methoden
Diese Studie wurde als beobachtende, Fall-Kontroll-, klinische Studie konzipiert und hatte zum Ziel, die Höhe und das Profil der biologischen Breite sowie die Orientierung der Kollagenfasern um schraubenlose, Morse-Taper-Implantat-Abutment-Verbindungen bei Teilnehmern 8 und 16 Wochen nach der Implantatfreilegung zu bewerten. Diese Studie wurde in Übereinstimmung mit den in der Deklaration von Helsinki für biomedizinische Forschung mit menschlichen Probanden dargelegten Prinzipien durchgeführt, die 2018 geändert wurde. Das Forschungprotokoll erhielt die ethische Genehmigung der Universität Bukarest in Rumänien (Protokollnummer 15/2024, 16. Dezember 2024) und wurde in einer Online-Datenbank für klinische Forschungsstudien registriert (Registrierungsnummer: NCT06862505; 5. März 2025). Jeder Patient im Alter von 18 Jahren oder älter, der von partieller Edentulismus der posterioren (Prämolaren und Molaren) Elemente betroffen war, mindestens zwei Einzelimplantat-Rehabilitierungen benötigte, ohne dass eine Weich- und/oder Gewebeaugmentation erforderlich war, und in der Lage war, ein Einverständnisformular zu verstehen und zu unterschreiben, wurde als für diese Studie geeignet angesehen. Patienten wurden ausgeschlossen, wenn eines der folgenden Ausschlusskriterien vorlag: systemische oder lokale Kontraindikationen für die Implantation; unbehandelte Parodontalerkrankung; Rauchen; Osteoporose; unkontrollierter Diabetes; die Ablehnung der Implantatrehabilitation; die Ablehnung der Biopsieentnahme; und systemische Erkrankungen, die die Heilung des peri-implantären Gewebes gefährden könnten. Alle ausgewählten Patienten wurden über alle chirurgischen und prothetischen Verfahren informiert, einschließlich der Vorteile sowie der potenziellen Risiken und Komplikationen dieser Forschung, und die schriftliche Einwilligung wurde vor der endgültigen Einschreibung eingeholt.
2.1. Präoperatives und operatives Protokoll
Die Patienten wurden zunächst klinischen und instrumentellen Untersuchungen unterzogen, um ihren allgemeinen Gesundheitszustand und ihre Eignung festzustellen. Die vom Fachbereich im Rahmen des normalen Protokolls geforderten instrumentellen Tests waren wie folgt: Blutuntersuchungen, EKG und kardiologische Untersuchung sowie Cone Beam CT des Zahnbogens. Etwa 10 Tage vor der Implantation durchliefen alle Patienten professionelle Mundhygienesitzungen. Alle Patienten erhielten eine prophylaktische Antibiotikatherapie: 2 g Amoxicillin 1 Stunde vor dem Eingriff oder Clindamycin 600 mg 1 Stunde vor der Implantation, falls sie allergisch gegen Penicillin waren. Alle Patienten spülten 1 Minute lang mit einer 0,2%igen Chlorhexidin-Mundspülung vor jedem chirurgischen Eingriff. Lokalanästhesie (Septanest mit Adrenalin, 1/100.000, Septodont, Mataró, Spanien) wurde mit einer infiltrativen Technik verabreicht. Der Schnitt und die Elevation eines trapezförmigen Mukoperiostlappens wurden an der gewählten Implantationsstelle durchgeführt. Sobald der Knochen freigelegt war, wurde die Osteotomie mit einem Pilotbohrer von 2,0 mm Durchmesser bei 1100 U/min und mit externer kalter Spülung durchgeführt. Die initiale Osteotomie wurde gemäß den Anweisungen des Herstellers erweitert. Kurze Zahnimplantate (Bicon-System, Boston, MA, USA) für Einzel- und Mehrzahnrekonstruktionen wurden 2 bis 3 mm unterhalb des Niveaus des marginalen Knochenkamms eingesetzt, und Heilungskappen wurden verwendet. Der Lappen wurde repositioniert und passiv genäht, um eine primäre Wundheilung zu ermöglichen. Ein zweistufiges chirurgisches Protokoll wurde verwendet. Drei Monate nach der Implantation wurde eine Lokalanästhesie (Septanest mit Adrenalin, 1/100.000, Septodont, Mataró, Spanien) mit einer infiltrativen Technik und einem Vasokonstriktor durchgeführt. Alle Implantate wurden durch minimal-invasive lineare Schnitte am Kamm freigelegt und alle darüber liegenden Gewebewachstums entfernt. Nachdem die Heilungskappe entfernt wurde, wurde ein Snap-on-Abdruck genommen.
Danach wurde ein Polycarbonat-Heilabutment mit einem Durchmesser von 4 (Prämolaren) oder 5 (Molaren) mm eingesetzt und auf den Implantaten befestigt. Die Patienten wurden in Gruppen randomisiert, die ihre definitiven Restaurationen 8 (Kontrolle) oder 16 (Test) Wochen nach der Verbindung des Heilabutments erhielten, um die Heilung der peri-implantären Weichgewebe über verschiedene Zeitintervalle zu bewerten. Eine intraorale radiografische Untersuchung des Implantatstandorts wurde bei allen Patienten durchgeführt, um die korrekte Fixierung des Heilabutments zunächst und später deren definitiver Restauration zu bewerten. Das Rinn-Ausrichtungssystem wurde verwendet.
2.2. Biopsietechnik
In beiden Gruppen wurde zu unterschiedlichen Zeitintervallen eine Biopsie des peri-implantären Weichgewebes unmittelbar vor der Lieferung der definitiven Prothese entnommen. Die Anästhesie wurde mit einer infiltrativen Technik 10 mm vom Probenstandort entfernt durchgeführt. Ein Mucotome mit einem Durchmesser von 5 (Prämolaren) oder 6,5 (Molaren) mm wurde um die halbkugelförmigen Basisabutments verwendet. Jede Probe umfasste das Weichgewebe, das während der Heilungsperiode von 8 oder 16 Wochen um die Abutments gebildet wurde (Abbildung 1). Die Proben wurden in zwei identische Teile geschnitten. Die ersten gesammelten Gewebeteile wurden in 10% neutral gepuffertem Formalin für die optische Untersuchung fixiert. Die zweiten Teile wurden in 2,5% Glutaraldehyd in PBS 0,1 M pH 7,4 für mindestens 4 Tage zur Beobachtung unter dem Rasterelektronenmikroskop fixiert. Eine postoperative Schmerzbehandlung mit Ibuprofen 600 mg wurde nach Bedarf verschrieben. Alle Patienten wurden in den nächsten sechs Monaten streng nachverfolgt, um die vollständige Heilung des entnommenen Weichgewebes zu bewerten.
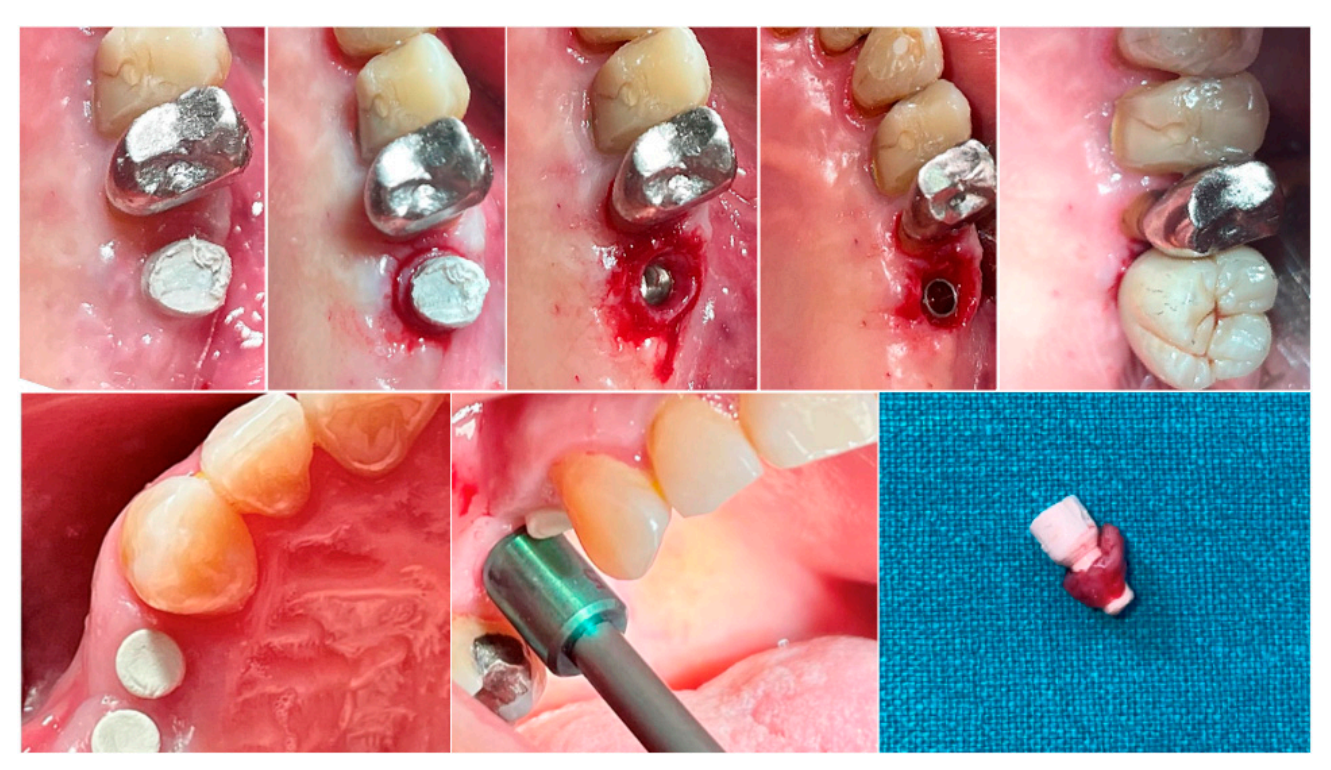
2.3. Ergebnismaße
Das primäre Ergebnis war das Implantatversagen, definiert als Mobilität, Infektion, Fraktur und/oder jedes andere mechanische oder biologische Problem, das seine Entfernung erforderte. Darüber hinaus wurden während der Nachuntersuchung alle biologischen (z. B. medikamentenresistente Schmerzen, Schwellungen, übermäßige MBL, Eiterbildung usw.) und/oder technischen (z. B. Bruch des Verblendmaterials und/oder des Rahmens, Schraubenlockerung usw.) Komplikationen aufgezeichnet.
Die sekundären Ergebnisse waren die histologische Analyse mit Histomorphometrie und der Analyse mit einem Rasterelektronenmikroskop (REM).
Alle histologischen Proben wurden am Department für Radiologische, Onkologische und Pathologische Wissenschaften, „La Sapienza“, Universität Rom, Italien, analysiert. Für die histologische Diagnose wurden zwei Gruppen definiert: diejenigen, die 8 oder 16 Wochen Heilung nach der Implantatfreilegung durchlaufen hatten. Für die histologische Analyse wurden die gesammelten Proben weiter in zwei Teile für sowohl transversale als auch longitudinale Untersuchungen unterteilt. Alle Proben wurden in Paraffin eingebettet und mit einem Mikrotom geschnitten, um transversale und longitudinale Schnitte zu erhalten, die für die morphologischen Analysen verwendet werden sollten. Für jede formalinfixierte Probe wurden zwei Teile in Paraffinwachs eingebettet, der erste entlang der longitudinalen Achse geschnitten, um alle langen Achsen des Präparats zu sehen, und der zweite entlang der halb-zirkumferentialen Achse, um die kurze Achse des Präparats zu sehen. Die histologischen Schnitte wurden mit Hämatoxylin und Eosin, Massons Trichrom und Picro Sirius gefärbt und mit einem Leica-Optikmikroskop (Leitz Kamera, Wetzlar, Deutschland) beobachtet.
Die Organisation der Kollagenfasern wurde durch histologische Untersuchung der Querschnittsabschnitte, die mit Hämatoxylin und Eosin, Massons Trichrom und Picro Sirius (mit und ohne polarisiertes Licht) gefärbt wurden, und mit einem Leica-Optikmikroskop beobachtet. Die biologische Breite wurde als Höhe und Profil der longitudinalen histologischen Abschnitte gemessen, die mit lichtmikroskopischer Analyse und histochemisch mit Hämatoxylin und Eosin gefärbt und mit einem Leica-Optikmikroskop beobachtet wurden. Die Organisation der Kollagenfasern wurde auch mit einem Rasterelektronenmikroskop (ZEISS EVO 40, ZEISS, Oberkochen, Deutschland) bewertet.
Quantitative, histomorphometrische Messungen wurden an den longitudinalen Abschnitten mit der Software ImageJ 1.54 (National Institute of Health, Bethesda, MD, USA) bei 1.6× Vergrößerung bewertet. Die Standardisierung des Mikroskops wurde sichergestellt, indem dasselbe Leica-Optikmikroskop für die morphologischen Analysen verwendet wurde, und zwei erfahrene Forscher (R.C., C.D.G.), die über die Art der Probe im Unklaren waren, führten die Bewertungen und die histomorphologischen Messungen durch.
Für die Analyse mit dem Rasterelektronenmikroskop wurden die Proben 2 Stunden lang in einer 2%igen Osmiumtetroxidlösung in H2O nachfixiert. Die Proben wurden dann zweimal für 20 Minuten in H2O gewaschen, um die Nachfixierungslösung zu entfernen. Anschließend wurde eine Dehydration in einer aufsteigenden Serie von Alkohollösungen (30–50–70–95–100%) durchgeführt. Um die ultrastrukturellen Oberflächendetails zu erhalten, wurden die Proben in einem Emitech K850, „Kritischer Punkt Trocknung“ Gerät (Emitech Ltd., Ashford, Kent, England) getrocknet. Die getrockneten Proben wurden mit Silberkleber auf Aluminiumstümpfe montiert und dann mit Platin (2 Minuten, 15 mA) unter Verwendung eines Emitech K 550 Sputterbeschichters (Emitech Ltd., Ashford, Kent, England) sputterbeschichtet. Die Proben wurden unter Hochvakuumbedingungen bei 12 kV mit einem Hitachi SU3500 (Hitachi Ltd., Hitachi, Japan) Rasterelektronenmikroskop beobachtet.
2.4. Stichprobengröße und Randomisierung
Die Berechnung der Stichprobengröße wurde nicht durchgeführt, da die vorliegende Studie als Pilotstudie, beobachtende klinische Studie betrachtet wurde. Eine computererstellte Randomisierungsliste wurde erstellt. Nur einer der Ermittler, der nicht an der Auswahl und Behandlung der Patienten beteiligt war, war über die Randomisierungssequenz informiert. Die randomisierten Codes wurden in nacheinander nummerierten, identischen, opaken, versiegelten Umschlägen aufbewahrt. Die Umschläge wurden nacheinander sofort nach der Abformung geöffnet; daher war die Zuteilung der Behandlung den Ermittlern während der Rekrutierung und Behandlung der Patienten nicht bekannt.
2.5. Statistische Analyse
Alle Analysen wurden gemäß einem vorab festgelegten Analyseplan mit der SPSS-Software für Mac OS X (Version 22.0; SPSS, Chicago, IL, USA) durchgeführt. Ein Zahnarzt (M.T.) analysierte die Daten. Eine deskriptive Analyse wurde für numerische Parameter unter Verwendung von Mittelwerten ± SD durchgeführt. Unterschiede in den durchschnittlichen Gewebekompositionen (Höhe und Profil) nach 8 und 16 Wochen wurden mit gepaarten t-Tests verglichen. Der Patient war die statistische Einheit der Analysen. Alle statistischen Vergleiche wurden mit einem Signifikanzniveau von 0,05 durchgeführt.
Ergebnisse
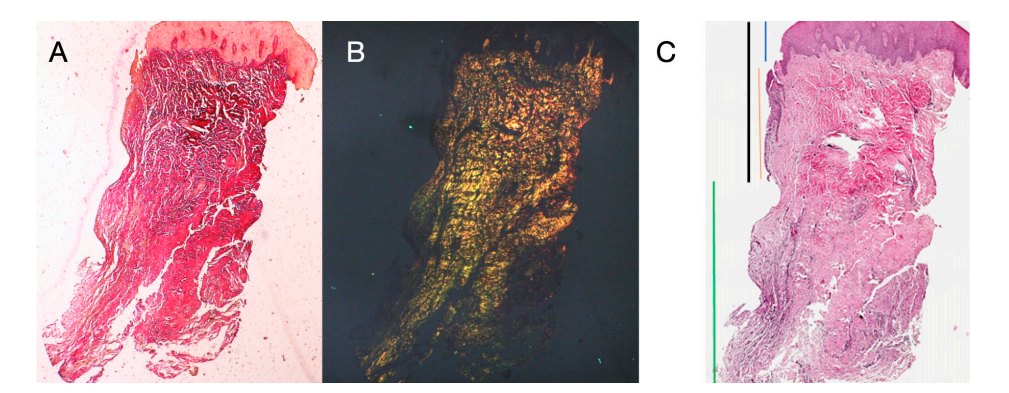
Acht Patienten im Alter von 38 bis 63 Jahren wurden ausgewählt, vier Frauen und vier Männer (Durchschnittsalter 51,5 ± 9 Jahre). Jeder Patient erhielt zwei Biopsien an zwei verschiedenen Stellen gemäß der Randomisierung. Sowohl nach 8 als auch nach 16 Wochen nach der Freilegung des Implantats zeigte die klinische Untersuchung gesunde peri-implantäre Gewebe. Kein Patient brach die Studie ab. Kein Implantat versagte während der Osseointegration und es traten bis zu sechs Monate nach der Prothesenabgabe keine biologischen oder technischen Komplikationen auf. In der lichtmikroskopischen Analyse zeigten die Gewebe eine vollständige Abwesenheit von Entzündungen und eine erhöhte Organisation der kollagenen Fasern, die zirkulär um das Abutment angeordnet waren. Die Menge des in den Proben enthaltenen Gewebes erlaubte die Vorbereitung mehrerer Schnitte mit unterschiedlichen Färbungen sowohl für die Licht- als auch für die Rasterelektronenmikroskopie. Die histologische Untersuchung der Querschnittsproben, die 8 Wochen nach der Freilegung des Implantats entnommen wurden, zeigte das nahezu vollständige Fehlen einer epithelialen Auskleidung an der Stelle des Implantats, die aus lockerem Bindegewebe mit kleinen, neu gebildeten Gefäßen in Anwesenheit von fokalen hämorrhagischen Extravasationen und lymphozytären entzündlichen Infiltraten bestand. Das angrenzende Bindegewebe erschien dichter, mit reichlicher entzündlicher Infiltration, die hauptsächlich aus Lymphozyten und Plasmazellen bestand, die um kleine Gefäßstrukturen angeordnet waren. Darüber hinaus zeigten die Bindegewebsbündel im oberflächlichen Bereich ein zirkuläres Muster. Bei der Untersuchung mit Massons Trichrom und Picro Sirius zeigte letzterer, unter einem optischen Mikroskop mit polarisiertem Licht beobachtet, die nahezu ausschließliche Präsenz von Kollagen Typ I (Abbildung 2).
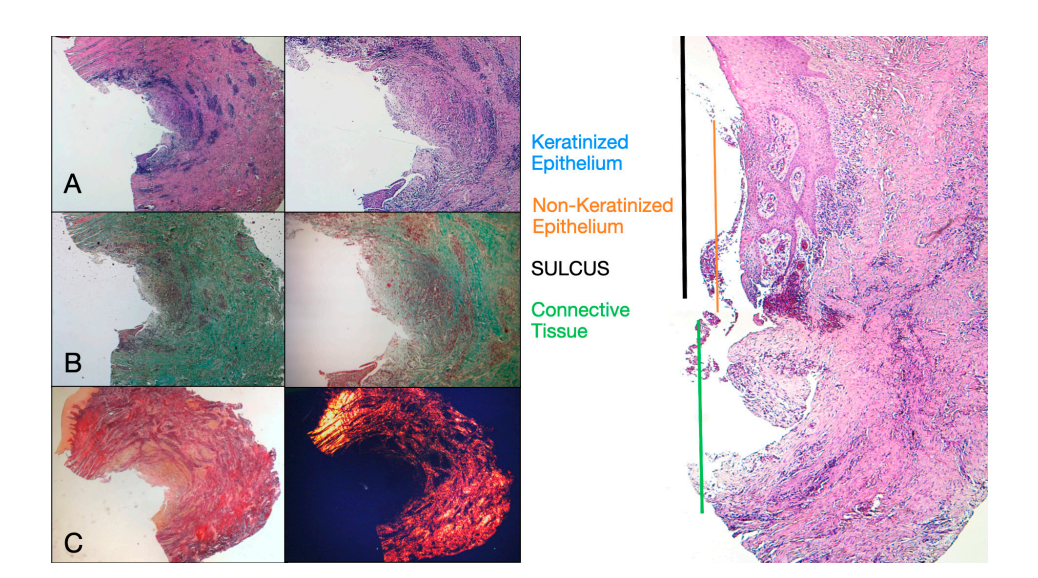
Das in den Längsschnitten analysierte Gewebe zeigte, wie der Sulcusbereich in zwei Teile unterteilt ist, die durch einen Bereich gekennzeichnet sind, der vom Zahnfleischrand ausgeht und von keratinisierendem Malpighianepithel ausgekleidet ist, und einen Bereich, der von einem weniger ausgeprägt keratinisierten Epithel ausgekleidet ist. Letzterer steht in Verbindung mit einem de-epithelialisierten Bereich, der ausschließlich aus lockerem Bindegewebe mit neu gebildeten Gefäßen besteht. Im Kontext des Bindegewebes gibt es ein lymphozytisches und plasmatisches Zellinfiltrat in den subepithelialen und perivaskulären Bereichen (Abbildung 1). Die Picro Sirius-Färbung des Längsschnitts, der 8 Wochen nach der Implantatfreilegung entnommen wurde, zeigt das Vorhandensein einiger Kollagenbündel, die aus dem angrenzenden Bindegewebe zum Knochen stammen und vertikal zum freien Rand des Zahnfleisches verlaufen, zusammen mit einer erheblichen Desorganisation der anderen Kollagenfasern (Abbildung 3).
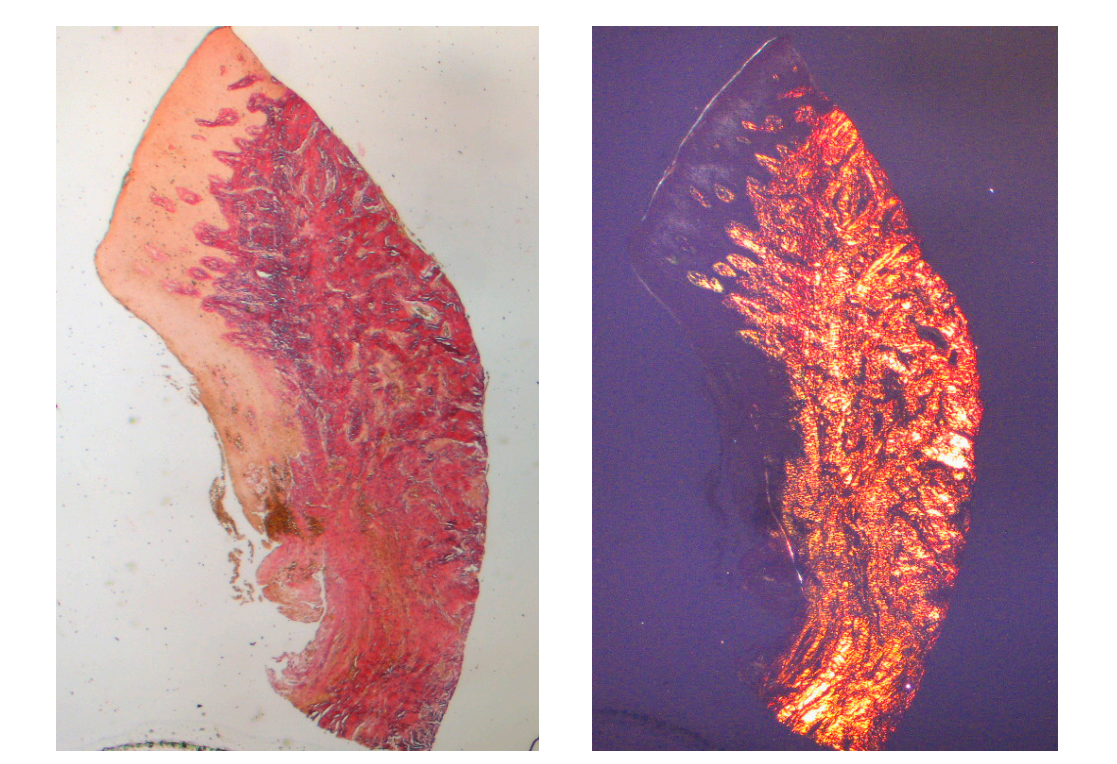
Die histochemische Querschnittsuntersuchung des Gewebes, das 16 Wochen nach der Freilegung des Implantats entnommen wurde, zeigt die teilweise Anwesenheit einer nicht-keratinisierten Epithelverkleidung am Implantatstandort, die aus reifem lockerem Bindegewebe besteht, das frei von entzündlichem Infiltrat ist. Das äußerste Bindegewebe ist organisierter als bei der vorherigen Probe. Die Kollagenbündel zeigten eine größere Organisation mit einem zirkumferenziellen Verlauf um das Abutment. Färbungen mit Massons Trichrom und Picro Sirius, letzteres auch unter polarisiertem Licht beobachtet, demonstrierten die fast ausschließliche Anwesenheit von Typ I Kollagen. Die mit diesen Färbungen erhaltenen Bilder zeigen deutlicher die Organisation und Orientierung der zirkulären Fasern. Die Färbung des Längsschnitts mit Picro Sirius zeigt, trotz der Artefakte, die vertikale Organisation der Kollagenfasern im unteren Teil des Stücks (Abbildung 4).
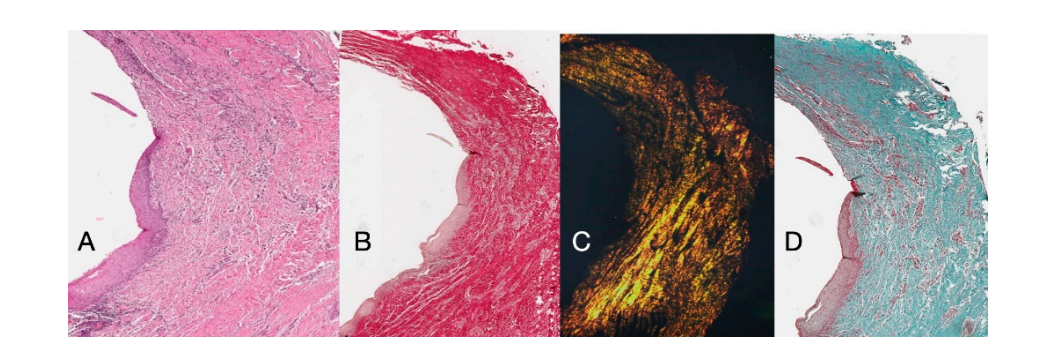
Die histochemischen Längsschnitte, die 16 Wochen nach der Freilegung des Implantats entnommen wurden, zeigten Sulcusbereiche, die in einen Bereich unterteilt waren, der vom gingivalen Rand ausgeht und mit keratinisierendem Malpighi-Epithel ausgekleidet ist, und einen Bereich, der mit nicht-keratinisiertem Epithel ausgekleidet ist. Letzteres ist kontinuierlich mit einem de-epithelialisierten Bereich, der ausschließlich aus Bindegewebe besteht. Das Bindegewebe bestand aus Kollagen vom Typ I und war frei von entzündlichem Infiltrat (Abbildung 5).
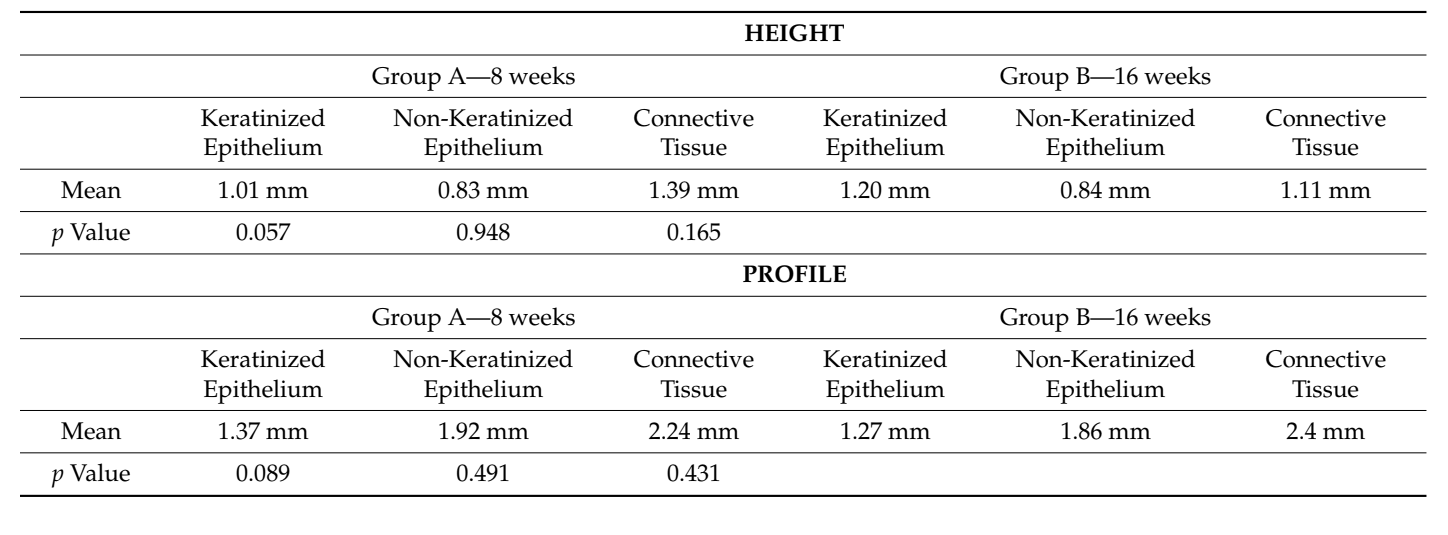
Schließlich zeigte die histologische Analyse keine statistisch signifikanten Unterschiede in der Zusammensetzung des Weichgewebes zu beiden Zeitpunkten sowohl in der Höhe als auch im Profil. Die durchschnittlichen biologischen Breiten, die nach 8 und 16 Wochen gemessen wurden, betrugen 3,2 und 3,1 mm in der Höhe und 5,5 im Profil bei beiden Nachuntersuchungen (Tabelle 1).
Die Beobachtung mit einem Elektronenmikroskop bei niedriger Vergrößerung (Abbildung 6A) der Proben zeigt, dass die peri-implantäre Mukosa frei von Entzündungen, Ödemen oder Blutextravasation ist. Rund um das Heilungsabutment ist das Vorhandensein von reifem Bindegewebe zu beobachten, das reich an ordentlich organisierten Kollagenfasern ist. Bei höheren Vergrößerungen (Abbildung 6B,C) sind gewundene Kollagenfasern sichtbar, die in ordentlicher und paralleler Weise organisiert sind; sie haben eine überwiegend kreisförmige Anordnung um das Abutment.
Um diese dichte Matrix genauer zu analysieren, wurden Bilder mit 300× und 500× Vergrößerung mit einem Rasterelektronenmikroskop aufgenommen. Bei diesen Vergrößerungen sind feine Kollagenfasern leicht zu beobachten, die von der Basalmembran ausgehen (Abbildung 6D,E) und als einzelne Fasern projizieren, die nicht in Bündeln organisiert sind.

Diskussion
Heute sind Zahnimplantate ein gängiges und äußerst effektives Verfahren zur Wiederherstellung fehlender Zähne. Die Untersuchung der Faktoren, die peri-implantäre Gewebe in einem stabilen und langfristig gesunden Zustand halten, war der Hauptfokus der Forschung zu Implantaten. Um den marginalen Knochenverlust zu reduzieren und die peri-implantären Weichgewebsniveaus aufrechtzuerhalten, wurden verschiedene Ansätze entwickelt, einschließlich Mikro- und Makro-Implantatdesigns, chirurgischen und prothetischen Verfahren, Plattformwechsel und Implantat-Abutment-Verbindungen.
Die Hauptfunktion der parodontalen Gewebe, neben der Befestigung des Zahns am Kiefer, ist der Schutz des Zahnfleisches; das heißt, ihre Funktion besteht darin, einen Verschluss gegen die kontaminierte Umgebung der Mundhöhle zu bieten, den Reibungskräften der Kaubewegungen standzuhalten und die Schnittstelle zwischen den Zähnen und dem Weichgewebe gegen fremde Eindringlinge zu verteidigen. Die biologische Breite um das Implantat unterscheidet sich in vielerlei Hinsicht von der um natürliche Zähne, einschließlich Konzept, Bildung, Remodellierung, Größe und Struktur, und spielt eine wichtige Rolle bei der Remodellierung der peri-implantären Weich- und Hartgewebe. In der vorliegenden Studie wurden peri-implantäre Weichgewebeproben 8 und 16 Wochen nach der Freilegung des Implantats und der Platzierung eines polycarbonat-halbkreisförmigen Heilungsabutments entnommen. Acht Wochen Heilung wurden als Kontrollbedingung gewählt. Das Vorhandensein einer natürlichen Barriere aus Bindegewebe und Epithelium nach 8 Wochen stimmt mit mehreren Studien überein, die Tierversuche durchgeführt haben. Die Proben, die nach 8 Wochen entnommen wurden, zeigten jedoch eine bescheidene Remodellierung, mit perivaskulären lymphozytären und Plasmazellinfiltraten, und die peri-implantären Gewebe wiesen morphostrukturelle Merkmale auf, die sich auf gesunde Gewebe überlagerten. Proben nach 16 Wochen zeigten eine vollständige Abwesenheit von Entzündungen und eine erhöhte Organisation der kollagenen Fasern, die kreisförmig um das Abutment angeordnet waren. Darüber hinaus gab es in den longitudinalen histologischen Schnitten ein morphostrukturelles Muster, bei dem der Sulcusbereich in zwei Teile unterteilt war, wobei ein Bereich vom Zahnfleischrand ausging und von keratinisierendem Malpighianepithel ausgekleidet war, und ein Bereich, der von weniger offensichtlich keratinisiertem Epithelium (JE) ausgekleidet war. Die Hauptanordnung der Fasern war in den longitudinalen Schnitten parallel zur Implantachse (Abbildung 4) und kreisförmig in den Querschnitten (Abbildung 3). Bei höheren Vergrößerungen, 300× und 500× (Abbildung 6B,C) konnten wellenförmige kollagene Fasern beobachtet werden, die ordentlich und parallel angeordnet waren. Diese Fasern wiesen hauptsächlich eine kreisförmige Organisation um das Abutment auf. Feine kollagene Fasern, die von der Basalmembran ausgehen und als einzelne Fasern projizieren, die nicht in Bündeln organisiert sind, konnten in den 3000× und 5000× SEM-Bildern (Abbildung 6D,E) leicht beobachtet werden.
Die vorliegende Studie zeigte, dass ein hemisphärisches Abutment-Design die Bildung eines strukturierten Bindegewebsmantels mit hochgradig ausgerichteten Fasern erleichtert, im Vergleich zur zufälligen Verteilung, die bei parallelwandigen Abutments zu beobachten ist. Dies deutet darauf hin, dass die Organisation der extrazellulären Matrix (ECM) durch die Geometrie des Gewebes im Makromaßstab beeinflusst werden kann, was die Anordnung der Fasern und die Morphogenese lenkt. Ähnliche Studien haben diesen Effekt bei Plattformwechsel-Implantaten beschrieben, bei denen die Kollagenorientierung eine mechanische Verankerung für parodontalen Fasern bietet. Tiermodelle haben ebenfalls suprakrestale zirkuläre Kollagenfaser-Netzwerke berichtet, die mit gingivalen Bändern vergleichbar sind.
Eine aktuelle präklinische Studie zeigte, dass ein konkaves transmukosales Design eine größere Ablagerung und das Wachstum von Bindegewebe im Vergleich zu einem geraden Design fördern könnte. Die Ergebnisse zeigten eine Zunahme der Bindegewebsdicke, ein dichteres peri-implantäres Netzwerk und eine Ausrichtung der Kollagenfasern in Richtung des Abutmentkragens, wodurch eine breite zirkuläre Kollagenstruktur um die Implantatplattform gebildet wurde. Die vorliegende Studie unterstützt diese Beobachtungen, da die Einführung eines hemisphärischen Profils die Anordnung der Kollagenfasern in gut organisierten parallelen Bündeln erleichterte.
Die Orientierung der Kollagenfasern ist ein entscheidender biomechanischer Faktor, der die Kräfte widerspiegelt, die auf das Bindegewebe wirken, insbesondere durch Kollagenbündel. Forschungen haben gezeigt, dass eine übermäßige Ansammlung von zufällig orientiertem Kollagen zur Bildung von dysfunktionalem fibrotischem Gewebe führen kann. Die gerichtete Organisation der Kollagenfasern ist entscheidend für die Stabilität des peri-implantären Weichgewebes, wie von Karjalainen et al. festgestellt wurde.
In der vorliegenden Studie betrugen die mittleren biologischen Breiten 3,2 und 3,1 mm nach 8 bzw. 16 Wochen. Im Vergleich zu den vorliegenden Ergebnissen mit anderen ähnlichen Studien ergab eine Studie von Tommasi et al., dass der durchschnittliche Wert nach 8 Wochen nach der Freilegung 2,7 mm betrug, einschließlich 1,5 mm Epithel und 1,2 mm Bindegewebe, während die Profilgröße 3,6 mm betrug. In der vorliegenden Studie waren die mittleren biologischen Breiten sowohl im Epithel als auch im Bindegewebe etwas höher. Allerdings wurde ein großer Anstieg für das gesamte Profil festgestellt. Der Hauptunterschied besteht darin, dass in der Tommasi-Studie die zweite Nachuntersuchung nach 12 Wochen und nicht nach 16 Wochen stattfand. Eine mögliche Erklärung für diesen Unterschied ist, dass das Gewebe mindestens 4 Monate nach der Wiedereröffnung weiter wächst.
Durch SEM ist es auch möglich, wellenförmige Kollagenfasern zu finden, die in einer ordentlichen und parallelen Weise organisiert sind, mit einer überwiegend kreisförmigen Anordnung um das Abutment.
In Bezug darauf kann angenommen werden, dass die vorherrschenden Anordnungen der kreisförmigen Kollagenbänder und der vertikalen Kollagenbänder in Bezug auf das Abutment-Design organisiert waren. Aus dieser Perspektive stellt die Möglichkeit, Implantate oder Implantat-Kronen-Systeme zu verwenden, die die Stabilität des mukösen Dichtungsbereichs fördern, einen wichtigen Forschungsbereich dar. Diese Lösung verschiebt die Bindegewebsdichtung apikal in Bezug auf die prothetischen Komponenten, deren Mikrobewegungen—die oft die stabile Bildung von Bindegewebe verhindern—die endgültige Stabilisierung der Dichtung nicht beeinträchtigen. Die Hauptbeschränkung der vorliegenden Forschung war die kleine Stichprobengröße, da keine Berechnung der Stichprobengröße durchgeführt wurde. Weitere klinische Studien mit größeren Stichproben sind erforderlich, um diese vorläufigen Ergebnisse zu bestätigen.
Schlussfolgerungen
Histologisch gab es keine Unterschiede in der Höhe und dem Profil des Zahnfleisches zwischen 8 und 16 Wochen Heilung nach der Freilegung des Implantats. Nach 16 Wochen wurde in beiden Gruppen mehr Gewebe gefunden. Eine größere Organisation der Kollagenfasern in zirkumferentialen Bahnen um die Abutments wurde in der Testgruppe (16 Wochen) im Vergleich zur Kontrollgruppe (8 Wochen) festgestellt.
Fabrizio Zaccheo, Giulia Petroni, Marco Tallarico, Cherana Gioga, Raffaella Carletti, Cira Rosaria Tiziana Di Gioia, Vincenzo Petrozza, Silvio Mario Meloni, Dario Melodia, Milena Pisano und Andrea Cicconetti
Literaturverzeichnis:
- Tallarico, M.; Lumbau, A.M.I.; Meloni, S.M.; Ieria, I.; Park, C.-J.; Zadroz˙ny, L.; Xhanari, E.; Pisano, M. Fünfjährige prospektive Studie über Implantatversagen und marginale Knochenumbauvorgänge bei Verwendung von Knochenlevel-Implantaten mit sandgestrahlter/äuregeätzter Oberfläche und konischer Verbindung. Eur. J. Dent. 2022, 16, 787–795. [CrossRef]
- Zheng, Z.; Ao, X.; Xie, P.; Jiang, F.; Chen, W. Die biologische Breite um das Implantat. J. Prosthodont. Res. 2021, 65, 11–18. [CrossRef]
- Berglundh, T.; Lindhe, J. Dimension der periimplantären Mukosa. Biologische Breite neu betrachtet. J. Clin. Periodontol. 1996, 23, 971–973. [CrossRef]
- Schierano, G.; Ramieri, G.; Cortese, M.; Aimetti, M.; Preti, G. Organisation der Bindegewebsbarriere um langfristig belastete Implantat-Abutments beim Menschen. Clin. Oral Implant. Res. 2002, 13, 460–464. [CrossRef]
- Rodríguez, X.; Navajas, A.; Vela, X.; Fortuño, A.; Jimenez, J.; Nevins, M. Anordnung der periimplantären Bindegewebsfasern um Plattformwechsel-Implantate mit konischen Abutments und deren Beziehung zum darunterliegenden Knochen: Eine humanhistologische Studie. Int. J. Periodontics Restor. Dent. 2016, 36, 533–540. [CrossRef]
- van Eekeren, P.; van Elsas, P.; Tahmaseb, A.; Wismeijer, D. Der Einfluss der initialen Mukosadicke auf die Veränderung des crestal Knochen bei ähnlichen makrogeometrischen Implantaten: Eine prospektive randomisierte klinische Studie. Clin. Oral Implant. Res. 2017, 28, 214–218. [CrossRef]
- Mishra, S.K.; Chowdhary, R.; Kumari, S. Mikroleckage an den verschiedenen Implantat-Abutment-Schnittstellen: Eine systematische Übersicht. J. Clin. Diagn. Res. 2017, 11, ZE10–ZE15. [CrossRef]
- Tallarico, M.; Canullo, L.; Caneva, M.; Özcan, M. Mikrobielle Besiedelung an der Implantat-Abutment-Schnittstelle und deren mögliche Einfluss auf Periimplantitis: Eine systematische Übersicht und Metaanalyse. J. Prosthodont. Res. 2017, 61, 233–241. [CrossRef]
- Schroeder, H.E.; Listgarten, M.A. Die gingivalen Gewebe: Die Architektur des parodontalen Schutzes. Periodontology 2000 1997, 13, 91–120. [CrossRef]
- Schupbach, P.; Glauser, R. Die Verteidigungsarchitektur der menschlichen periimplantären Mukosa: Eine histologische Studie. J. Prosthet. Dent. 2007, 97 (Suppl. S6), S15–S25, Erratum in J. Prosthet. Dent. 2008, 99, 167. [CrossRef]
- James, R.A.; Schultz, R.L. Hemidesmosomen und die Adhäsion von junctionalen Epithelzellen an Metallimplantate—Ein vorläufiger Bericht. J. Oral Implantol. 1974, 4, 294–302.
- Atsuta, I.; Ayukawa, Y.; Kondo, R.; Oshiro, W.; Matsuura, Y.; Furuhashi, A.; Tsukiyama, Y.; Koyano, K. Weichgewebsversiegelung um Zahnimplantate basierend auf histologischer Interpretation. J. Prosthodont. Res. 2016, 60, 3–11. [CrossRef]
- Berglundh, T.; Abrahamsson, I.; Welander, M.; Lang, N.P.; Lindhe, J. Morphogenese der periimplantären Mukosa: Eine experimentelle Studie an Hunden. Clin. Oral Implant. Res. 2007, 18, 1–8. [CrossRef] [PubMed]
- Moraschini, V.; Poubel, L.d.C.; Ferreira, V.; Barboza, E.d.S. Bewertung der Überlebens- und Erfolgsraten von Zahnimplantaten, die in longitudinalen Studien mit einer Nachbeobachtungszeit von mindestens 10 Jahren berichtet wurden: Eine systematische Übersicht. Int. J. Oral Maxillofac. Surg. 2015, 44, 377–388. [CrossRef]
- Atieh, M.A.; Ibrahlm, H.M.; Atieh, H.A. Plattformwechsel zur Erhaltung des marginalen Knochengewebes um Zahnimplantate: Eine systematische Übersicht und Metaanalyse. J. Periodontol. 2010, 81, 1350–1366.
- Bateli, M.; Att, W.; Strub, J.R. Implantat-Hals-Konfigurationen zur Erhaltung des marginalen Knochenlevels: Eine systematische Übersicht. Int. J. Oral Maxillofac. Implant. 2011, 26, 290–303.
- Schwarz, F.; Hegewald, A.; Becker, J. Einfluss der Implantat-Abutment-Verbindung und der Positionierung des bearbeiteten Kragens/Mikrospalts auf die Veränderungen des crestal Knochenlevels: Eine systematische Übersicht. Clin. Oral Implant. Res. 2014, 25, 417–425. [CrossRef]
- Tetè, S.; Mastrangelo, F.; Bianchi, A.; Zizzari, V.; Scarano, A. Orientierung der Kollagenfasern um bearbeitete Titan- und Zirkonia-Zahnimplantat-Hälse: Eine Tierstudie. Int. J. Oral Maxillofac. Implant. 2009, 24, 52–58.
- Schwarz, F.; Herten, M.; Sager, M.; Bieling, K.; Sculean, A.; Becker, J. Vergleich von natürlich vorkommenden und ligaturinduzierten periimplantären Knochenfehlern bei Menschen und Hunden. Clin. Oral Implant. Res. 2007, 18, 161–170, Erratum in Clin. Oral Implant. Res. 2007, 18, 397. [CrossRef] [PubMed]
- Vignoletti, F.; Johansson, C.; Albrektsson, T.; De Sanctis, M.; Roman, F.S.; Sanz, M. Frühe Heilung von Implantaten, die in frische Extraktionssocket gesetzt wurden: Eine experimentelle Studie am Beagle-Hund. De novo Knochenbildung. J. Clin. Periodontol. 2009, 36, 265–277. [CrossRef] [PubMed]
- Liu, Y.; Wang, J. Einflüsse von Mikrospalt und Mikrobewegung der Implantat-Abutment-Schnittstelle auf den marginalen Knochenverlust um den Implantathals. Arch. Oral Biol. 2017, 83, 153–160. [CrossRef] [PubMed]
- Rodríguez, X.; Vela, X.; Calvo-Guirado, J.L.; Nart, J.; Stappert, C.F.J. Einfluss des Plattformwechsels auf die Orientierung der Kollagenfasern und die Knochenresorption um Zahnimplantate: Eine vorläufige histologische Tierstudie. Int. J. Oral Maxillofac. Implant. 2012, 27, 1116–1122.
- Nelson, C.M. Geometrische Kontrolle der Gewebemorphogenese. Biochim. Biophys. Acta BBA Mol. Cell Res. 2009, 1793, 903–910. [CrossRef] [PubMed]
- López-López, P.J.; Mareque-Bueno, J.; Boquete-Castro, A.; Aguilar-Salvatierra Raya, A.; Martínez-González, J.M.; Calvo-Guirado, J.L. Die Auswirkungen von Heilungsabutments unterschiedlicher Größe und anatomischer Form, die sofort in Extraktionssocket platziert werden, auf periimplantäre harte und weiche Gewebe. Eine Pilotstudie an Foxhound-Hunden. Clin. Oral Implant. Res. 2016, 27, 90–96. [CrossRef]
- Covani, U.; Giammarinaro, E.; Di Pietro, N.; Boncompagni, S.; Rastelli, G.; Romasco, T.; Velasco-Ortega, E.; Jimenez-Guerra, A.; Iezzi, G.; Piattelli, A.; et al. Elektronenmikroskopische (EM) Analyse von Kollagenfasern in den periimplantären Weichgeweben um zwei verschiedene Abutments. J. Funct. Biomater. 2023, 14, 445. [CrossRef]
- Belloni, A.; Belloni, A.; Furlani, M.; Furlani, M.; Greco, S.; Greco, S.; Notarstefano, V.; Notarstefano, V.; Pro, C.; Pro, C.; et al. Uterine Leiomyom als nützliches Modell zur Aufdeckung des morphometrischen und makromolekularen Kollagenzustands und der Beeinträchtigung bei fibrotischen Erkrankungen: Eine ex-vivo menschliche Studie. Biochim. Biophys. Acta BBA Mol. Basis Dis. 2022, 1868, 166494. [CrossRef]
- Karjalainen, V.-P.; Kestilä, I.; Finnilä, M.; Folkesson, E.; Turkiewicz, A.; Önnerfjord, P.; Hughes, V.; Tjörnstrand, J.; Englund, M.; Saarakkala, S. Quantitative dreidimensionale Analyse der Kollagenorientierung im hinteren Horn des menschlichen Meniskus in Gesundheit und Osteoarthritis unter Verwendung von Mikro-Computertomographie. Osteoarthr. Cartil. 2021, 29, 762–772. [CrossRef]
- Tomasi, C.; Tessarolo, F.; Caola, I.; Wennström, J.; Nollo, G.; Berglundh, T. Morphogenese der periimplantären Mukosa neu betrachtet: Eine experimentelle Studie am Menschen. Clin. Oral Implant. Res. 2014, 25, 997–1003. [CrossRef]