Einsatz der Vakuum-Plasma-Oberflächenbehandlung zur Verbesserung der Knochenheilung und -regeneration bei Socket Preservation und GBR: Eine Fallserie mit histologischer Analyse
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Zweck: Bewertung der klinischen und histologischen Ergebnisse von Patienten, die implantatgestützte Kronen nach der Vakuum-Plasma-Oberflächenbehandlung (VPST) von Biomaterialien erhalten, die in der Alveolenerhaltung (SP) und der geführten Knochenregeneration (GBR) verwendet werden.
Materialien und Methoden: Diese Studie wurde als Fallserie konzipiert. Patienten, die eine Zahnextraktion und Alveolenerhaltung oder geführte Knochenregeneration benötigten, wurden eingeschlossen. Die Technik der Alveolenerhaltung wurde nach der Zahnextraktion unter Verwendung eines heterologen Kollagenknochen-Transplantats und einer Kollagen-Xenomatrix durchgeführt, die beide mit Vakuumplasma aktiviert wurden. In der Zwischenzeit wurde eine zweistufige horizontale Kieferaugmentation unter Verwendung eines maßgeschneiderten Titan-Meshs und einer Mischung aus autologen (unbehandelten) und heterologen (behandelten) Knochen-Transplantaten sowie einer behandelten Kollagenmembran durchgeführt. ACTILINK Reborn mit Universal Vortex Holder (Plasmapp Co., Ltd., Daejeon, Republik Korea) wurde verwendet, um alle Biomaterialien zu behandeln. Die Ergebnisparameter waren Implantat- und Prothesenausfälle, Komplikationen und histologische Untersuchungen. Weich- und Hartgewebeproben wurden zum Zeitpunkt der Implantation nur bei Patienten entnommen, die mit SP behandelt wurden.
Ergebnisse: Insgesamt wurden sechs Patienten behandelt - drei mit Socket-Erhaltung und verzögerter Implantation, und drei mit gestufter GBR. Kein Implantat oder Prothese ist fehlgeschlagen. Ein maßgeschneiderter Titan-Mesh brach nach der Plasmabehandlung und musste durch eine Perikardmembran ersetzt werden. Es traten keine weiteren Komplikationen auf. Die histologische Analyse drei Monate nach der Operation zeigte gut durchblutetes neu gebildetes Knochengewebe in verschiedenen Reifungsstadien mit integrierten Knochenersatzpartikeln, während das Weichgewebe physiologisch strukturiert erschien.
Fazit: VPST könnte die Hydrophilie von Biomaterialien verbessern und somit günstige Heilungsergebnisse in SP und GBR unterstützen. Weitere randomisierte kontrollierte Studien mit angemessenen Stichprobengrößen sind erforderlich, um diese vorläufigen Ergebnisse zu bestätigen.
Einleitung
Die orale Implantologie wird als sichere und effektive klinische Methode anerkannt, die langfristigen Erfolg in der oralen Rehabilitation gewährleisten kann. Die Ursprünge dieses medizinischen Fachgebiets reichen bis in die frühen 1950er Jahre zurück, als Dr. Per-Ingvar Brånemark, ein schwedischer Orthopäde, bahnbrechende Entdeckungen machte, während er orthopädische Experimente an Hasenbeinen durchführte. Seitdem hat sich das Fachgebiet rasant weiterentwickelt, angetrieben von Fortschritten in Biomaterialien und chirurgischen Techniken, was zu verbesserten Ergebnissen und höherer Patientenzufriedenheit führte.
Derzeit wird ein Implantat als osseointegriert betrachtet, wenn es keine progressive relative Bewegung zwischen dem Implantat und dem umgebenden Knochen gibt, was auf direkten Kontakt und Stabilität hinweist. Die primäre Stabilität wird maßgeblich durch mechanisches Verkeilen zwischen der Implantatoberfläche und dem Wirtknochen beeinflusst, was von Faktoren wie Knochendichte, Implantatdesign und chirurgischer Technik abhängt.
Die Erreichung und Aufrechterhaltung einer langfristigen Osseointegration ist komplex und kann von verschiedenen biologischen und mechanischen Faktoren beeinflusst werden. Dazu gehören die systemische Gesundheit des Patienten, die lokale Knochenqualität, die Belastungsbedingungen des Implantats und die Oberflächenmerkmale des Implantats. Jüngste Studien legen nahe, dass die Modifizierung von Implantatoberflächen zur Verbesserung ihrer biologischen Verträglichkeit die Ergebnisse der Osseointegration erheblich verbessern kann. Zahlreiche Oberflächenbehandlungsverfahren wurden untersucht und implementiert, um die biologischen Oberflächenmerkmale von Implantaten zu verbessern und den Osseointegrationsprozess sowohl für kurzfristigen als auch für langfristigen Erfolg zu unterstützen. Unter diesen sind Oberflächenrauhigkeit und Hydrophilie besonders wichtig, um einen hohen Kontakt zwischen Knochen und Implantat (BIC) zu erreichen. Diese Oberflächenmerkmale sind darauf ausgelegt, während des Heilungsprozesses eine bessere Stabilität zu bieten und eine schnellere Implantatbelastung zu ermöglichen, indem sie den Osseointegrationsmechanismus beschleunigen und eine stärkere, schnellere Knochenbildung fördern.
Um die Osteokonduktivität und Osteoinduktivität von Biomaterialien für die Knochenregeneration zu verbessern, hat sich gezeigt, dass die Modifikation ihrer Oberfläche die Zelladhäsion, Proliferation und die Bildung neuen Knochens fördert. Diese Behandlungen umfassen additive Modifikationen wie Beschichtungen oder subtraktive Modifikationen wie Ätzen, Sandstrahlen und andere. Unter den verschiedenen Biomaterialbehandlungen, die darauf abzielen, die Osseointegration zu verbessern, hat die Plasmabehandlung signifikante Verbesserungen der Zelladhäsion gezeigt, indem die Oberflächenrauhigkeit und Benetzbarkeit modifiziert wurden. Die Plasmaaktivierung verändert die Oberfläche, indem funktionelle Gruppen integriert, die Oberflächenenergie erhöht und die Hydrophilie verbessert wird. Dies führt zu einer Verringerung des Kontaktwinkels zwischen biologischen Flüssigkeiten und der Implantatoberfläche, was die Diffusion von osteoblastischen Zellen erleichtert, ohne Rückstände nach der Behandlung zu hinterlassen. Darüber hinaus induziert die Plasmabehandlung Veränderungen der physikochemischen Eigenschaften, einschließlich der freien Oberflächenenergie, des Kohlenwasserstoffgehalts und der Anwesenheit funktioneller Hydroxylgruppen. Jüngste Fortschritte in der Plasmatechnologie haben die Entwicklung von Niederdruckplasma-Systemen ermöglicht, die in der Lage sind, komplexe Implantatgeometrien gleichmäßig zu behandeln. Diese Systeme bieten eine präzise Kontrolle über Behandlungsparameter wie Leistung, Gaszusammensetzung und Expositionszeit, was maßgeschneiderte Oberflächenmodifikationen zur Verbesserung der Biokompatibilität ermöglicht. Trotz vielversprechender In-vitro-Ergebnisse bleibt jedoch der klinische Nachweis über plasmabehandelte Biomaterialien begrenzt, was weitere Untersuchungen erforderlich macht. Trotz der vielversprechenden Ergebnisse aus In-vitro-Studien bleibt der klinische Nachweis über die Wirksamkeit plasmabehandelter Biomaterialien begrenzt, was weitere Untersuchungen erforderlich macht.
Das Ziel dieses klinischen Audits ist es, die klinischen und histologischen Ergebnisse von Patienten zu bewerten, die implantatgestützte Kronen nach VPST von Biomaterialien erhalten, die in der Socket Preservation (SP) und der geführten Knochenregeneration (GBR) verwendet werden. Die Ergebnisse dieser Forschung sollen bestehende klinische Protokolle informieren und potenziell verfeinern, um einen genaueren und vorhersehbareren Ansatz in der oralen Rehabilitation zu ermöglichen. Daher kann dieses klinische Audit als Machbarkeitsstudie dienen.
Materialien und Methoden
Diese Studie wurde als Phase-IV-Fallserie konzipiert, wobei CE-zugelassene Materialien und Geräte im Rahmen der üblichen beruflichen Praxis und ohne zusätzliche Risiken verwendet wurden. Alle Fälle wurden in einer Privatklinik in Rom, Italien, durchgeführt, und die Daten wurden an der Abteilung für Medizin, Chirurgie und Pharmazie der Universität Sassari, Italien, ausgewertet. Die Studie hielt sich an die Prinzipien der Helsinkier Deklaration von 2013 und die Prinzipien der Guten Medizinischen Praxis. Medizinische Daten wurden anonymisiert, sodass Patienten nicht identifiziert werden konnten, und die Genehmigung des Ethikkomitees für die Einwilligung zu einer Fallserie wurde eingeholt (Berichtsnummer 41/1.6; veröffentlicht am 21. Mai 2025).
Patienten, die eine atraumatische Zahnextraktion eines hoffnungslosen Zahns und ein Verfahren zur Erhaltung des Alveolarknochens benötigen, sowie Patienten, die ein Verfahren zur geführten Knochenregeneration vor der Implantation benötigen, wurden in diese Studie aufgenommen.
Einschlusskriterien:
- Patienten mit mindestens einem hoffnungslosen Zahn im Unterkiefer oder Oberkiefer, mit intaktem post-extraktivem Alveolus, die in der Lage sind, die Informationen zu verstehen und eine informierte Zustimmung zu geben, wurden als für die Erhaltung des Alveolarknochens geeignet erachtet; oder alle Patienten, die eine Einzelimplantat-getragene Restauration und gestufte horizontale geführte Knochenregeneration (Defekt der Klasse IV gemäß Cawed und Howell) im Unterkiefer oder Oberkiefer benötigten. Ein hoffnungsloser Zahn wurde definiert als ein Zahn mit schwerwiegenden strukturellen, parodontalen oder endodontischen Schäden, die nicht vorhersehbar behandelt oder erhalten werden konnten und zur Extraktion empfohlen wurden. Häufige Kriterien zur Klassifizierung eines Zahns als hoffnungslos umfassen: schwere Parodontalerkrankung mit ≥75% Knochenverlust, Mobilität (Grad III) oder Klasse III Furkationsbeteiligung; umfangreiche Karies oder Frakturen, die den Zahn nicht restaurierbar machen; erfolglose endodontische Behandlung mit persistierender Infektion; und Trauma, das zu nicht lebensfähigen Wurzeln oder schwerer Verschiebung führt.
- Alter von 18 Jahren oder älter und in der Lage, eine informierte Zustimmung zu geben.
- Raucher wurden kategorisiert als: (1) Nichtraucher; (2) moderate Raucher (Rauchen von bis zu 10 Zigaretten/Tag); und (3) starke Raucher (Rauchen von mehr als 11 Zigaretten/Tag). Starke Raucher wurden ausgeschlossen, nur die Kategorien 1 und 2 wurden in diese Studie einbezogen.
- Der Biotyp wurde kategorisiert als: dünn (≤1 mm), mittel (>1–<2 mm) oder dick (≥2 mm). Ausschlusskriterien:
- Allgemeine Kontraindikationen für die Implantatchirurgie
- Patienten, die im Kopf- und Halsbereich bestrahlt wurden.
- Immunsupprimierte oder immungeschwächte Patienten.
- Patienten, die mit intravenösen Amino-Bisphosphonaten behandelt wurden oder werden.
- Patienten mit unbehandelter Parodontitis.
- Patienten mit schlechter Mundhygiene und Motivation.
- Unkontrollierter Diabetes.
- Starke Raucher (mehr als 11 Zigaretten/Tag).
- Schwangerschaft oder Stillzeit.
- Substanzmissbrauch.
- Psychiatrische Probleme oder unrealistische Erwartungen.
- Fehlen eines antagonistischen, okkludierenden Gebisses im Bereich, der für die Implantation vorgesehen ist.
- Patienten mit Infektionen und/oder Entzündungen im Bereich, der für die Implantation vorgesehen ist.
- Patienten, die an anderen Studien teilnehmen, wenn das vorliegende Protokoll nicht ordnungsgemäß eingehalten werden kann.
- Patienten, die nur zur Implantation überwiesen wurden und im Behandlungszentrum nicht nachverfolgt werden können.
- Patienten, die nicht über einen Zeitraum von 5 Jahren nachverfolgt werden können.
2.1. Verfahren zur Erhaltung des Zahnfachs
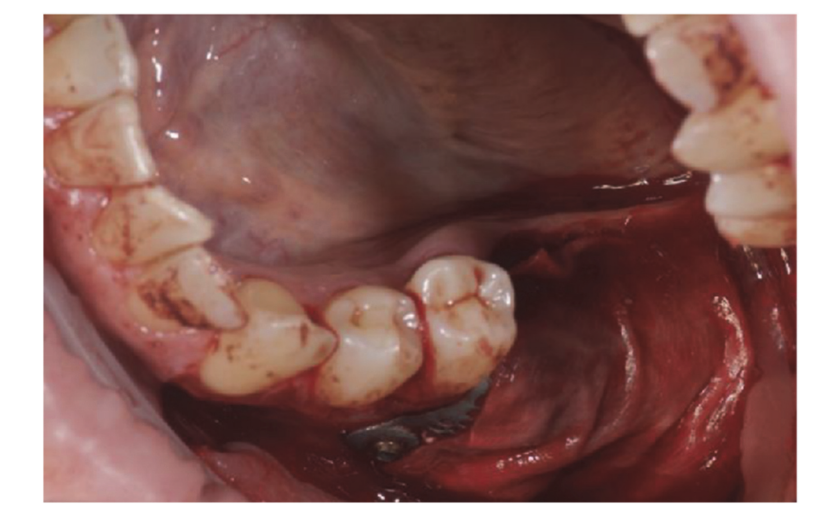
Patienten, die die Einschluss-/Ausschlusskriterien (Abbildung 1) erfüllten, wurden gründlich klinisch untersucht, um Karies und die Gesundheit des Zahnfleisches zu bewerten. Vor dem Verfahren zur Erhaltung des Zahnfachs unterzogen sich die Patienten einem präoperativen CBCT-Scan, um das Knochenvolumen zu quantifizieren. Nachdem die Eignung bestätigt und die informierte Einwilligung eingeholt wurde, wurde eine umfassende orale Untersuchung durchgeführt, um die allgemeine Mundgesundheit zu bewerten und etwaige Pathologien zu identifizieren, die vor der Erhaltung des Zahnfachs und der Implantatrehabilitation behandelt werden mussten. Ungefähr 10 Tage vor der Erhaltung des Zahnfachs und der Implantation erhielten alle Patienten eine professionelle Mundhygiene, einschließlich der notwendigen Entfernung von Belägen. Die prophylaktische Verabreichung von Antibiotika umfasste 2 g Amoxicillin eine Stunde vor der Operation oder 600 mg Clindamycin im Falle einer Penicillinallergie. Die Patienten spülten auch eine Minute lang mit einer 0,2%igen Chlorhexidin-Mundspülung vor jedem chirurgischen Eingriff. Alle chirurgischen Eingriffe wurden unter örtlicher Betäubung mit Articain und Adrenalin (1:100.000) durchgeführt. Eine intravenöse Sedierung war optional. Eine atraumatische Zahnextraktion ohne Lappenhebung wurde durchgeführt, gefolgt von der Kürettage des Alveolus, der Beurteilung der alveolären Integrität und der Erhaltung des Zahnfachs (Abbildung 2). Die post-extraktions Zahnfächer wurden mit heterologem Knochenersatz gefüllt, der aus natürlichen equinen Knochengranulaten (Bioactiva, Arcugnano, Italien) bestand, und mit XC Collagen Xenomatrix (Bioteck S.p.A, Vicenza, Italien) abgedeckt. Die Vakuum-Plasma-Oberflächenbehandlung wurde mit der ACTILINK reborn Maschine (Activelink reborn, Plasmapp Co., Ltd., Daejeon, Republik Korea) unter Verwendung eines maßgeschneiderten Halters (Abbildung 3) gemäß einem veröffentlichten Protokoll durchgeführt. Die Zykluszeit der Vakuum-Plasma-Oberflächenbehandlung, genannt Vortex Plasma-Modus, betrug 30 s.
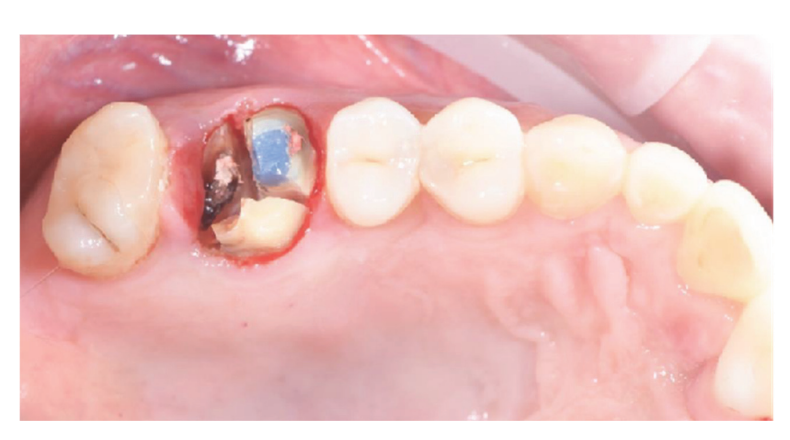

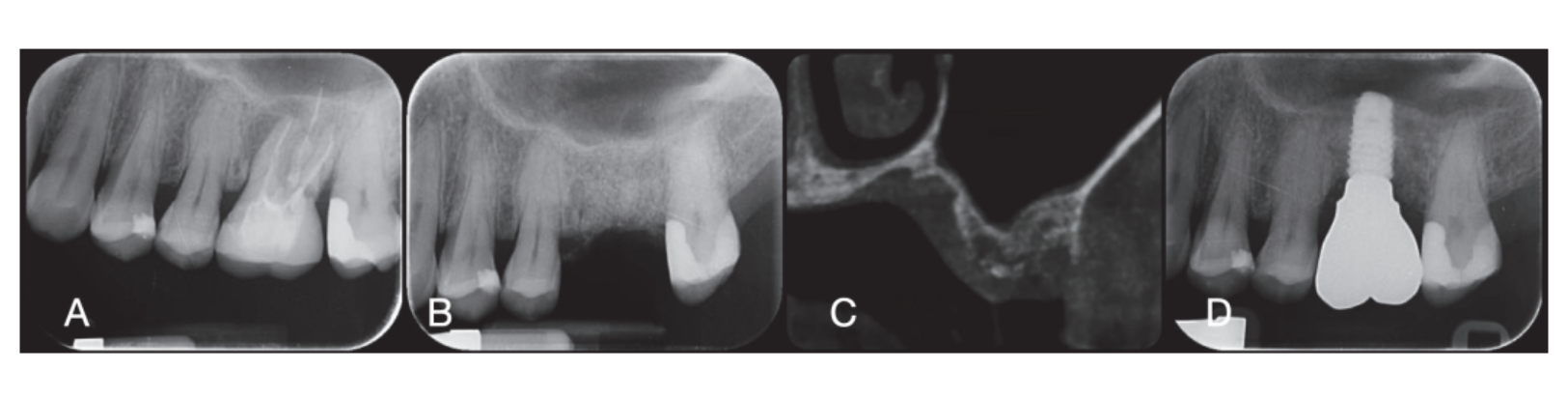
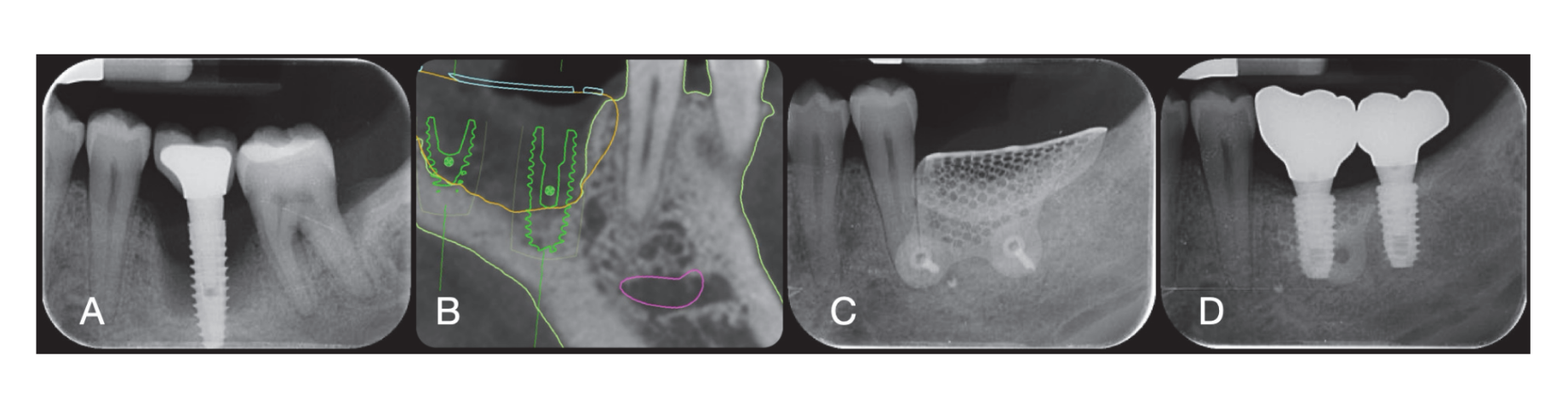
Die chirurgischen Stellen wurden dann mit Vicryl 4.0 einfachen Nähten (Revello S.p.A, Verona, Italien) (Abbildung 4) verschlossen. Nach einer Heilungszeit von drei Monaten wurde die Implantation (Osstem Implant, Seoul, Republik Korea) gemäß den Anweisungen des Herstellers durchgeführt. Histologische Gewebeproben wurden unmittelbar vor der Vorbereitung des Implantatstandorts entnommen (siehe Abschnitte 2.3 und 2.4). Die Implantatstandorte wurden freihändig, ohne chirurgische Schablone, mit Bohrern zunehmenden Durchmessers vorbereitet. Die Knochenqualität wurde subjektiv als hart, mittel oder weich kategorisiert. Das Motor-Drehmoment wurde während der Implantation auf 35 Ncm eingestellt. Die Implantate wurden 1,5 mm unter dem intakten buccalen Knochen platziert, und ein sofortiges Belastungsprotokoll wurde mit einem minimalen Einführdrehmoment von 35 Ncm angenommen. Eine postchirurgische Schmerzbehandlung mit Ibuprofen 600 mg wurde nach Bedarf verschrieben. Alle Patienten wurden streng überwacht, um die vollständige Heilung zu bewerten. Drei bis vier Monate nach der sofortigen Belastung wurden definitive Abdrücke genommen, und innerhalb eines Monats wurde eine schraubengehaltene, implantatgestützte, metallfreie Einzelkrone geliefert. Periapikale Röntgenaufnahmen wurden zum Zeitpunkt der Implantation angefertigt (Abbildung 5).
2.2. Postoperative Anweisungen und prothetische Phase nach der Socket-Erhaltung
Eine weiche Diät wurde für 30 Tage im Falle einer Sofortbelastung empfohlen. Ibuprofen (400 mg) wurde verschrieben, um 2–4 Mal täglich während der Mahlzeiten eingenommen zu werden, jedoch wurden die Patienten angewiesen, es nicht ohne Schmerzen einzunehmen (im Falle von Allergien oder Magenproblemen wurde stattdessen 1 g Paracetamol verschrieben). Zusätzlich wurde eine 0,2%ige Chlorhexidin-Mundspülung für 1 Minute zweimal täglich über 14 Tage empfohlen. Den Patienten war es nicht erlaubt, herausnehmbare Prothesen zu tragen, die die Studienimplantate belasten könnten. Die Nähte wurden nach 7 bis 10 Tagen entfernt, und es wurden Anweisungen zur Mundhygiene gegeben.
Zum Zeitpunkt der Implantatinsertion wurden sofort belastbare temporäre Restaurationen geliefert. Nach der Osseointegration (8 Wochen) wurden die temporären Restaurationen gemäß dem Weichgewebemanagement modifiziert. Nach 3 bis 4 Monaten wurde ein definitiver, digitaler oder analoger Abdruck genommen. Definitive Restaurationen wurden innerhalb eines Monats nach der Überprüfung der Stabilität der einzelnen Implantate geliefert. Die okklusale Fläche stand in leichtem Kontakt mit der gegenüberliegenden Dentition. Periapikale Röntgenaufnahmen und klinische Bilder der Studienimplantate wurden aufgenommen (Abbildung 5). Wenn die peri-implantären marginalen Knochenlevels nicht lesbar waren, wurde ein neues Röntgenbild aufgenommen, und es wurden Anweisungen zur Mundhygiene gegeben.
2.3. Biopsieentnahme
Nach drei Monaten wurde die Implantation (Osstem Implant, Seoul, Republik Korea) gemäß den Anweisungen des Herstellers durchgeführt. Während der Vorbereitung des Implantatstandorts wurden Weich- und Hartgewebe-Biopsien mit einem 5 mm Mucotome (Außendurchmesser) für Weichgewebe und einem 3,0 mm (Außendurchmesser) Trephine-Bohrer für Knochenproben entnommen. Hartgewebeproben wurden in 10% neutral gepuffertem Formalin und Weichgewebe in 4% neutral gepuffertem Formalin für histologische Untersuchungen fixiert.
2.4. Probenverarbeitung und histologische Analyse
Hartgewebeproben wurden mit einer aufsteigenden Ethanollösung dehydriert. Nach der Dehydrierung wurden die Proben mit methacrylatbasierter Harz infiltriert und anschließend eingebettet. Die Blöcke wurden mit einer Diamantklinge geschnitten und auf eine Dicke von etwa 100 µm reduziert. Die Schnitte wurden auf Kunststoffobjektträger montiert, geklebt und mit Toluidinblau und gelbem Pyronin gefärbt.
Formalin-fixierte Weichgewebsproben wurden in Paraffin eingebettet. Histologische Schnitte wurden angefertigt und mit Hämatoxylin und Eosin, Mallory-Trichrom und Siriusrot gefärbt. Die Schnitte wurden qualitativ unter einem hellfeldoptischen Mikroskop (Nikon Eclipse 80i, Nikon, Tokio, Japan) und einem hochauflösenden Scanner bei unterschiedlichen Vergrößerungen (Hamamatzu NanoZoomer Series S60, Hamamatzu Photonics, Hamamatsu, Japan) untersucht. Darüber hinaus wurden Siriusrot-färbte Proben unter polarisiertem Licht beobachtet, um die Organisation der Kollagenfasern zu bewerten (Nikon Eclipse 80i, Nikon, Tokio, Japan).
2.5. GBR-Verfahren
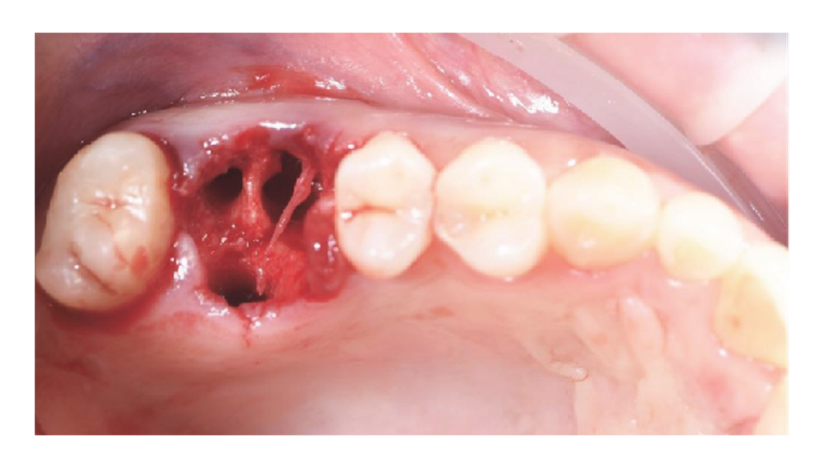
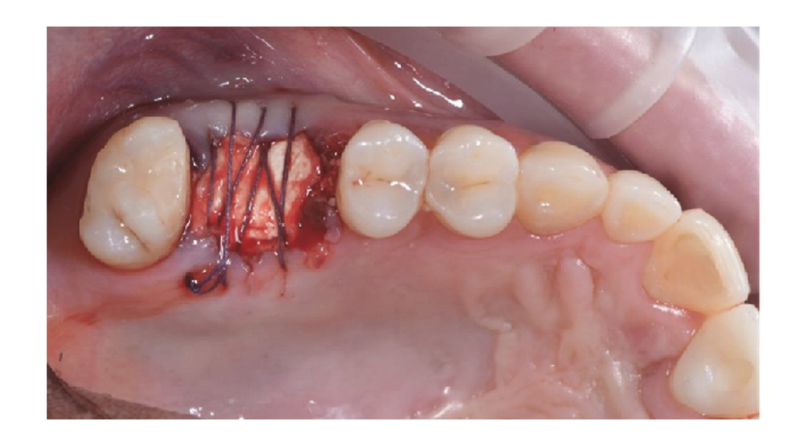
Die Patienten wurden auf ihre Eignung für die Studie bewertet. Für jeden Patienten wurde ein präoperativer CBCT-Scan durchgeführt, um das Knochenvolumen zu quantifizieren. Patienten, die nicht über ausreichend Knochenvolumen für die Implantation verfügten, wurden über die Studieninhalte informiert und unterzeichneten das Einwilligungsformular zur Forschung. Nachdem die Eignung bestätigt und die informierte Einwilligung eingeholt wurde, wurde eine gründliche orale Untersuchung durchgeführt, um die allgemeine Gesundheit zu bewerten und etwaige orale Pathologien zu identifizieren, die vor der geführten Knochenregeneration (GBR) und der Implantatrehabilitation behandelt werden mussten. Zehn Tage vor der GBR und der Implantation unterzogen sich alle Patienten professionellen Mundhygieneverfahren, einschließlich der notwendigen Debridements. Fehlgeschlagene Zähne an den operativen Stellen wurden acht Wochen vor der GBR und der Implantation extrahiert. Die Patienten erhielten eine Stunde vor der Operation 2 g Amoxicillin (Zimox, Pfizer, Rom, Italien), gefolgt von 1 g zweimal täglich für zwei Wochen. Bei Penicillinallergie wurden 600 mg Clindamycin mit demselben postoperativen Regime verabreicht. Unmittelbar vor der Operation spülten die Patienten eine Minute lang mit einer 0,2%igen Chlorhexidinlösung (Curasept, Curaden Healthcare, Saronno, Italien). Der chirurgische Eingriff wurde unter bewusster Sedierung (Diazepam, Hoffmann-La Roche, Basel, Schweiz) und lokaler Anästhesie (Septanest mit Adrenalin 1/100.000, Septodont, Saint-Maur-des-Fossés, Frankreich) durchgeführt. Ein mittiger inzisionaler Schnitt (leicht bukkal vorverlagert) wurde in das verbleibende keratinisierte Gewebe mit einer chirurgischen Klinge Nr. 15 gemacht, gefolgt von zwei bilateralen vertikalen Schnitten ein oder zwei Zähne entfernt. Ein Volldickenschlitz wurde über die mukogingivale Grenze hinaus angehoben, mindestens 5 mm über den Knochendefekt hinaus, und die Empfängerstelle wurde gründlich von Weichgeweberesten befreit. Autogenes Knochenmaterial wurde von der geplanten Implantationsstelle oder dem mandibulären retro-molaren Bereich mit einem minimal-invasiven kortikalen Knochenentnehmer (Micross, Meta, Reggio Emilia, Italien) entnommen. Der Knochendefekt wurde dann mit einer 50:50-Mischung aus autogenem Knochen und heterologem Knochenersatz (natürliche equine Knochengranulate, Bioactiva, Arcugnano, Italien), die mit Vortex Plasma unter Verwendung des Materialhalters vorbehandelt wurde, gefüllt. Ein plasma-behandeltes, CAD/CAM-gestaltetes Titannetz (Exocad DentalCAD, Exocad, Darmstadt, Deutschland), das basierend auf der Kontur und Form der kontralateralen Region angepasst wurde (New Ancorvis Srl, Bargellino, Calderara di Reno, Italien), wurde dann platziert, um die transplantierte Stelle zu bedecken und zu schützen. Das angepasste Titannetz wurde mit zwei bis drei vorgeplanten Schrauben fixiert und mit einer plasma-behandelten Perikardmembran (Bioactiva, Arcugnano, Italien) abgedeckt (Abbildungen 6 und 7). Eine spannungsfreie Wundverschluss wurde mit Vicryl 4.0 Nähten erreicht. Postoperativ erhielten die Patienten 80 mg Ketoprofen (Oki, Dompé, Mailand, Italien) und 4 mg/Tag Betamethason (Bentelan, Glaxo, Verona, Italien) für zwei Tage. Sie wurden angewiesen, drei Mal täglich mit 0,2% Chlorhexidin (Curasept) für zwei Wochen zu spülen und nur weiche Nahrungsmittel für 30 Tage zu konsumieren. Die Nähte wurden nach 14 bis 21 Tagen entfernt. Basis-periapikale Röntgenaufnahmen wurden am Ende des Verfahrens, während der Wiedereröffnung, bei der Prothesenabgabe und jährlich danach gemacht. Der ACTILINK Reborn mit Universal Vortex Holder (Plasmapp Co., Ltd., Republik Korea) wurde verwendet, um alle Biomaterialien zu behandeln, wie zuvor berichtet.

Sechs Monate nach der GBR wurden Implantate gemäß dem Standardprotokoll des Herstellers eingesetzt. Nach der Erhebung des Lappens wurden die Implantatstellen mit Bohrern zunehmenden Durchmessers vorbereitet, wobei die Knochenqualität subjektiv als hart, mittel oder weich kategorisiert wurde. Das Motor-Drehmoment wurde während des Implantateinsatzes auf 25 Ncm eingestellt. Die Implantate (Osstem TSIII SOI, Osstem Implant CO., LTD., Seoul, Republik Korea) wurden in prothetisch geplanten Positionen eingesetzt. Da die Implantate eine aktivierte Oberfläche hatten, wurde keine zusätzliche Vortex-Plasma-Behandlung durchgeführt. Die Implantate wurden auf Krestenhöhe oder leicht darunter, entweder freihändig oder mit einer CAD/CAM-Chirurgievorlage eingesetzt. Vier Monate nach dem Implantateinsatz wurden die Implantate freigelegt und das Weichgewebe nach Bedarf behandelt. Digitale oder analoge Abdrücke wurden dann genommen, und temporäre Restaurationen wurden gemäß den Anforderungen des Weichgewebemanagements geliefert. Zwei bis vier Monate später wurden definitive monolithische Zirkonkronen, die auf Ti-Link verklebt waren, nach Bestätigung der individuellen Implantatstabilität geliefert. Die okklusalen Flächen wurden so gestaltet, dass sie leichten Kontakt mit der gegenüberliegenden Dentition hatten. Periapikale Röntgenaufnahmen und klinische Bilder wurden während des GBR-Verfahrens, des Implantateinsatzes sowie der temporären und definitiven Restaurationen aufgenommen (Abbildung 8). Anweisungen zur Mundhygiene wurden bei jedem Nachsorgetermin gegeben. Die professionelle Hygienewartung wurde alle sechs Monate nach der definitiven Belastung und nach Bedarf während der prothetischen Phasen geplant. Der zahnärztliche Biss wurde bei jedem Nachsorgetermin bewertet.
2.6. Ergebnismaße
Die primären Ergebnisse waren:
- Implantatversagen definiert als Mobilität, Infektion, Fraktur und/oder jedes andere mechanische oder biologische Problem, das seine Entfernung erforderte.
- Prothesenversagen wurde in Betracht gezogen, wenn sie zu irgendeinem Zeitpunkt ersetzt werden musste.
- Alle biologischen (z. B. medikamentenresistenter Schmerz, Schwellung, übermäßiger MBL, Eiterung usw.) und/oder technischen (z. B. Bruch des Verblendmaterials und/oder des Gerüsts, Schraubenlockerung usw.) Komplikationen wurden während der Nachsorge dokumentiert.
Das sekundäre Ergebnis bestand darin, die Knochenregeneration durch qualitative histologische Analyse zu bewerten, indem der Grad der Knochenmineralisierung beurteilt wurde.
Ergebnisse
3.1. Klinische Ergebnisse
Insgesamt wurden sechs Patienten behandelt. Drei Patienten mit hoffnungslosen Zähnen und intakten Alveolen nach der Zahnextraktion erhielten ein Verfahren zur Erhaltung der Alveole und eine verzögerte (drei Monate) Implantation, während die anderen drei Patienten mit Klasse IV horizontalen Defekten die Implantation in Kombination mit geführter Knochenregeneration erhielten. Sechs histologische Proben wurden bei drei Patienten zum Zeitpunkt der Implantation in der Gruppe zur Erhaltung der Alveole entnommen. Von jedem Patienten wurden drei Monate nach dem Verfahren zur Erhaltung der Alveole, zur gleichen Zeit wie die Implantatchirurgie, weiche und harte Gewebe entnommen, wie beschrieben. Insgesamt wurden sechs Proben gesammelt und zur histologischen Analyse geschickt (drei Weichgewebeproben und drei Knochenproben).
Insgesamt wurden sechs Patienten behandelt. Alle Patienten waren weiblich mit einem Durchschnittsalter von 50 Jahren (Altersspanne 37 bis 63). Keiner der Patienten war Raucher und alle Patienten waren gesund (ASA 1). Alle Patienten wurden mindestens 1 Jahr nach der Prothesenabgabe nachverfolgt, ohne Abbrecher.
Bis zu einem Jahr nach der Implantation sind keine Implantate oder Prothesen ausgefallen. Bei einem Patienten, der eine geführte Knochenregeneration durchlief, brach das Titannetz nach der Plasmabehandlung. Bei diesem Patienten wurde eine Perikardmembran verwendet und mit Tags fixiert. Es traten keine weiteren biologischen oder technischen Komplikationen auf.
Bei einem Patienten in der Gruppe zur Erhaltung des Alveolarknochens lag zum Zeitpunkt der Implantation die primäre Stabilität bei etwa 15–20 Ncm. Das Implantat osseointegrierte jedoch und die endgültige Krone wurde geliefert.
3.2. Histologische Bewertung
Drei Monate nach der Operation zur Erhaltung des Alveolarknochens zeigten keine histologischen Proben Anzeichen von Entzündungen oder Nekrose.
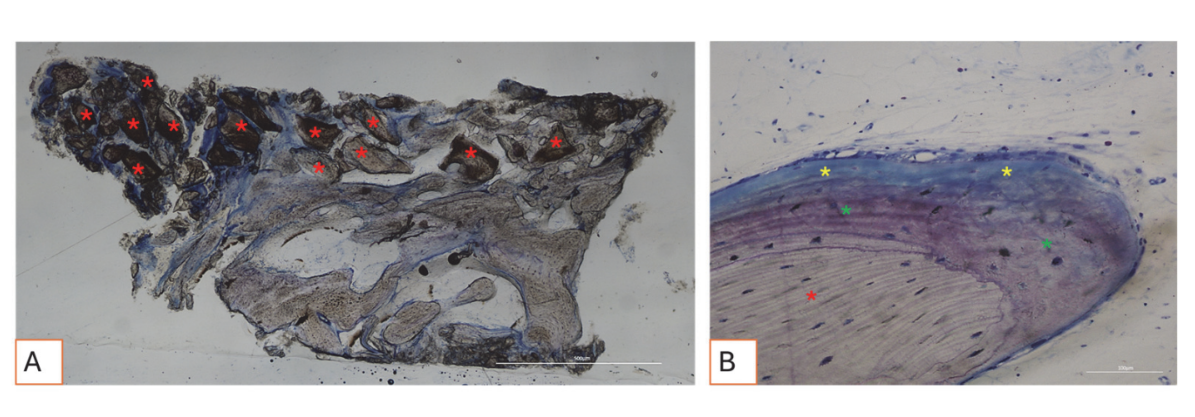
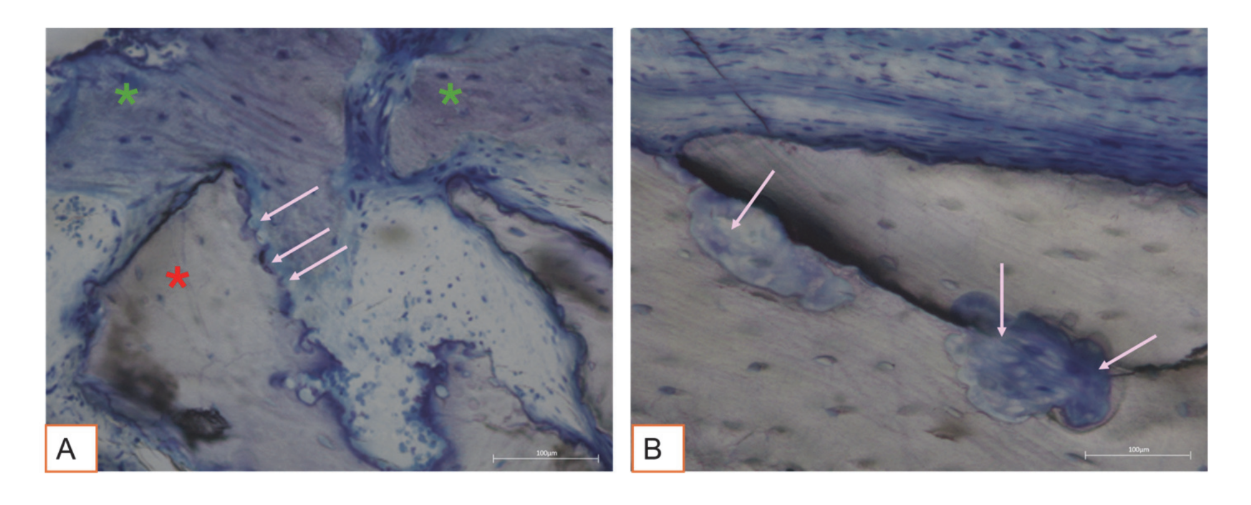
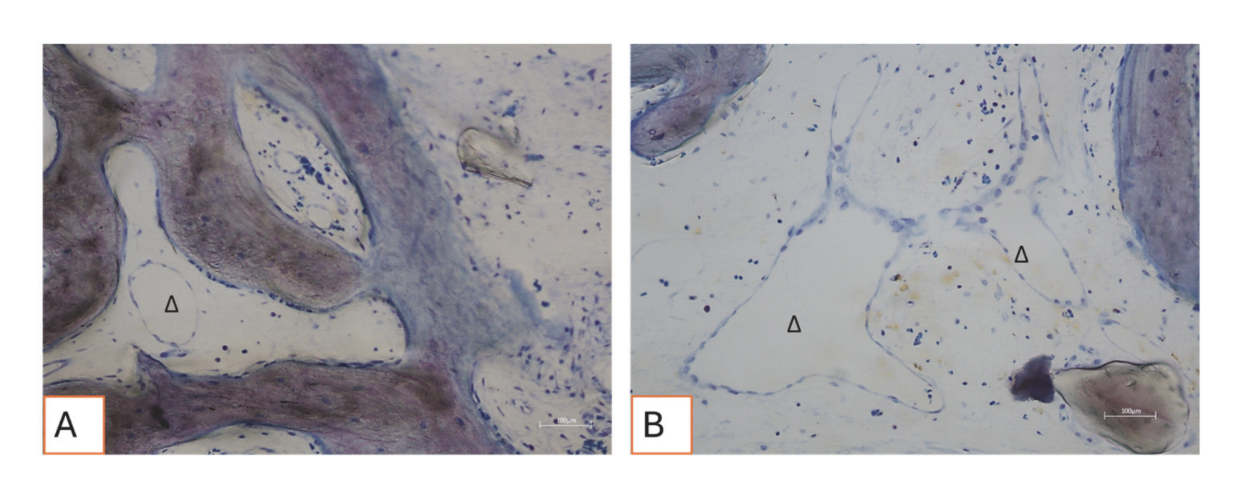
Alle Hartgewebeproben wiesen neu gebildeten Knochen auf, der sich in verschiedenen Stadien der Mineralisation befand (Abbildung 9), der mehrere Knochentransplantatpartikel umgab, die durch zahlreiche Oberflächenlakunen gekennzeichnet waren, die mit Osteoklasten-Resorptionslakunen übereinstimmten (Abbildung 10). Der neu gebildete Knochen schien reich an knochenaktiven Zellen zu sein, nämlich osteoblastenähnlichen Zellen, die in Ablagerungslinien ausgerichtet waren und osteoide Matrix sezernierten, sowie unreifen osteozytenähnlichen Zellen, die in Lakunen des geflochtenen Knochens lebten (Abbildung 9). Lockeres Bindegewebe wurde um die Hartgewebeareale beobachtet und schien reich an Zellen und Blutgefäßen zu sein (Abbildung 11).
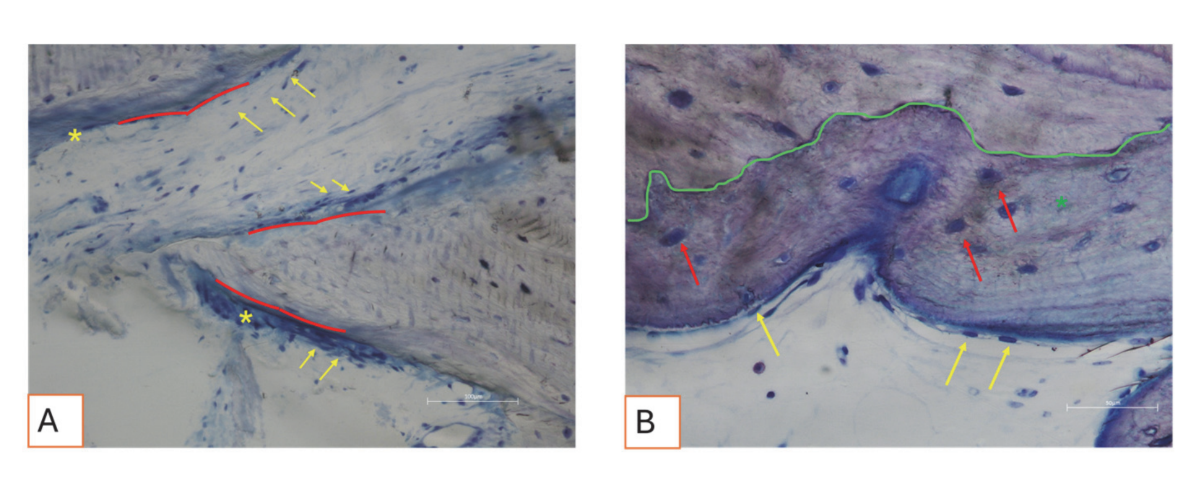
Die Weichgewebe wiesen eine physiologische Morphologie auf. Die Bindegewebskomponente war leicht fibrotisch, was mit der postoperativen Heilung übereinstimmt (Abbildungen 12 und 13).

Diskussion
Diese Studie untersuchte die Auswirkungen von VPST auf Biomaterialien, die in SP- und GBR-Verfahren verwendet werden, und bewertete ihren Einfluss auf die Oberflächenhydrophilie und die Heilungsergebnisse. Die Ergebnisse zeigen, dass die Plasabehandlung die biologische Verträglichkeit der Biomaterialien verbessert, was eine effektive Osseointegration und günstige Heilungsreaktionen fördert.
Die histologische Analyse nach drei Monaten zeigte keine Anzeichen von Nekrose, Entzündung oder Narbenbildung. Sowohl Weich- als auch Hartgewebe wiesen physiologische Architekturen mit guter Vaskularisierung auf. Die nach der Operation regenerierten Hartgewebe zeigten das Vorhandensein aktiver Knochenzellen, die osteoide Matrix und neu gebildetes Knochengewebe sezernierten, was mit dem erwarteten Heilungsverlauf übereinstimmt. Diese Ergebnisse stimmen mit früheren Studien überein, die berichten, dass die frühe Knochenbildung durch die Ablagerung einer osteoiden Matrix gekennzeichnet ist, die im Laufe der Zeit zunehmend mineralisiert. Partikel des Knochenersatzmaterials waren gut in den neu gebildeten Knochen integriert. Interessanterweise wiesen viele dieser Partikel Oberflächenlacunä auf, die mit osteoklastischer Resorption kompatibel sind. Menschliche Osteoklasten, die 21 Tage auf der Oberfläche von deproteinisierten equinen Knochengranulaten (DEBGs) und deproteinisierten bovinen Knochengranulaten (DBBGs) kultiviert wurden, resorbierten die Biomaterialien und zeigten typische osteoklastische Marker und morphologische Merkmale aktiver auf DEBGs als auf DBBGs. Diese Ergebnisse deuteten darauf hin, dass DEBGs die Differenzierung von Osteoklasten und die resorptive Aktivität unterstützen. Darüber hinaus berichteten Di Stefano et al. in einer klinischen und histomorphometrischen Studie, die sechs Monate nach der Socket-Grafting durchgeführt wurde, dass DEBGs mit einer signifikant höheren Menge an neu gebildetem Knochen und einem niedrigeren Prozentsatz an verbleibendem Biomaterial im Vergleich zu DBBGs assoziiert waren. In Anbetracht unserer Ergebnisse könnte das Vorhandensein von Resorptionslacunä, die auf der Oberfläche von DEBGs beobachtet wurden, auf die intrinsischen Eigenschaften des Materials selbst zurückzuführen sein, die durch die VPST-Behandlung weiter verbessert zu sein scheinen. Darüber hinaus verbessert VPST die Oberflächenrauhigkeit und Benetzbarkeit, was eine bessere Zell-Differenzierung und Apatitbildung fördert, die entscheidend für eine erfolgreiche Knochenregeneration sind. Die Analyse des Hartgewebes zeigte in der Tat zahlreiche Knochenablagerungslinien, die durch das Vorhandensein von osteoblastenähnlichen Zellen gekennzeichnet waren, die aktiv osteoide Matrix sezernierten. Die sekretorische Aktivität der Osteoblasten spielt eine entscheidende Rolle bei der Bildung neuen Knochens und bei der erfolgreichen Integration des Biomaterials in das Wirtsgewebe. Diese Ergebnisse bestätigten, dass die VPST-Behandlung die osteokonduktiven Eigenschaften des DEBG-Transplantats nicht beeinträchtigte und somit seine Verträglichkeit mit physiologischen Knochenregenerationsprozessen unterstützte. Darüber hinaus bildet die gleichzeitige Wirkung der osteoblastenvermittelten Matrixablagerung und der osteoklastenvermittelten Resorption die Grundlage für die physiologische Knochenremodellierung.
Dieser dynamische Prozess wird durch komplexe zelluläre Wechselwirkungen zwischen diesen beiden Zelltypen streng reguliert.
In Bezug auf das Weichgewebe zeigte die histologische Analyse eine physiologische Architektur mit einem leicht fibrotischen Bindegewebskomponenten, die mit der postoperativen Heilung übereinstimmt. Diese Ergebnisse stimmen mit denen von Pellegrini et al. überein, die den Verlauf der Heilung des Weichgewebes nach Knochenaufbauverfahren in Techniken zur Erhaltung von Zahnhöhlen beschrieben haben. Das Vorhandensein von leichter Fibrose im Bindegewebe kann als Teil der normalen Remodellierungsphase interpretiert werden, in der Fibroblasten zur Ablagerung der extrazellulären Matrix und zur Gewebereifung beitragen.
Klinisch wurden bis zu einem Jahr nach der Implantation keine Implantat- oder Prothesenfehler verzeichnet, was die klinische Zuverlässigkeit von plasma-behandelten Biomaterialien unterstreicht. Dies steht im Einklang mit früheren Studien, die eine verbesserte Implantatstabilität und Überlebensraten in Verbindung mit plasma-aktivierten Oberflächen berichteten. Das Fehlen biologischer oder technischer Komplikationen, mit Ausnahme des isolierten Bruchs des Titannetzes, unterstützt weiter die klinische Sicherheit und Wirksamkeit des vorgeschlagenen Behandlungsprotokolls. Die Wechselwirkung von Vakuumplasma mit biologischen Objekten kann auch nachteilige Auswirkungen haben, die berücksichtigt werden müssen. Eine mögliche Erklärung für den Bruch des Titannetzes war, dass das Titannetz unmittelbar nach dem Testen am Knochendefekt behandelt wurde. Das Vorhandensein biologischer Flüssigkeiten könnte eine Hyperaktivierung der Oberfläche verursacht haben.
Nach dem besten Wissen der Autoren ist dies die erste Studie, die VPST auf Biomaterialien bewertet. Trotz dieser vielversprechenden Ergebnisse hat diese Studie einige Einschränkungen. Die kleine Stichprobengröße und die Natur eines klinischen Audits schränken die Verallgemeinerbarkeit der Ergebnisse ein. Darüber hinaus verhindert das Fehlen einer Kontrollgruppe einen direkten Vergleich zwischen plasma-behandelten und nicht behandelten Biomaterialien. Zukünftige Studien sollten größere, randomisierte kontrollierte Studien mit langfristiger Nachverfolgung umfassen, um diese vorläufigen Ergebnisse zu validieren und robuste klinische Richtlinien zu etablieren.
Fazit
Angesichts der begrenzten Stichprobengröße zeigt diese vorläufige Fallserie, dass VPST die biologische Verträglichkeit von Biomaterialien, die in SP- und GBR-Verfahren verwendet werden, verbessern kann. Diese vorläufigen Ergebnisse könnten darauf hindeuten, dass die Plasma-Behandlung sicher in klinische Protokolle integriert werden könnte, um potenziell die Ergebnisse der oralen Rehabilitation zu verbessern. Weitere randomisierte kontrollierte Studien mit Stichprobengrößenberechnung sind erforderlich, um diese vorläufigen Ergebnisse zu bestätigen und die langfristigen Auswirkungen auf die Implantatüberlebensrate und die Patientenzufriedenheit zu untersuchen.
Marco Tallarico, Michele Troia, Milena Pisano, Silvio Mario Meloni, Dario Melodia, Claudia Della Via, Dolaji Henin, Francesco Mattia Ceruso, Carlotta Cacciò und Aurea Immacolata Lumbau
Referenzen
- Busenlechner, D.; Fürhauser, R.; Haas, R.; Watzek, G.; Mailath, G.; Pommer, B. Langfristiger Implantaterfolg an der Akademie für orale Implantologie: 8-Jahres-Nachverfolgung und Risikofaktoranalyse. J. Periodontal Implant. Sci. 2014, 44, 102–108. [CrossRef] [PubMed]
- Kim, T.I. Eine Hommage an Dr. Per-Ingvar Brånemark. J. Periodontal Implant. Sci. 2014, 44, 265. [CrossRef] [PubMed]
- Mavrogenis, A.F.; Dimitriou, R.; Parvizi, J.; Babis, G.C. Biologie der Implantat-Ossseointegration. J. Musculoskelet. Neuronal Interact. 2009, 9, 61–71.
- Gallucci, G.O.; Hamilton, A.; Zhou, W.; Buser, D.; Chen, S. Implantations- und Belastungsprotokolle bei teilweise zahnlosen Patienten: Eine systematische Übersicht. Clin. Oral Implant. Res. 2018, 29 (Suppl. S16), 106–134. [CrossRef]
- Wong, M.; Eulenberger, J.; Schenk, R.; Hunziker, E. Einfluss der Oberflächentopologie auf die Ossseointegration von Implantatmaterialien im trabekulären Knochen. J. Biomed. Mater. Res. 1995, 29, 1567–1575. [CrossRef]
- Wennerberg, A.; Albrektsson, T. Über Implantatoberflächen: Eine Übersicht über den aktuellen Wissensstand und Meinungen. Int. J. Oral Maxillofac. Implant. 2010, 25, 63–74.
- Wennerberg, A.; Albrektsson, T. Auswirkungen der Titanoberflächentopographie auf die Knochenintegration: Eine systematische Übersicht. Clin. Oral Implant. Res. 2009, 20 (Suppl. S4), 172–184. [CrossRef]
- Kazimierczak, P.; Przekora, A. Osteokonduktive und Osteoinduktive Oberflächenmodifikationen von Biomaterialien zur Knochenregeneration: Eine kurze Übersicht. Coatings 2020, 10, 971. [CrossRef]
- Canullo, L.; Genova, T.; Chinigò, G.; Iacono, R.; Pesce, P.; Menini, M.; Mussano, F. Vakuum-Plasma-Behandlungsgerät zur Verbesserung der Fibroblastenaktivität auf bearbeiteten und rauen Titanoberflächen. Dent. J. 2024, 12, 71. [CrossRef] [PubMed]
- Shibata, Y.; Hosaka, M.; Kawai, H.; Miyazaki, T. Glow-Entladung Plasma-Behandlung von Titanplatten verbessert die Haftung von osteoblastenähnlichen Zellen an den Platten durch einen integrinvermittelten Mechanismus. Int. J. Oral Maxillofac. Implant. 2002, 17, 771–777.
- Noro, A.; Kaneko, M.; Murata, I.; Yoshinari, M. Einfluss der Oberflächentopographie und der physikochemischen Eigenschaften auf die Benetzbarkeit von Zirkonia (tetragonales Zirkonia-Polykrystal). J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 355–363. [CrossRef] [PubMed]
- Tallarico, M.; Meloni, S.M.; Troia, M.; Cacciò, C.; Lumbau, A.I.; Gendviliene, I.; Ceruso, F.M.; Pisano, M. Die Verwendung von Vakuum-Plasma-Oberflächenbehandlung zur Verbesserung der Hydrophilie und Benetzbarkeit von Biomaterialien: Eine In-vitro-Studie. Dent. J. 2025, 13, 141. [CrossRef] [PubMed]
- Canullo, L.; Pellegrini, G.; Canciani, E.; Heinemann, F.; Galliera, E.; Dellavia, C. Technik zur Erhaltung des alveolären Socket: Einfluss des Biomaterials auf das Knochenregenerationsmuster. Ann. Anat. Anat. Anz. 2016, 206, 73–79. [CrossRef] [PubMed]
- Lorusso, F.; Alla, I.; Gehrke, S.A.; Carmine, M.D.; Tari, S.R.; Scarano, A. Einfluss verschiedener zahnärztlicher Implantat-Prothesenverbindungen auf den marginalen Knochenverlust: Aufkommende Erkenntnisse aus einer Bayesian-Netzwerk-Metaanalyse (NMA) und systematischen Übersicht. Prosthesis 2024, 6, 186–205. [CrossRef]
- Udeabor, S.E.; Heselich, A.; Al-Maawi, S.; Alqahtani, A.F.; Sader, R.; Ghanaati, S. Aktuelles Wissen über die Heilung des Extraktionssocket: Eine narrative Übersicht. Bioengineering 2023, 10, 1145. [CrossRef]
- Perrotti, V.; Nicholls, B.M.; Piattelli, A. Bildung und Aktivität von menschlichen Osteoklasten auf einem equinen spongiösen Knochenersatz. Clin. Oral Implant. Res. 2009, 20, 17–23. [CrossRef]
- Di Stefano, D.A.; Zaniol, T.; Cinci, L.; Pieri, L. Chemischer, klinischer und histomorphometrischer Vergleich zwischen equinem Knochen, der durch enzymatische Antigenelimination hergestellt wurde, und bovinem Knochen, der durch einen Hochtemperaturprozess in post-extraktiven Socket-Graft nicht-antigenisch gemacht wurde. Eine vergleichende retrospektive klinische Studie. Dent. J. 2019, 7, 70. [CrossRef]
- Le, P.T.M.; Shintani, S.A.; Takadama, H.; Ito, M.; Kakutani, T.; Kitagaki, H.; Terauchi, S.; Ueno, T.; Nakano, H.; Nakajima, Y.; et al. Bioaktivierungsbehandlung mit gemischter Säure und Wärme auf Titanimplantaten, die durch selektives Laserschmelzen hergestellt wurden, verbessert die Differenzierung von Präosteoblastenzellen. Nanomaterials 2021, 11, 987. [CrossRef]
- Pellegrini, G.; Rasperini, G.; Obot, G.; Farronato, D.; Dellavia, C. Heilung des Weichgewebes in der Technik zur Erhaltung des alveolären Socket: Histologische Bewertungen. Int. J. Periodontics Restor. Dent. 2014, 34, 531–539. [CrossRef]
- Kahm, S.H.; Lee, S.H.; Lim, Y.; Jeon, H.J.; Yun, K.I. Osseointegration von Zahnimplantaten nach Vakuum-Plasma-Oberflächenbehandlung in vivo. J. Funct. Biomater. 2024, 15, 278. [CrossRef]
- Pesce, P.; Menini, M.; Santori, G.; Giovanni, E.; Bagnasco, F.; Canullo, L. Foto- und Plasmaaktivierung von Titanoberflächen von Zahnimplantaten. Eine systematische Übersicht mit Metaanalyse von präklinischen Studien. J. Clin. Med. 2020, 9, 2817. [CrossRef] [PubMed]
- Scribante, A.; Ghizzoni, M.; Pellegrini, M.; Pulicari, F.; Manfredini, M.; Poli, P.P.; Maiorana, C.; Spadari, F. Vollständig digitale maßgeschneiderte Netze in geführten Knochenregenerationsverfahren: Eine Scoping-Übersicht. Prosthesis 2023, 5, 480–495. [CrossRef]
- Berger, M.B.; Bosh, K.B.; Cohen, D.J.; Boyan, B.D.; Schwartz, Z. Benchtop-Plasma-Behandlung von Titanoberflächen verbessert die Zellreaktion. Dent. Mater. 2021, 37, 690–700. [CrossRef] [PubMed]
