Eine systematische Übersicht über die Definition von Periimplantitis: Grenzen im Zusammenhang mit den verschiedenen vorgeschlagenen Diagnosen
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziel: Ziel dieser umfassenden systematischen Überprüfung war es, die verschiedenen in der Literatur vorgeschlagenen Definitionen von Periimplantitis darzustellen.
Materialien und Methoden: Elektronische und manuelle Literatursuchen wurden von drei unabhängigen Gutachtern durchgeführt, um Manuskripte zu identifizieren, die Daten zur Definition von Periimplantitis mit klinischer Diagnose berichteten, in englischer Sprache verfasst und bis Oktober 2015 veröffentlicht wurden. Mehrere Datenbanken wurden herangezogen, darunter PubMed, Embase, die Cochrane-Bibliothek und die Datenbank für graue Literatur.
Ergebnisse: Neunundvierzig Artikel wurden als geeignet für die Überprüfung angesehen. Aktuelle Beweise deuten auf die Verwendung eindeutiger Falldefinitionen für Periimplantitis hin, definiert durch Veränderungen des Niveaus des crestal Knochens, das Vorhandensein von Blutungen beim Sondieren und/oder Eiterung, mit oder ohne gleichzeitige Vertiefung der Periimplantattaschen. Es wurden jedoch mehrere Referenzpunkte verwendet, um diese Veränderungen zu messen, einschließlich unterschiedlicher Schweregrade und Jahre der Nachverfolgung.
Fazit: Die verfügbare wissenschaftliche Literatur deutet auf das Fehlen einer einheitlichen Definition von Periimplantitis hin. Zukünftige Studien, die konsistente Falldefinitionen anwenden, sollten in Betracht gezogen werden.
Einleitung
Der Begriff „Periimplantitis“ wurde in den frühen 1960er Jahren eingeführt, um infektiöse pathologische Zustände des periimplantären Gewebes zu beschreiben. Heute ist Periimplantitis die häufigste Komplikation von Zahnimplantaten und tritt mit einer Häufigkeit von 1 % bis 47 % auf Implantatniveau auf. Im Gegensatz zur Periimplantitis-Mucositis (definiert als das Vorhandensein eines reversiblen entzündlichen Weichgewebeinfiltrats, ohne zusätzlichen Knochenverlust über die initiale physiologische Knochenremodellierung hinaus) wurde die Periimplantitis als ein entzündlicher Prozess um ein Implantat beschrieben, der sowohl eine Entzündung des Weichgewebes als auch einen fortschreitenden Verlust des unterstützenden Knochens über die physiologische crestale Knochenremodellierung hinaus umfasst. Wie in aktuellen Literaturübersichten und Konsensuskonferenzen hervorgehoben, wurden unterschiedliche Definitionen von Periimplantitis berichtet. Dies kann teilweise auf den Mangel an Konsens über Terminologie, Ätiologie, Diagnosesysteme und Prognosesysteme zurückzuführen sein.
Die Periimplantitis wurde als eine Erkrankung mit einem infektiösen Bestandteil beschrieben, die der chronischen Parodontitis ähnlich ist. Der 8. Europäische Workshop zur Parodontologie hat zugestimmt, dass die 200810 und 20118 veröffentlichten Definitionen übernommen werden sollten. Die vorgeschlagene Definition sollte Folgendes umfassen: Veränderungen im Niveau des crestal Knochens, positives Bluten bei der Sondierung (BOP) und/oder Eiterung (SUP), mit oder ohne begleitende Periimplantat-Taschen (Sondierungstiefen, PPD). Heutzutage wird zwar die Plaqueansammlung weiterhin als der Hauptfaktor angesehen, es hat sich jedoch gezeigt, dass es andere potenzielle Risikofaktoren der Erkrankung gibt, einschließlich Patienten-, chirurgischer und prothetischer Faktoren, die sicherlich zu ihrer Entwicklung beitragen können.
In der MeSH (Medical Subject Headings) Datenbank wurde der Begriff „Periimplantitis“ 2011 eingeführt und als ein entzündlicher Prozess mit Verlust des unterstützenden Knochens im Gewebe um funktionierende Zahnimplantate definiert. Trotz dieser sehr klaren und umfassenden Krankheitsdefinition treten Inkonsistenzen und Verwirrung bei der klinischen Anwendung der Terminologie auf. All diese Faktoren zusammen haben zu unterschiedlichen Interpretationen und Definitionen dieser häufig auftretenden Erkrankung geführt. Außerdem hat kürzlich die Hypothese der nicht-infektiösen Fremdkörperreaktion das Verständnis dieses Themas weiter kompliziert. Ziel der vorliegenden systematischen Überprüfung war es, die verschiedenen in der Literatur vorgeschlagenen Definitionen der Periimplantitis darzustellen.
Materialien und Methoden
Das vorliegende Papier wurde zur teilweisen Erfüllung einer Konsenserklärung erstellt, die im Januar 2016 in Rom, Italien, stattfand. Diese systematische Überprüfung wurde gemäß den PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) Richtlinien verfasst (http://www.prisma-statement.org/PRISMAStatement/PRISMA-Statement.aspx).
Die fokussierte Frage war: Gibt es eine einheitliche Definition von Periimplantitis, einschließlich klinischer Diagnose. Die Forschungsfrage wurde an das PICO-Format angepasst:
P = Population: menschliche Patienten, die aus klinischen Studien, systematischen Übersichten, narrativen Übersichten, Konsenserklärungen, Kommentaren oder Editorials stammen und mindestens ein zahnärztliches Implantat, das seit mindestens einem Jahr in Funktion ist, aufweisen und von Periimplantitis betroffen sind;
I = Intervention: klinische Daten, die mit dem Ziel gesammelt wurden, die Schwere der periimplantären Erkrankung festzustellen und neue Kriterien zu definieren, um periimplantäre Erkrankungen zu klassifizieren;
C = Vergleich/Kontrolle: klinische Ergebnisse der Periimplantitis im Vergleich zu klinischen Anzeichen der Parodontitis sowie zu gesunden Patienten;
O = Ergebnisse: klinische Parameter und radiografische Bewertung der Periimplantitis: BOP, PPD, Blutungsindex, Vorhandensein von SUP und marginalem Knochenverlust (MBL).
Suchstrategie
Eine anfängliche Suchstrategie, die die englische Literatur von 1967 bis Oktober 2015 umfasste, wurde online durchgeführt, um relevante Studien zu identifizieren, die die Einschlusskriterien erfüllten. Die folgenden elektronischen Datenbanken wurden konsultiert: PubMed-Datenbank der U.S. National Library of Medicine, Embase (Excerpta Medica dataBASE) und die Cochrane Library. Gemäß der AMSTAR (A Measurement Tool to Assess Systematic Reviews) Checkliste wurde die Graue Literaturdatenbank im Graue Literaturbericht der New York Academy of Medicine durchsucht, um mögliche unveröffentlichte Arbeiten zu finden. Das Screening wurde unabhängig und gleichzeitig von zwei Prüfern (MT und AM) durchgeführt. Ein dritter Gutachter (LC) bewertete die einbezogenen und ausgeschlossenen Studien erneut. Die elektronischen Datenbanken wurden unter Verwendung einer Kombination von booleschen Schlüsselwörtern, einschließlich MeSH und mehreren Freitextbegriffen (Tabelle 1), durchsucht.
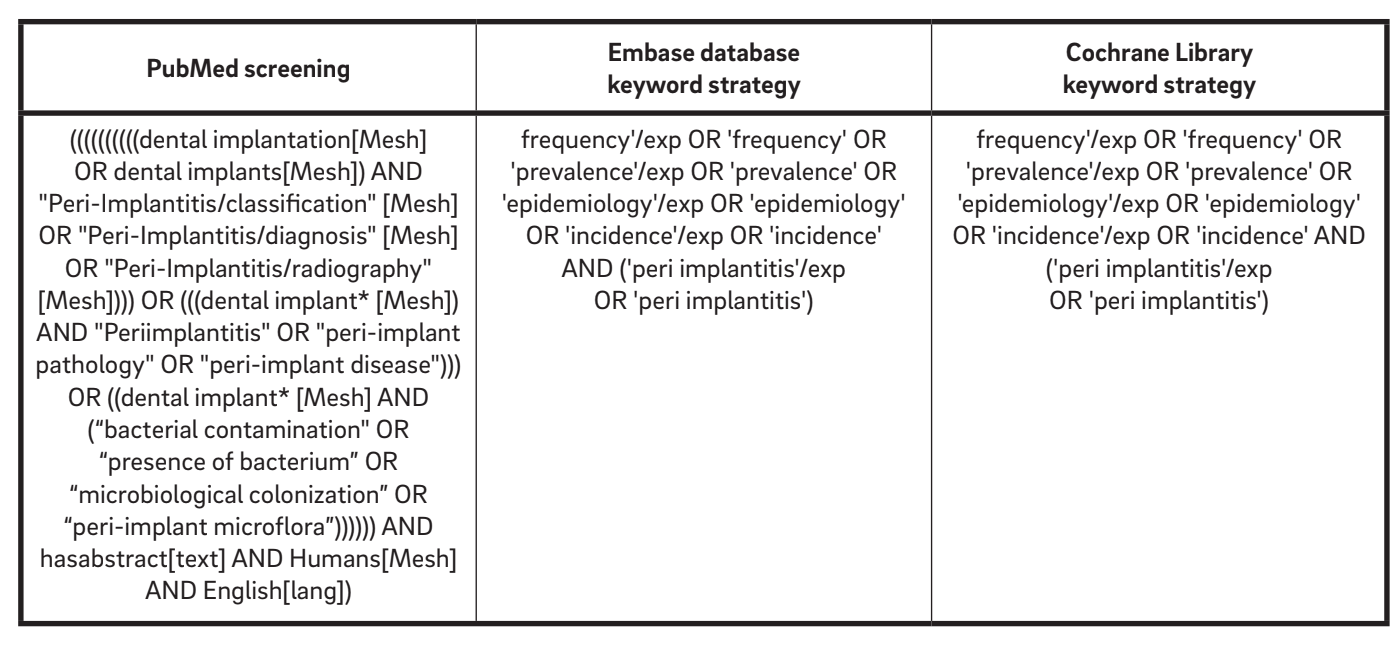
Teilnahmebedingungen
Die folgenden Einschlusskriterien wurden für die Auswahl der Artikel definiert:
- in Englisch verfasst;
- klinische Untersuchungen an menschlichen Patienten;
- randomisierte kontrollierte klinische Studien zu Implantaten mit einer Funktionsdauer von ≥ 1 Jahr;
- prospektive und retrospektive Kohortenstudien zu Implantaten mit einer Funktionsdauer von ≥ 1 Jahr;
- Querschnittsstudien mit einer Funktionsdauer von ≥ 1 Jahr; und
- systematische Übersichtsarbeiten, narrative Übersichtsarbeiten, Konsenserklärungen, Kommentare oder Editorials.
Artikel wurden ausgeschlossen, wenn sie
- Tierstudien;
- in vitro Studien;
- Berichte über lokal oder systemisch beeinträchtigte Stellen und/oder Bedingungen;
- Berichte mit < 15 Fällen;
- Berichte über Mini-Implantate, Einteilig-Implantate oder Klingenimplantate; oder
- Berichte über Implantate mit einer Funktionsdauer von < 1 Jahr.
Papiere ohne Abstracts, aber mit Titeln, die sich auf die Ziele dieser Überprüfung beziehen, wurden ausgewählt, damit der Volltext auf die Eignung überprüft werden konnte. Volltextpapiere wurden für alle Abstracts und Titel beschafft, die anscheinend die Einschlusskriterien erfüllten, und wurden von denselben zwei Prüfern auf die Eignung bewertet. Die Referenzlisten der ausgewählten Studien wurden auf zusätzliche Papiere überprüft, die möglicherweise die Eignungskriterien der Studie erfüllt haben. Darüber hinaus wurden manuelle Suchen in den Referenzlisten ausgewählter systematischer Übersichten durchgeführt, beschränkt auf die folgenden Zeitschriften: Clinical Implant Dentistry and Related Research, Clinical Oral Implants Research, International Journal of Oral and Maxillofacial Implants, Journal of Clinical Periodontology und Journal of Periodontology. Alle Meinungsverschiedenheiten zwischen den beiden Gutachtern wurden nach einer zusätzlichen Diskussion gelöst. Darüber hinaus wurde die Übereinstimmung zwischen den Prüfern in der zweiten Phase berechnet. Ein abschließender Gutachter (LC) bewertete mögliche Inkonsistenzen zwischen den beiden Gutachtern. Alle Volltexte der ausgewählten Papiere wurden in gemeinsamen Ordnern gespeichert, die für alle Gutachter zugänglich sind.
Qualitative Bewertung der Parameter zur Definition von Periimplantitis
Eine beschreibende Bewertung wurde durchgeführt, um qualitativ die Bandbreite der Parameter zu analysieren, die zur Definition von Periimplantitis als irreversible entzündliche Erkrankung, die zu einem Abbau von Hartgewebe führt, betrachtet werden. Dementsprechend wurden die folgenden gängigen Parameter bewertet: PPD, BOP, SUP und radiografisches MBL. Solche Parameter aus den verschiedenen Artikeln wurden zusammengefasst, um die Varianz oder Einheitlichkeit unter den berichteten Falldefinitionen von Periimplantitis zu analysieren. Grafiken zur Darstellung der Varianz wurden erstellt. Während PPD in drei verschiedene Gruppen eingeteilt wurde (< 3 mm, 3–5 mm und > 5 mm), wurde das radiografische MBL in vier Hauptbereiche kategorisiert, abhängig von der Hauptreferenz, die die Prothesenabgabe als Basis nimmt: ≤ 1 mm, > 1–2 mm, > 3–4 mm und ≥ 5 mm.
Ergebnisse
Screening-Prozess
Die Kombinationen von Suchbegriffen und eine manuelle Suche nach Referenzen in ausgewählten Artikeln führten zu einer Liste von 1.061 Titeln. Davon wurden 976 Artikel aufgrund der Bewertung des Titels und der Zusammenfassung ausgeschlossen, sodass 85 Artikel für die Aufnahme in Frage kamen (k = 0,84). Nach Anwendung der Eignungskriterien wurden insgesamt 49 Artikel für die Überprüfung berücksichtigt. Nach der Auswahl und dem Lesen der Volltextartikel wurden die relevanten Informationen aus jedem Artikel extrahiert. Ein Diagramm der Suchstrategie ist in Abbildung 1. dargestellt.
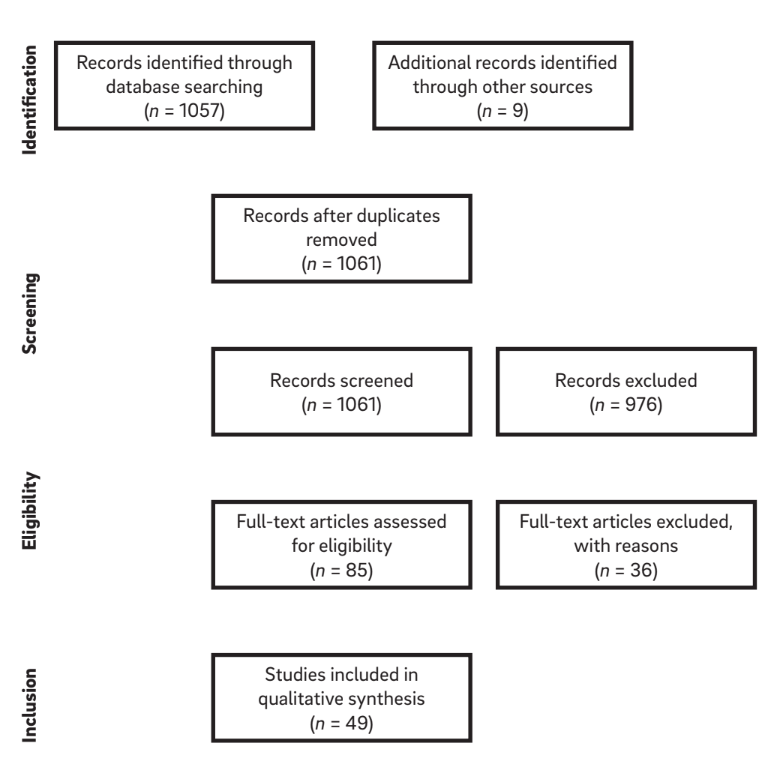
Definitionen von “Periimplantitis”
Achtzehn Manuskripte, einschließlich narrativer und systematischer Übersichten, Konsenserklärungen und Originalarbeiten, wurden ausgewählt und Daten wurden extrahiert. 1965 berichtete Levignac über eine periimplantäre Weichgewebeentzündung mit anschließender Zerstörung des Knochens und bezeichnete sie als “Periimplantitis.” 1987 beschrieben Mombelli et al. die Periimplantitis als eine Infektionskrankheit, die Merkmale der chronischen Parodontitis teilt. Der gleiche Autor betonte die infektiöse Natur dieses pathologischen Zustands und konzentrierte sich auf die bakterielle Belastung der Implantatoberfläche und das anschließende Auftreten einer Weichgewebeentzündungsreaktion in der Nähe von Zahnimplantaten, die manchmal zum Verlust des unterstützenden Knochens führte. Wie die Parodontitis wurde gezeigt, dass die Ätiopathogenese der Periimplantitis durch eine bakterielle Infektion ausgelöst wird, die eine Zytokinkaskade aktiviert, was zu entzündlichem Knochenverlust führt.
„Periimplantitis“ wurde im Konsensbericht des 1. Europäischen Workshops für Parodontologie im Jahr 1993 als akzeptierter Begriff eingeführt. Es wurde als eine irreversible entzündliche destruktive Reaktion um funktionierende Implantate beschrieben, die zum Verlust des unterstützenden Knochens führt. Der 6. Europäische Workshop für Parodontologie präsentierte eine modifizierte Definition, um nicht nur anzuerkennen, dass Periimplantitis eine behandelbare Erkrankung ist, sondern auch den Sammelbegriff „Peri-Implantat-Erkrankung“ für sowohl Periimplantitis als auch Periimplantitis einzuschließen.
Um die Qualität der Forschung zu Periimplantaterkrankungen zu verbessern, empfahl der 7. Europäische Workshop für Parodontologie die Verwendung eindeutiger Falldefinitionen: Veränderungen im Niveau des crestal Knochens und das Vorhandensein von BOP und/oder SUP, mit oder ohne gleichzeitige Vertiefung der peri-implantären Taschen. Schließlich definierte die American Academy of Periodontology im Jahr 2013 „Periimplantitis“ als eine entzündliche Reaktion, die mit dem Verlust des unterstützenden Knochens über die initiale biologische Knochenremodellierung um ein funktionierendes Implantat hinaus verbunden ist.
Das Ausmaß und die Schwere von periimplantären Erkrankungen wurden selten berichtet. Froum und Rosen schlugen eine Kombination aus BOP und/oder SUP, PPD und dem Ausmaß der radiografischen MBL um das Implantat vor, um die Periimplantitis in frühe, moderate oder fortgeschrittene Krankheitskategorien zu klassifizieren. Ebenso schlugen Decker et al. ein Prognosesystem basierend auf der Diagnose für jede Kategorie gemäß der Prognoseklassifikation von Kwok und Caton für natürliche Zähne vor. In ihrer Studie gaben die Autoren an, dass PPD, das Ausmaß der radiografischen MBL, das Vorhandensein von SUP und die Implantatmobilität die kritischsten Faktoren waren, um Fälle als mit einer günstigen, fraglichen, ungünstigen oder hoffnungslosen Prognose zu kategorisieren.
Kürzlich modifizierten Albrektsson et al. das Konzept der Periimplantitis als Verlust von Knochen um ein Implantat als klinisch ungünstige, unausgeglichene Fremdkörperreaktion und stellten spezifisch fest, dass die Osseointegration ein Prozess ist, bei dem der Knochen auf das Zahnimplantat reagiert, indem er eine verkalkte Struktur bildet, die an dieses angrenzend ist. Tatsächlich kann diese Fremdkörperreaktion manchmal tatsächlich zu osteoklastischer Aktivität führen, die den stützenden Knochen zerstören kann. Die Autoren sind der Meinung, dass der Begriff „Periimplantitis“ durchaus angemessen ist, da es sich nicht um eine primäre Erkrankung handelt, sondern um eine Komplikation einer klinisch ungünstigen, unausgeglichenen Fremdkörperreaktion, die den Ausgangspunkt des pathologischen Prozesses und der daraus resultierenden Gewebe-Folgen darstellt.
Derzeit wird, wie im Konsens des 7. Europäischen Workshops zur Parodontaltherapie vorgesehen, angenommen, dass die Infektion selbst immer durch Plaque und deren Produkte verursacht wird; jedoch werden zahlreiche Risikofaktoren anerkannt, die spezifisch mit Periimplantitis assoziiert sind, wie chirurgische oder prothetische Faktoren, Implantateigenschaften, Rauchen und die Reaktion des Wirts.
Definition der Periimplantitis mit klinischer und radiografischer Diagnose
Einunddreißig Manuskripte (Tabelle 2) wurden ausgewählt und Daten wurden extrahiert. Informationen von 1.711 Patienten mit 5.432 Implantaten wurden analysiert. Der Begriff „Periimplantitis“ wurde allgemein verwendet, um jedes Implantat mit unterschiedlichen Graden von Knochenschwund zu beschreiben, und eine klare Definition wurde entweder nicht präsentiert oder direkt aus der Terminologie extrahiert.
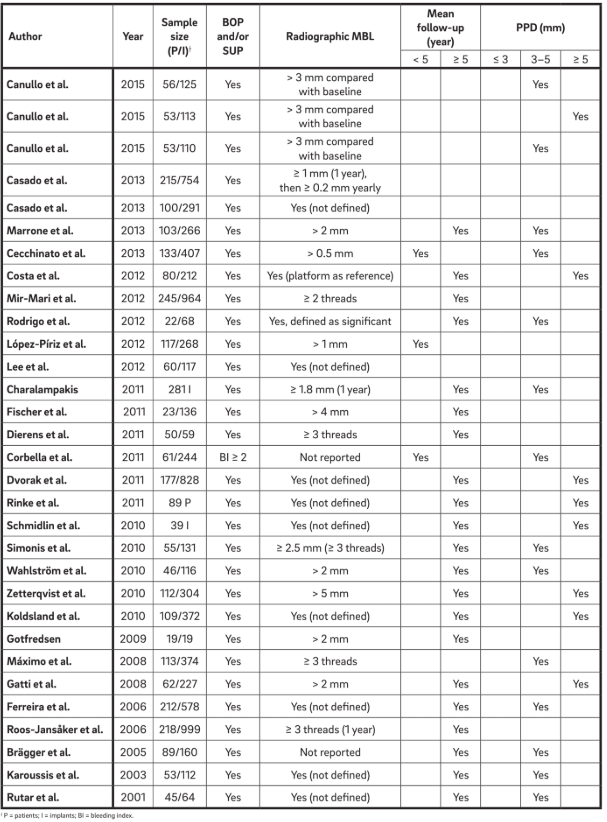
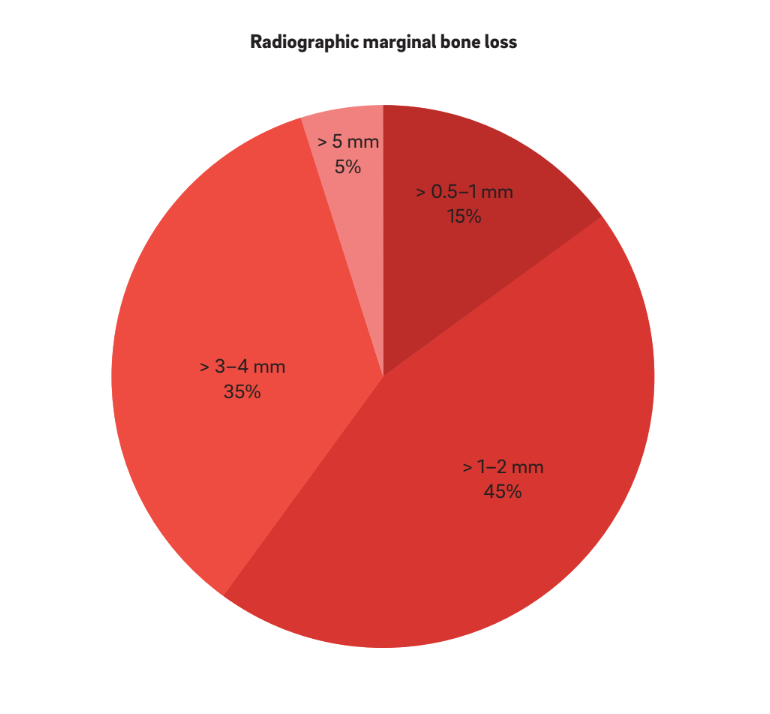
Vier Hauptmerkmale wurden verwendet, um „Periimplantitis“ zu definieren. Interessanterweise betrachten alle Autoren BOP und SUP als Indikatoren für Periimplantitis. Dieser Ansatz berücksichtigt rein plaque- und fremdkörperinduzierte Periimplantitis, bei der eine Entzündungsreaktion oft durch den Biofilm oder dessen Produkte und/oder fremde Substanzen, wie z.B. Restzement, ausgelöst wird. Darüber hinaus berichteten 22 Studien eindeutig, dass PPD ein entscheidender Parameter zur Bestimmung von Periimplantitis ist. Keine Studie betrachtete PPD < 3 mm als indikativ für Periimplantitis. Während die überwiegende Mehrheit (64%) der Studien PPD = 3–5 mm als indikativ für Periimplantitis definierte, betrachteten die verbleibenden 36% PPD > 5 mm als Referenz (Abb. 2). Ein radiographischer MBL ≥ 0,5–1 mm, > 1–2 mm, > 3–4 mm und ≥ 5 mm, wobei die Prothesenabgabe als Basislinie genommen wurde, wurde in 15%, 45%, 35% und 5% der Studien jeweils als definierend für Periimplantitis angesehen (Abb. 3). Daher wurde spekuliert, dass ein radiographischer MBL < 1 mm als physiologisches Knochenremodellierung betrachtet werden sollte.
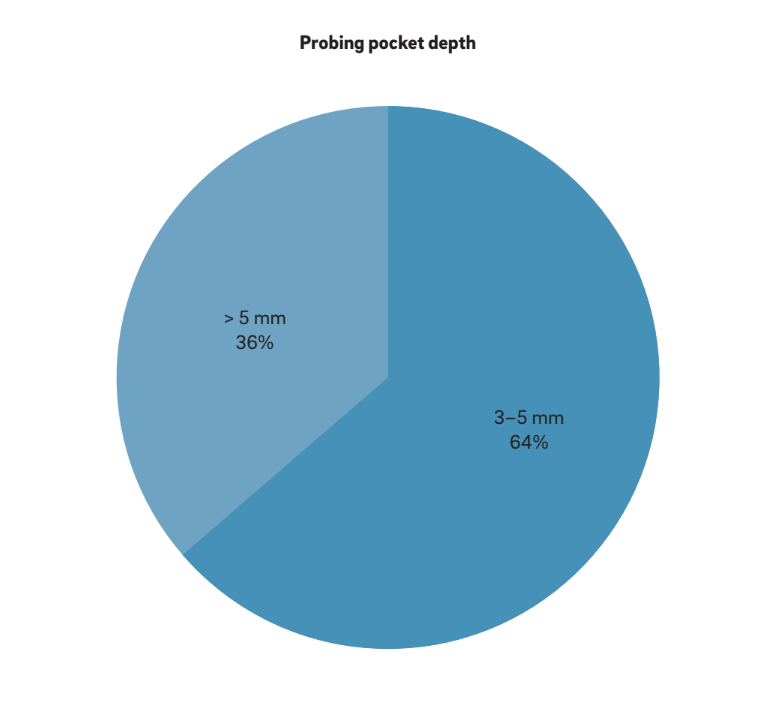
BOP und/oder SUP waren in allen analysierten Studien Voraussetzung. In den meisten Studien wurde die Kombination aus klinischen und radiografischen Messungen zur Falldefinition verwendet. In zwei prospektiven Studien wurden die radiografischen MBL nicht berichtet, und es wurden nur klinische Messungen verwendet, um biologische Komplikationen zu bewerten. In diesen Fällen waren das Vorhandensein von BOP und/oder SUP bei der Sondierung und PPD ≥ 4 mm Voraussetzung für eine Diagnose von Periimplantitis. In neun Studien, darunter eine randomisierte kontrollierte Studie, drei prospektive und fünf retrospektive Studien, wurden BOP und radiografische Bewertungen allein durchgeführt, ohne dass PPD-Messungen berichtet wurden. In diesen Fällen wurde ein MBL von 0,5 mm bis > 4 mm34 als mit Periimplantitis assoziiert angesehen.
Vor 2012 waren Veränderungen im Niveau des crestal Knochens entweder nicht definiert oder nicht klar berichtet, was die Diagnose von Periimplantitis erschwerte. In Studien, die die Entität des MBL definierten, wurden jedoch unterschiedliche diagnostische Kriterien verwendet. In einer Langzeitstudie wurde Periimplantitis als das Vorhandensein von BOP, PPD ≥ 4 mm und MBL > 0,5 mm definiert. Eine andere Studie verwendete jedoch MBL > 4 mm als Referenzwert.34 Die meisten Studien betrachteten MBL > 2 mm für die Diagnose von Periimplantitis. Zuvor verwendete unsere Gruppe ein radiografisches MBL > 3 mm, basierend auf dem Ausgangsröntgenbild, das zum Zeitpunkt der Prothesenabgabe aufgenommen wurde, um Periimplantitis zu diagnostizieren. In drei anderen Studien wurde MBL in Bezug auf die Zeit betrachtet, in der die Prothese in Funktion war. Alle Studien bis auf fünf berechneten MBL in Millimetern. In den anderen Studien wurden die Implantatgewinde als Referenz verwendet.
Acht Studien verwendeten PPD > 5 mm zur Diagnose von Periimplantitis. Marrone et al. definierten Periimplantitis als das Vorhandensein von BOP, PPD > 5 mm und MBL > 2 mm. Charalampakis et al. wandten die Kriterien für das Vorhandensein von BOP und/oder SUP, PPD ≥ 5 mm und MBL ≥ 1,8 mm nach einem Jahr in Funktion an. Zetterqvist et al. schlossen Fälle mit PPD > 5 mm und MBL ≥ 3 mm ein. Zwei weitere Studien, eine prospektive und eine retrospektive, verwendeten das Vorhandensein von BOP und/oder SUP, PPD > 5 mm und radiografische Anzeichen von MBL, ohne das Ausgangsniveau des Knochens zu spezifizieren. Positives BOP und/oder SUP, radiografisches MBL ≥ 3 mm und PPD ≥ 6 mm wurden von Koldsland et al. verwendet.
Auf dem 7. und 8. Europäischen Workshop zur Parodontalforschung wurden Periimplantitis und Periimplantitis wie folgt beschrieben: „Änderungen des Niveaus des crestal Knochens, Vorhandensein von Blutungen beim Sondieren und/oder Suppuration; mit oder ohne gleichzeitige Vertiefung der periimplantären Taschen.“ Periimplantitis wurde mit positivem BOP und/oder SUP definiert und Periimplantitis mit positivem BOP und/oder SUP in Kombination mit radiografischem MBL ≥ 2 mm. Dieselben Parameter wurden von Zitzmann und Berglundh verwendet, um Periimplantitis zu definieren. Atieh et al. verwendeten jedoch dieselben Kriterien, zusätzlich PPD ≥ 5 mm, als Definition von Periimplantitis in ihrem systematischen Übersichtsartikel.
Diskussion
Periimplantäre Erkrankungen treten in zwei Formen auf: Periimplantitis und Periimplantitis. Beide sind durch eine entzündliche Reaktion im Gewebe um ein Implantat gekennzeichnet. Periimplantitis wurde als reversible entzündliche Reaktion im Weichgewebe um ein funktionierendes Implantat definiert, während Periimplantitis als eine tiefere entzündliche Läsion definiert wurde, die durch eine vertiefte periimplantäre Tasche und den Verlust von unterstützendem Knochen um ein funktionierendes Implantat gekennzeichnet ist.
Studien, die Anfang 2010 veröffentlicht wurden, deuteten darauf hin, dass Mukositis und Periimplantitis äquivalent zu Parodontitis sind, da beide als ein Ungleichgewicht zwischen bakterieller Last und der Reaktion des Wirts beschrieben werden. Basierend darauf sind beide Erkrankungen eng mit der Bildung eines Biofilms verbunden, der eine Mikrobiota enthält, die reich an gramnegativen Bakterien ist, in Anwesenheit eines anfälligen Wirts. Es wurde jedoch gezeigt, dass Mikroorganismen vorhanden sein können, aber nicht notwendig für Periimplantitis sind. Darüber hinaus teilen sowohl Parodontitis als auch Periimplantitis mehrere gemeinsame systemische Risikofaktoren oder Indikatoren (z. B. Rauchen, schlechte Mundhygiene, Diabetes oder Vorgeschichte von Parodontitis, Osteoporose). Ähnlich scheint Periimplantitis, wie es bei Parodontitis der Fall ist, von einem bestimmten genetischen Profil beeinflusst zu werden (d. h. Interleukin-1-Polymorphismus). Andere haben die Beschreibung einer Erkrankung, die mit Parodontitis vergleichbar ist, aufgrund der anatomischen Unterschiede zwischen parodontalen und periimplantären Strukturen abgelehnt (z. B. unterschiedliche Kollagenfaserorientierung [senkrecht vs. horizontal], Vaskularität oder Reparaturkapazität und die mechanische Widerstandsfähigkeit, die durch das parodontalen Ligament bereitgestellt wird). Tatsächlich ist Parodontitis durch die entzündliche Zerstörung des unterstützenden Apparats der Zähne (Parodontium) gekennzeichnet, einschließlich des parodontalen Ligaments und des Alveolarknochens. Aufgrund der unterschiedlichen Zusammensetzung der beiden unterstützenden Gewebe scheinen ähnliche Gewebereaktionen um ein Implantat und einen Zahn äußerst unwahrscheinlich. Der Begriff „Osseo-Insuffizienz“ wurde von Zarb und Koka vorgeschlagen, um den Unterschied zwischen Periimplantitis und parodontal bedingtem Knochenverlust zu beschreiben. Das anatomische Bild der Knochenresorption aufgrund von Parodontitis oder Periimplantitis unterscheidet sich in vielen Situationen, wobei sehr breite Knochenkübel typisch für das Implantat, jedoch nicht für den Zahn sind. Daher kann Periimplantitis als von Parodontitis unterschieden betrachtet werden, da sie sich erheblich in Bezug auf Beginn und Fortschritt unterscheidet und eine schlechte Behandlungsprognose aufweist; folglich muss ihre Behandlung auf eine frühzeitige Diagnose und die Kontrolle der Risikofaktoren oder Indikatoren fokussiert werden, um ihr Auftreten zu verhindern.
Bis heute gibt es keine standardisierten Parameter, um die verschiedenen Stadien und Schweregrade der Periimplantitis klinisch zu unterscheiden. Die Kriterien zur Diagnose von Periimplantitis bleiben unklar. Die meisten bestehenden Studien verwendeten klinische Parameter in Kombination mit radiografischen Befunden, um Periimplantitis zu definieren. Klinische Parameter wie BOP und PPD um Implantate sind jedoch weniger vorhersagbar, da sie von mehr Störfaktoren beeinflusst werden als die natürliche Dentition. Darüber hinaus könnte jeder Faktor, der die Plaquebildung erleichtert (z. B. schlechte Mundhygiene) oder die Abwehrfähigkeit des Wirts (z. B. Rauchergewohnheiten, übermäßiger Alkoholkonsum, genetische Merkmale, Vorgeschichte von Parodontitis oder Verwendung von Bisphosphonaten), zur Entwicklung von Periimplantitis beitragen. Die Diagnose und der Verlauf der Periimplantitis können durch erhöhte Messwerte für klinische Parameter (PPD, BOP, SUP oder sogar Mobilität), MBL und Mikrobiologie gekennzeichnet sein. In Bezug auf klinische Parameter ist PPD eine gültige Bewertungsmethode, da eine Korrelation zwischen den aufgezeichneten Knochenständen und der radiografischen Sondendurchdringung besteht. Dennoch waren in einer Querschnittsstudie die intraoperativ gemessenen periimplantären Knochenstände apikaler als die radiografischen Knochenstände. SUP tritt häufiger bei Implantaten mit als ohne fortschreitendem Knochenverlust auf, insbesondere bei Rauchern, und kann mit Episoden aktiver Gewebezerstörung verbunden sein. In einer systematischen Übersicht definierten Berglundh et al. Periimplantitis als PPD ≥ 6 mm oder MBL ≥ 2,5 mm. Lang und Berglundh erklärten im Konsens der Europäischen Föderation für Parodontologie von 2011, dass klinische und radiografische Daten routinemäßig nach der Protheseninstallation auf Implantaten erhoben werden sollten, um eine Basislinie für die Diagnose von Periimplantitis während der Betreuung von Implantatpatienten zu schaffen. Eine Meta-Analyse von Derks und Tomasi zeigte eindeutig eine positive Beziehung zwischen der Prävalenz von Periimplantitis und der Funktionszeit. Das Vorhandensein von Knochenverlust und PPD allein reicht möglicherweise nicht aus, um eine Diagnose von Periimplantitis zu stellen. Ein wichtiger Faktor, der potenziell die große Bandbreite der Prävalenz von Periimplantitis beeinflusst, ist der Mangel an Konsens bezüglich der klinischen Parameter. Zum Beispiel berichtete eine Studie, dass, wenn PPD > 4 mm als Kriterium verwendet wurde, 74,8 % der Personen Periimplantitis hatten, aber wenn diese Messung auf > 6 mm geändert wurde, fiel die Prävalenz auf 43,9 %. Wenn radiografisches MBL zur Definition von Periimplantitis herangezogen wurde, zeigten 25,3 % der Personen > 2 mm, während 13,1 % > 3 mm hatten. Tatsächlich kann, wenn PPD berücksichtigt wird, eine weitere Heterogenität festgestellt werden. Das Sondieren um Implantate wird von vielen Faktoren beeinflusst, wie der Größe der Sonde, der Sondierkraft, der Richtung der Sonde, der Gesundheit und Dicke des periimplantären Weichgewebes sowie dem Design des Implantathals und der Suprastruktur.1 Tatsächlich können das platform-switched Design sowie fehlerhafte Restaurationen das Sondieren komplizieren und somit das wahre Ausmaß der Periimplantitis verbergen. Darüber hinaus kann das Vorhandensein von Diskrepanzen in den buccolingualen Hart- und Weichgewebsniveaus zu unterschiedlichen PPD-Messungen führen.
Aufgrund des Mangels an standardisierten Parametern zur Bestimmung der Anwesenheit und Schwere von periimplantären Erkrankungen ist es schwierig, eine klinische Strategie basierend auf PPD zur Bewältigung dieses häufigen Problems in der Implantatzahnheilkunde zu entwickeln. Froum und Rosen schlugen jedoch ein Klassifikationssystem vor, um die Schwere der Periimplantitis basierend auf PPD, MBL und klinischen Anzeichen von BOP und/oder SUP zu bestimmen,28 aber dieses System muss noch validiert werden. Darüber hinaus wurde in einer Reihe von Studien von Merli et al. die Interrater-Zustimmung bei der Diagnose von periimplantären Erkrankungen als lediglich gut beurteilt, aufgrund der unklaren Definition von Periimplantitis und Mukositis, wobei vollständige Übereinstimmung nur in der Hälfte der Fälle (52%) erzielt wurde.
Die überwiegende Mehrheit (45%) der in dieser Übersicht einbezogenen Studien fand radiografisches MBL > 1–2 mm nach prothetischer Belastung. Daher werden die folgenden Kriterien zur Definition von Periimplantitis vorgeschlagen: ein radiografisches MBL > 1 mm nach der Lieferung der Implantatprothese oder 2 mm mindestens sechs Monate nach der Platzierung der Implantatprothese als guter Indikator für Periimplantitis. BOP hat aufgrund der schwachen Weichgewebeverbindung um Zahnimplantate keinen hohen prädiktiven Wert. Ebenso hängt PPD weitgehend vom Implantatdesign (Knochen- vs. Gewebebene), der apikokoronalem Position und dem Biotyp ab. Aus den extrahierten Daten scheint es logisch, radiografisches MBL als den einheitlichsten und genauesten Indikator für Periimplantitis zu betrachten. Obwohl der Grenzwert vom entzündlichen Muster des Patienten, der Art der Operation, der apikokoronalem Implantatposition, dem Makrodesign des Implantats und dem kreisförmigen Modul abhängt, muss angesichts des schnellen Krankheitsverlaufs über die Zeit eine strenge radiografische Kontrolle durchgeführt werden, wenn ein klinisches Symptom festgestellt wird. Darüber hinaus muss der Kliniker eine Kombination der vielen verfügbaren klinischen Parameter verwenden, wie PPD, entzündlichen Status der Mukosa, BOP bei leichtem Sondieren, radiografisches MBL und möglicherweise bakterielle und/oder periimplantäre Zervikalflüssigkeitsbiomarker, um eine genaue Diagnose von Periimplantitis zu stellen. Im Gegensatz zum Fall der Parodontitis kann bakterielle Testung bei der Diagnose von Periimplantitis möglicherweise nicht zuverlässig sein. Dies deutet darauf hin, dass sich die parodontalen und periimplantären Ökosysteme erheblich unterscheiden und daher periimplantäre Erkrankungen nicht immer als Infektionskrankheit betrachtet werden sollten. Ähnlich wurde gezeigt, dass ein solcher Unterschied auch für die Pathogenese gilt. Darüber hinaus wurden keine Beweise gefunden, dass eine primäre Infektion marginale Knochenresorption verursacht hat.
Fazit
Die verfügbaren wissenschaftlichen Literatur deutet auf das Fehlen einer einheitlichen Definition von Periimplantitis hin. Aktuelle Definitionen von Periimplantitis basieren ausschließlich auf klinischen Parametern, ohne andere potenziell verwandte Risikofaktoren der Erkrankung zu berücksichtigen. Zukünftige Studien, die konsistente Falldefinitionen anwenden, sollten in Betracht gezogen werden.
Marco Tallarico, Alberto Monje, Hom-Lay Wang, Pablo Galindo Moreno, Erta Xhanarid & Luigi Canulloe
Literaturverzeichnis
- Levignac J. [Periimplantationsosteolyse— Periimplantose—Periimplantitis]. Rev Fr Odontostomatol. 1965 Okt;12(8):1251–60. Französisch.
- Hämmerle CH, Glauser R. Klinische Bewertung der Zahnimplantatbehandlung. Periodontol 2000. 2004 Feb;34:230–9.
- Schwarz F, Becker K, Sager M. Wirksamkeit der professionell durchgeführten Plaqueentfernung mit oder ohne ergänzende Maßnahmen zur Behandlung von Periimplantitis. Eine systematische Übersicht und Metaanalyse. J Clin Periodontol. 2015 Apr;42 Suppl 16:S202–13.
- Atieh MA, Alsabeeha NH, Faggion CM, Duncan WJ. Die Häufigkeit von periimplantären Erkrankungen: eine systematische Übersicht und Metaanalyse. J Periodontol. 2013 Nov;84(11):1586–98.
- Zitzmann NU, Margolin MD, Filippi A, Weiger R, Krastl G. Patientenbewertung und Diagnose in der Implantatbehandlung. Aust Dent J. 2008 Jun;53 Suppl 1:S3–10.
- Sanz M, Chapple IL; Arbeitsgruppe 4 des VIII. Europäischen Workshops zur Parodontalforschung. Klinische Forschung zu periimplantären Erkrankungen: Konsensbericht der Arbeitsgruppe 4. J Clin Periodontol. 2012 Feb;39 Suppl 12:202–6.
- American Academy of Periodontology. Akademiebericht: Periimplantäre Mukositis und Periimplantitis: ein aktuelles Verständnis ihrer Diagnosen und klinischen Implikationen. J Periodontol. 2013 Apr;84(4):436–43.
- Lang NP, Berglundh T; Arbeitsgruppe 4 des Siebten Europäischen Workshops zur Parodontalforschung. Periimplantäre Erkrankungen: wo stehen wir jetzt?—Konsens des Siebten Europäischen Workshops zur Parodontalforschung. J Clin Periodontol. 2011 Mar;38 Suppl 11:178–81.
- Chan HL, Lin GH, Suarez F, MacEachern M, Wang HL. Chirurgische Behandlung von Periimplantitis: eine systematische Übersicht und Metaanalyse der Behandlungsergebnisse. J Periodontol. 2014 Aug;85(8):1027–41.
- Lindhe J, Meyle J; Gruppe D des Europäischen Workshops zur Parodontalforschung. Periimplantäre Erkrankungen: Konsensbericht des Sechsten Europäischen Workshops zur Parodontalforschung. J Clin Periodontol. 2008 Sep;35(8 Suppl):282–5.
- Mombelli A, Müller N, Cionca N. Die Epidemiologie der Periimplantitis. Clin Oral Implants Res. 2012 Okt;23 Suppl 6:67–76.