Crestal Sinuslift mit einem Implantat mit internem L-förmigem Kanal: Ergebnisse nach 1 Jahr nach der Belastung aus einer prospektiven Kohortenstudie
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zweck: Bewertung der klinischen und radiografischen Ergebnisse eines einstufigen crestal Sinushebung-Verfahrens unter Verwendung eines selbstschneidenden endossose Implantatsystems (iRaise, Maxillent, Herzliya, Israel), das für die Sinusaugmentation entwickelt wurde, 1 Jahr nach der Belastung.
Materialien und Methoden: Patienten, die eine Restauration im hinteren Oberkiefer mit einem residualen alveolären Kamm von 3 bis 8 mm Höhe und 5 mm Breite distal zum Caninus benötigten, wie auf dem CBCT-Scan gemessen, wurden mit dem iRaise Sinuslift-System behandelt. Die Ergebnisparameter waren: Implantat- und prothetische Misserfolge, Komplikationen, erhöhte Knochenhöhe (iBH), marginaler Knochenverlust (MBL), Implantatstabilitätsquotient (ISQ), radiografische Gewebeumbau-Muster unter Verwendung des Sinusgraft-Umbau-Index (SGRI), volumetrische Messungen des Sinusgrafts, selbstberichtete postoperative Schwellung der Patienten, Verbrauch von Schmerzmitteln und histologische Analyse.
Ergebnisse: Insgesamt nahmen 30 aufeinanderfolgende Teilnehmer mit einem Durchschnittsalter von 54,2 ± 9,4 Jahren an einer transkrestalen Elevation der Sinusmembran, der Einsetzung eines Knochenersatzmaterials und der Implantation teil. Insgesamt wurden 50 Implantate eingesetzt (30 iRaise-Systemimplantate und 20 ergänzende iSure-Implantate, Maxillent). Die durchschnittliche Nachbeobachtungszeit betrug 15,8 ± 2,1 Monate nach der Implantatbelastung. Ein Patient schied bei der Nachuntersuchung ein Jahr nach der Belastung aus. Während der gesamten Nachbeobachtungszeit gab es keine Implantat- und keine Prothesenfehler. Ein Patient erlitt einen kleinen Membranriss. Vor der Implantation betrug die durchschnittliche Höhe des verbleibenden Alveolarkamms 4,64 ± 0,86 mm (Bereich: 3,4–6,4 mm; 95% CI: 4,39–5,01 mm). Ein Jahr nach der Belastung betrug die Knochenhöhe 16,86 ± 3,13 mm (95% CI 15,83–18,07 mm). Bei der Nachuntersuchung ein Jahr nach der Belastung betrug der durchschnittliche MBL 0,19 ± 1,05 mm (95% CI 0,02–0,78 mm). Der durchschnittliche ISQ bei der Implantation betrug 65,2 ± 5,4 (95% CI 63,6–67,4) und stieg während der Heilungsphase auf den Durchschnittswert von 73,6 ± 3,7 (95% CI 73,1–75,9; Bereich 62–79). Der Unterschied war statistisch signifikant (8,4 ± 5,3; 95% CI 5,9–39,7; P = 0,0000). Ein Jahr nach der Belastung wurde der SGRI-Score bei 23 Implantaten ausgewertet. Insgesamt betrug der durchschnittliche SGRI-Wert 2,29 ± 2,41 mm (95% CI 1,22–2,98 mm). Das Knochenvolumen bei der Implantation betrug 2,41 ± 0,25 CC (95% CI 2,22–2,48 CC). Während der 6-monatigen, submersen Heilungsphase wurde eine leichte Knochenkontraktion von 11,3% beobachtet. (2,13 ± 0,24 CC; 95% CI 2,02–2,26; Unterschied = 0,27 ± 0,25 CC; 95% CI 0,10–0,36; P = 0,0011). Im ersten Jahr nach der Belastung blieb das Knochenersatzmaterial stabil (2,11 ± 0,22 CC; 95% CI 2,02–2,24). Der Unterschied war nicht statistisch signifikant (0,02 ± 0,07 CC; 95% CI 0,01–0,04; P = 0,2166). Aus der Sicht der Patienten betrug der durchschnittliche Schmerzwert 0,52 ± 0,74 (Bereich 0–3); der durchschnittliche Schwellungswert betrug 0,27 ± 0,52 (Bereich 0–2); und der durchschnittliche Verbrauch von Analgetika betrug 0,87 ± 4,94 Tabletten (Bereich 0–4) 3 Tage nach der Operation. Morphologische und histomorphometrische Analysen zeigten, dass alle Proben sechs Monate nach der Heilung eine normale Struktur ohne entzündlichen Infiltrat aufwiesen. Die folgenden Fraktionen (%) wurden gefunden: Knochen (unreifer Knochen + reifer Knochen): 44,07 ± 4,91; verbleibendes Biomaterial: 23,98 ± 2,64; Markräume: 31,95 ± 3,16.
Schlussfolgerungen: Die Sinusbodenaugmentation kann erfolgreich mit einem transkrestalen Ansatz unter Verwendung eines speziellen Implantatsystems durchgeführt werden. Während der ersten 6 Monate der Heilung wurde eine physiologische Kontraktion von 11,3 % des ursprünglichen Volumens des Knochenersatzmaterials festgestellt; danach wurde keine weitere Volumenreduktion des Transplantats beobachtet. Langfristige klinische Studien sind erforderlich, um diese vorläufigen Ergebnisse zu bestätigen.
Einleitung
Die gestufte Sinusbodenhebung ist die gängige Lösung für die Implantation bei schwer atrophierter Maxilla. Die Erhöhung des Sinusbodens der Maxille mittels eines lateralen Ansatzes erfordert die Durchführung eines großen mukosalen periostalen Lappens, der zwangsläufig die postoperative Genesung und die zusätzlichen Kosten des Augmentationsverfahrens beeinflusst. Mögliche Komplikationen sind Perforationen der Sinusmembran, Nasenbluten, postoperative Schmerzen, Schwellungen, Hämatome und Sinusinfektionen.
Die Erhöhung des Bodens der Kieferhöhle durch den Alveolarkamm (transalveolar) wurde erstmals von Tatum Ende der 1970er Jahre beschrieben und 1980 erstmals von Boyne veröffentlicht. Die Technik wurde mehrfach modifiziert. Die Hauptanliegen dieser Technik sind die begrenzte Menge an Knochenaugmentation, kein visueller Zugang zur Stelle, das Risiko einer Perforation der Schneider-Membran und postoperative Symptome.
Eine geschlossene transcrestale hydraulische Erhöhung der Schneider-Membran und eine gleichzeitige Knochenaugmentation können unter Verwendung eines speziellen Zahnimplantats durchgeführt werden. Dieser Ansatz unterscheidet sich hauptsächlich von zuvor beschriebenen hydraulischen Techniken, da die Erhöhung der Schneider-Membran und die Knochenaugmentation beide durch das Implantat erfolgen.
Im Allgemeinen erhöhen Sinuslift-Verfahren angemessen die vertikale Dimension des resorbierten Alveolarkamms im hinteren Oberkiefer, wodurch die Platzierung von Implantaten ausreichender Länge ermöglicht wird. Die in der Literatur berichtete Volumenrückgangsrate des Transplantats liegt zwischen 20 % und 50 % sowohl für autogenes Knochenmaterial als auch für Knochenersatzmaterialien wie demineralisiertes gefriergetrocknetes Knochenallograft (DFDBA), mineralisiertes gefriergetrocknetes Knochenallograft (FDBA) und Xenotransplantate. In den letzten Jahren haben resorbierbare Biokeramiken, die aus einer Mischung von Hydroxylapatit und beta-Tricalciumphosphat bestehen, an Popularität gewonnen und zeigen Bioaktivität und Osteokonduktivität in verschiedenen histologischen Studien. Dennoch ist die Verwendung von Knochenersatzmaterialien fraglich, wenn mehr als 3 mm Knochenhöhe vorhanden ist.
Ein vorläufiger 6-Monats-Bericht aus dieser Studie über die ersten 18 Patienten zeigte eine physiologische Kontraktion von 13,9 % des ursprünglichen Volumens des Knochenmaterials unter Verwendung des iRaise Sinus Lift Systems. Die vorliegende Studie bewertete die klinischen und radiografischen Ergebnisse eines einstufigen, kreisförmigen Sinushebung-Verfahrens unter Verwendung eines selbstschneidenden endossose Implantatsystems (iRaise, Maxillent, Herzliya, Israel), das für die Sinusaugmentation entwickelt wurde, unter Verwendung von Cone-Beam-Computertomographie (CBCT), 1 Jahr nach der Belastung. Diese Studie folgte der Erklärung zur Stärkung der Berichterstattung über Beobachtungsstudien in der Epidemiologie (STROBE), um die Qualität von Beobachtungsstudien zu verbessern (http://www.strobe-statement.org).
Materialien und Methoden
Diese Studie wurde als prospektive Beobachtungsstudie konzipiert. Die Patienten wurden zwischen September und Dezember 2014 in einer Privatpraxis in Rom, Italien, behandelt. Alle Patienten wurden über die Natur der Studie informiert und gaben ihre schriftliche Einwilligung zu chirurgischen und prothetischen Verfahren sowie zur Verwendung klinischer und radiologischer Daten. Die chirurgischen Eingriffe wurden von zwei Klinikern (MT und SMM) durchgeführt, die über umfangreiche Erfahrung in der Implantation und in Verfahren zur Sinusaugmentation verfügen.
Konsekutive Patienten im Alter von 18 Jahren oder älter, die in der Lage sind, eine informierte Einwilligung zu unterschreiben und implantatgestützte Restaurationen benötigen, um ihren atrophen posterioren Oberkiefer zu rehabilitieren, wurden als geeignet für die Aufnahme betrachtet. Der ausgewählte Bereich musste einen residualen alveolären Kamm von mindestens 3 bis 8 mm Höhe und 5 mm Breite distal zum Caninus aufweisen, gemessen mit einem CBCT-Scan.
Ausschlusskriterien waren:
- Allgemeine Kontraindikationen für die Implantatchirurgie;
- Vor weniger als 1 Jahr einer Bestrahlung im Kopf- und Halsbereich unterzogen;
- Unkontrollierter Diabetes;
- Schwanger oder stillend;
- Substanzmissbrauch;
- Starker Raucher (≥ 11 Zigaretten/Tag);
- Psychiatrische Therapie oder unrealistische Erwartungen;
- Immunsuppressiv oder immungeschwächt;
- Behandelt oder in Behandlung mit oralen oder intravenösen Aminobisphosphonaten;
- Fehlende gegenüberliegende okklusale Dentition/Prothese im Bereich der geplanten Implantatplatzierung;
- Schwerer Bruxismus oder Zähneknirschen;
- Heilte Stellen (mindestens 3 Monate nach Zahnextraktionen);
- Unbehandelte Parodontitis;
- Schlechte Mundhygiene und Motivation (vollständige Mundblutung bei Sondierung und vollständiger Mundplaque-Index > 25%);
- Patienten, die an anderen Studien teilnehmen, wenn dies die ordnungsgemäße Durchführung des vorliegenden Protokolls verhindert.
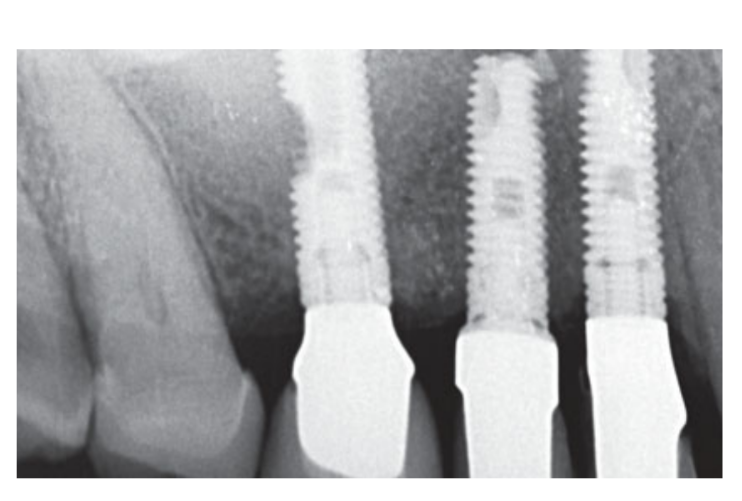
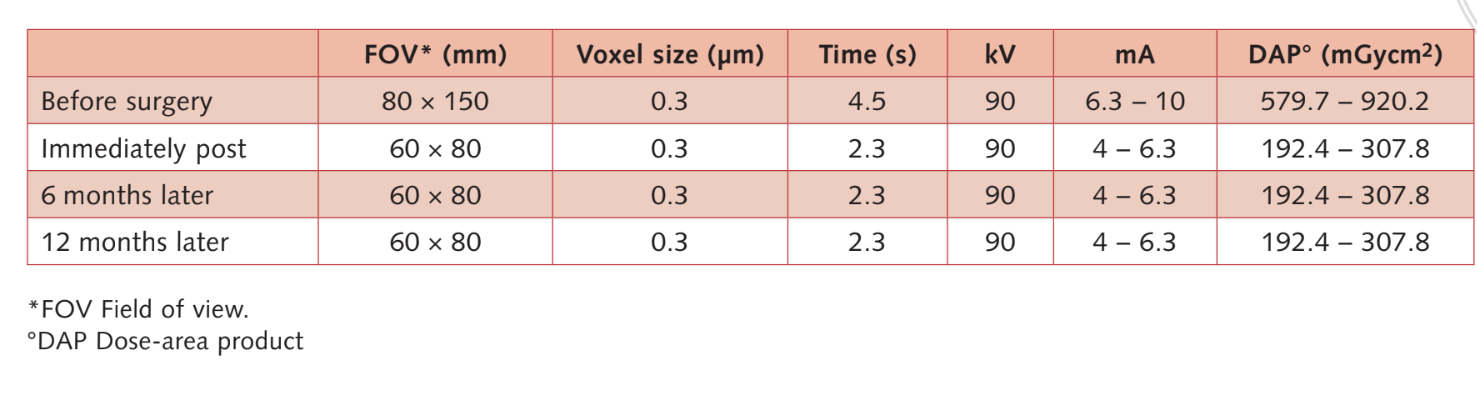
Moderate Raucher wurden einbezogen und die Patienten wurden als Nichtraucher oder moderate Raucher (≤ 10 Zigaretten/Tag) kategorisiert. Präoperative panoramische oder periapikale Röntgenaufnahmen und Bilder wurden für das erste Screening verwendet (Abb. 1 und 2). Cone-Beam-Computertomographie-Scans wurden für jeden Patienten innerhalb von 2 Wochen vor der Operation durchgeführt (Sichtfeld 80 A~ 150 mm; Voxelegröße 0,3 μm; 4,5 s; 90 kV; 6,3–10 mA; 579,7–920,9 mGy cm2), unmittelbar nach dem Eingriff, 6 Monate nach der Implantation und 1 Jahr nach der Belastung (Sichtfeld 60 Å~ 80 mm; Voxelegröße 0,3 μm; 2,3 s; 90 kV; 5–8 mA; 192,4–307,8 mGy cm2) als Teil des regulären Behandlungsprotokolls. Die Belichtungsparameter wurden so niedrig wie vernünftigerweise möglich eingestellt.
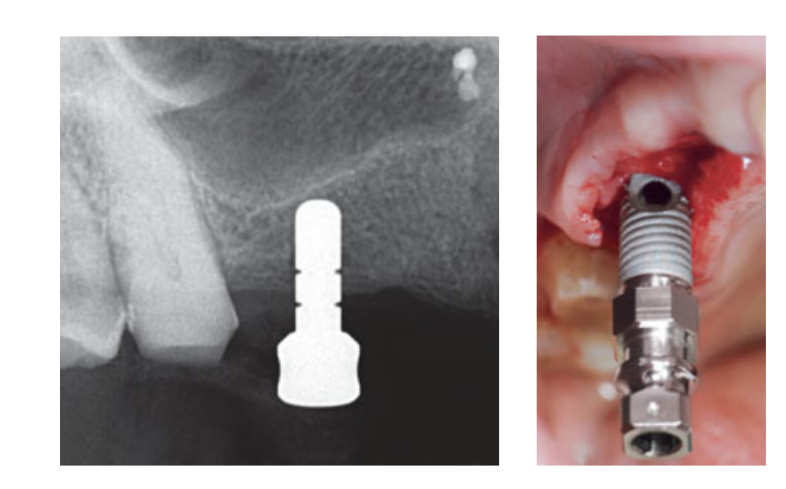
Die intranasale Sprühtherapie (Thiamphenicolglycinate-Acetylcystein 810 mg/4 ml) und Cortison (Betamethason 1 mg) wurden zweimal täglich ab dem Tag vor der Operation verabreicht. Am Tag der Operation wurde eine Einzeldosis Antibiotikum (2 g Amoxicillin und Clavulansäure oder 600 mg Clindamycin, falls Allergie gegen Penicillin) prophylaktisch 1 Stunde vor der Operation verabreicht. Eine Chlorhexidin 0,2% Mundspülung wurde 1 Minute vor der Operation verabreicht. Eine lokale Anästhesie mit Articain und Adrenalin 1:100.000 wurde verabreicht. Ein Mittelschnitt wurde gemacht und ein vollschichtiges Mukoperiostlappen wurde angehoben. Die Implantatempfangsstellen wurden gemäß dem vom Hersteller vorgeschlagenen Bohrprotokoll vorbereitet (Abb. 3a). Bohrstopps und Tiefenführungen wurden verwendet, um eine präzise und sichere Kontrolle der Osteotomietiefe zu erreichen. Die Länge des Implantats (von 13 bis 16 mm) wurde im Voraus basierend auf der verbleibenden Knochenhöhe ausgewählt, die mithilfe der präoperativen CBCT-Scans von der Knochenkante bis zum Boden der Kieferhöhle entlang der geplanten Implantachse gemessen wurde, und dies wurde mit speziellen radiografischen Werkzeugen (Maxillent) bestätigt. Die iRaise Sinus Lift Implantate (Maxillent) wurden in die Osteotomiestellen eingesetzt, wobei die Öffnung des Implantats mittig buccal ausgerichtet war und ein sichtbares Schraubengewinde über der Öffnung blieb (Abb. 3b). Der Einweg-Rohrverbinder wurde an den Implantatanschluss geschraubt. Der Verbinder berührt das Implantat nur an dem Silikonring (medizinisches Silikon, das für die Implantation vorgesehen ist). Dann wurden 2 bis 3 ml Kochsalzlösung sanft durch den Rohrverbinder und den internen L-förmigen Kanal des Implantats (Durchmesser 1,5 mm), der vom prothetischen Anschluss und somit von der Mundhöhle isoliert ist, in die Kieferhöhle injiziert. Die Kochsalzlösung wurde in die Spritze zurückgezogen und eine leichte physiologische Blutung wurde in der zurückgezogenen Kochsalzlösung festgestellt. Danach wurde eine Spritze, die mit 1 ml fließfähigem Knochenersatzmaterial (MBCP Gel, Biomatlante, Vigneux-de-Bretagne, Frankreich) gefüllt war, mit 0,1 ml 0,9% steriler Kochsalzlösung gemischt, die langsam durch denselben Anschluss injiziert wurde. Das MBCP Gel ist ein 100% synthetischer injizierbarer Knochenersatz, der aus 60% biphasischem Calciumphosphat und 40% Hydroxylapatit besteht, das in einem löslichen Polymer suspendiert ist, mit einer Granulometrie von 80 bis 200 μm. Nach Abschluss des Transplantationsverfahrens wurde das hydraulische System getrennt und die gesamte Länge des Implantats wurde in die Osteotomiestelle und die transplantierte Kieferhöhlenhöhle eingesetzt und zur Heilung für 6 Monate belassen, gemäß einem submarierten Protokoll. Zusätzliche Implantate (iSure, Maxillent) wurden im behandelten Bereich nach Abschluss der iRaise (Maxillent) chirurgischen Sequenz platziert oder 6 Monate später in Fällen, in denen die Patienten eine verbleibende Knochenhöhe von ≤ 3 mm an der geplanten Stelle hatten.
Die intranasale Sprühtherapie (Thiamphenicolglycinate-Acetylcystein 810 mg/4 ml) und Cortison (Betamethason 1 mg) wurden 10 Tage nach der Operation fortgesetzt. Antibiotika wurden 7 Tage nach der Operation fortgesetzt (1 g Amoxicillin und Clavulansäure oder 300 mg Clindamycin zweimal täglich). Chlorhexidin 0,2% Mundspülung wurde 1 Minute lang zweimal täglich für 2 Wochen verwendet, und eine weiche Diät wurde für 1 Monat empfohlen. Ibuprofen 400 mg oder Paracetamol 1 g wurde bei Schmerzen verabreicht. Die Nähte wurden nach 1 Woche entfernt und die Anweisungen zur Mundhygiene wurden verstärkt.
Sechs Monate nach der Implantation und Sinusaugmentation wurden die Heilungsabutments verbunden. Bei Patienten, die gestaffelte Implantate benötigten, wurde ein kalibrierter Trephine-Bohrer mit einem äußeren Durchmesser von 3,0 mm verwendet, um die Stelle vorzubereiten, und eine Kernprobe wurde für die histologische Analyse entnommen.
Zwei Wochen nach der zweiten Operation wurde ein offener Tray-Abdruck mit einem Polyether-Material (Impregum, 3M ESPE, Seefeld, Deutschland) genommen. Es wurden keine temporären Restaurationen verwendet. Die endgültigen Restaurationen wurden mit Computer-aided Design (CAD)/ Computer-aided Manufacturing (CAM) Technologie hergestellt und 4 (Einzelkronen) bis 6 Wochen (feste Prothesen) später geliefert. Der Okklusion wurde dann sorgfältig überprüft. Recall-Termine zur Mundhygiene wurden alle 4 Monate nach der Belastung vereinbart. Die Okklusion wurde auch bei jedem Besuch bewertet (Abb. 4 und 5).
Ergebnismaße
Die Ergebnismaße dieser Studie waren:
- Ein Implantat wurde als Misserfolg betrachtet, wenn es eine Mobilität aufwies, die durch Klopfen oder Wackeln des Implantatkopfes mit den metallischen Griffen zweier Instrumente beurteilt wurde, und/oder eine Infektion vorlag, die die Entfernung des Implantats erforderte, oder wenn mechanische Komplikationen (z.B. Implantatbruch) das Implantat unbrauchbar machten, obwohl es noch mechanisch stabil im Knochen war. Die radiografische Bewertung erfolgte mittels einer intraoralen Röntgenaufnahme, die mit einer parallelen Technik strikt senkrecht zur Implantat-Knochen-Grenze aufgenommen wurde.
- Eine Prothese wurde als Misserfolg betrachtet, wenn sie durch eine alternative Prothese ersetzt werden musste.
- Alle biologischen (Schmerzen, Schwellungen oder Eiterung usw.) und/oder mechanischen (Schraubenlockerung oder Bruch des Gerüsts und/oder des Verblendmaterials usw.) Komplikationen.
- Änderungen des marginalen Knochenlevels wurden durch intraorale digitale periapikale Röntgenaufnahmen (Digora Optime Gerät, Soredex, Tuusula, Finnland; Bildplatte, PSP [Photo Stimulable Phosphorplatte] Größe 2, Pixelgröße 30 μm, Auflösung 17 lp/mm) bewertet, die mit der parallelen Technik unter Verwendung handelsüblicher Filmhalter (Rinn XCP; Dentsply Rinn, Elgin, IL, USA) bei der Implantatplatzierung (Basislinie), der Implantatbelastung und 1 Jahr nach der Belastung gemacht wurden. Im Falle einer unleserlichen Röntgenaufnahme wurde die Röntgenaufnahme erneut gemacht. Alle Röntgenaufnahmen wurden in einer Bildanalyse-Software (DfW 2.8 für Windows, Soredex) angezeigt, die mit der bekannten Länge oder dem Durchmesser der Zahnimplantate kalibriert wurde. Der Abstand vom koronalsten Rand des Implantatkragens bis zur Spitze des Knochenkamms wurde auf die nächste 0,01 mm gemessen und als marginales Knochenlevel betrachtet. Mesiale und distale Werte wurden für jedes Implantat gemittelt. Der negative Unterschied zwischen den Zeitpunkten wurde als marginaler Knochenverlust (MBL) betrachtet.
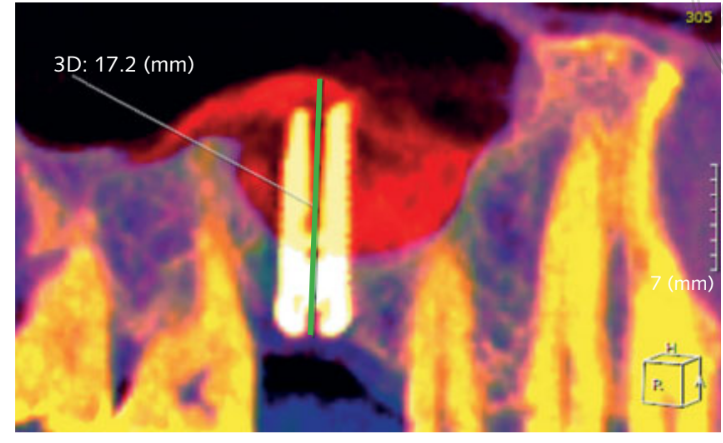
- Die erhöhte Knochenhöhe (iBH) wurde im CBCT-Scan als der Abstand zwischen dem Knochenkamm und dem höchsten radiopaken Zeichen des Transplantatmaterials berechnet, gemessen entlang der langen Achse des Implantats. Der Knochenzuwachs wurde durch den Unterschied zwischen der iBH und der präoperativen residualen alveolären Knochenhöhe (aBH) bestimmt, berechnet als der Abstand zwischen dem Knochenkamm und dem Boden der Kieferhöhle, gemessen entlang der langen Achse an der idealen Implantatposition (Abb. 6).
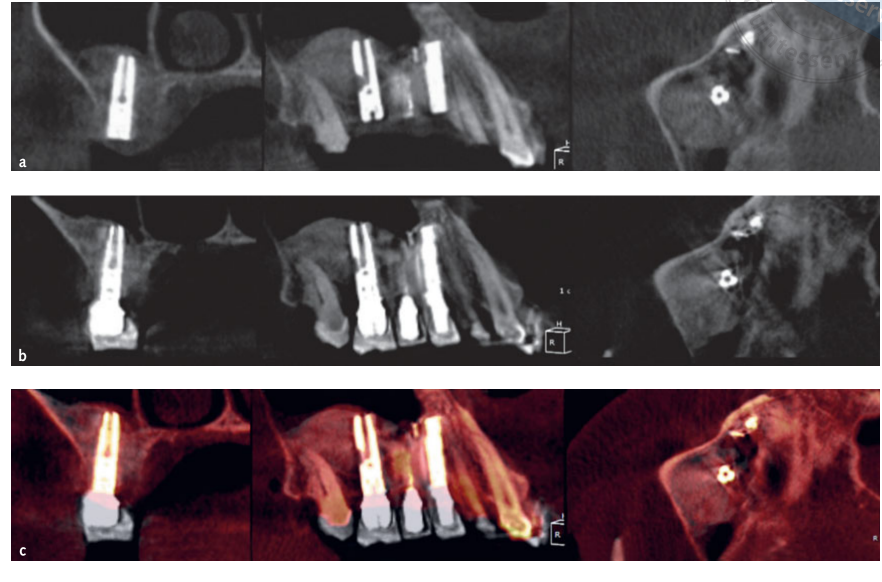
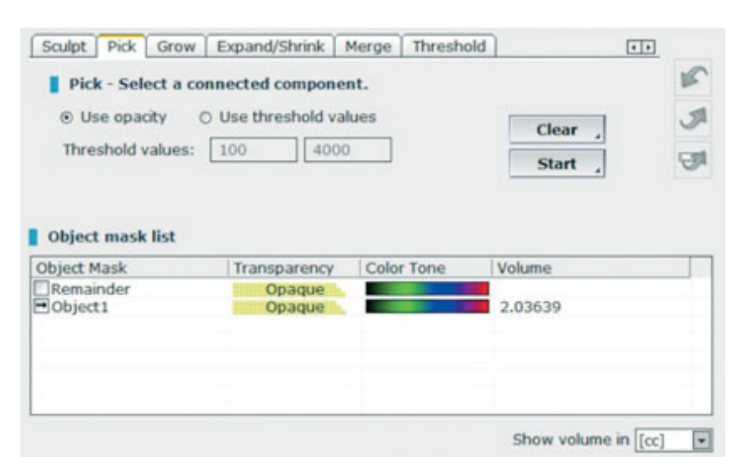
- Volumetrische Messungen von Sinusgrafts wurden im CBCT-Scan unter Verwendung der OnDemand 3D-Software, Fusion ergänzendes Modul (Cybermed, Yuseong-gu, Daejeon, Korea) (Abb. 7) durchgeführt. Fusion ist ein Visualisierungstool, das eine fortschrittliche Registrierungstechnik nutzt, um Volumendaten unter Verwendung von Voxelinformationen zu überlagern. Die Technologie hinter Fusion, bekannt als MI oder Mutual Information, berechnet die statistische Abhängigkeit zwischen zwei Volumina, die Intensitäts- und Korrelationswerte der Entropie und vergleicht den Unterschied in der Entropie der Summe einzelner Bilder und der gemeinsamen Entropie kombinierter Bilder, um Daten zusammenzuführen. Überlagerungen der postoperativen und präoperativen DICOM-Daten des Patienten wurden automatisch erstellt, indem ein Volumen von Interesse (VOI) über einen Bereich mit unveränderten anatomischen Landmarken (z.B. Zähne, basaler Schädel, Implantate) gezeichnet und manuell auf vollständige Übereinstimmung überprüft wurde, um die höchste Genauigkeit für die Überlagerung sicherzustellen. Anschließend wurden die Volumina des transplantierten Materials im Sinusraum unter Verwendung des Segmentierungstools (OnDemand 3D, Cybermed) berechnet. Dieses Tool liefert volumetrische Informationen basierend auf der Opazität des transplantierten Materials (Abb. 8 und 9). Der segmentierte Bereich umfasste Implantate und Transplantate. Die Implantate konnten jedoch klar von den transplantierten Materialien durch ihre Dichte und Struktur unterschieden werden und wurden von den Messungen ausgeschlossen. Die CBCT-Scans wurden vor der Implantatplatzierung, unmittelbar danach und bei den Nachuntersuchungen nach 6 und 12 Monaten gemäß dem ALARA-Prinzip (as low as reasonably achievable) durchgeführt (Tabelle 1). SMAR (Soredex Metal Artifact Reduction) Technologie wurde verwendet, um Streuungen durch Metallartefakte zu minimieren. Der gleiche Kliniker, der zuvor nicht an der Studie beteiligt war, bewertete alle 2- und 3-dimensionalen radiografischen Messungen.
- Das Einfügedrehmoment wurde bei der Implantatplatzierung mit der chirurgischen Einheit (iChiro Pro, BienAir, Bienne, Schweiz) aufgezeichnet.
- Der Implantat-Stabilitätsquotient (ISQ) wurde vom Chirurgen mittels Resonanzfrequenzanalyse (Osstell Mentor Gerät, Osstell, Göteborg, Schweden) aufgezeichnet. Für jedes Implantat wurden zwei Messungen durchgeführt: eine buccopalatal von der buccalen Seite und eine mesiodistal von der mesialen Seite. Beide Messungen wurden gemittelt, wobei das Ergebnis vom Gerät in ISQ-Einheiten angezeigt wurde, die von 1 bis 100 reichen. Die Werte wurden bei der Implantatplatzierung (Basislinie) und bei der Nachuntersuchung nach 6 Monaten aufgezeichnet.
- Die Patienten berichteten selbst über postchirurgische Schmerzen auf einer ordinalen Skala (0 = keine Schmerzen; 1 = leichte Schmerzen; 2 = mäßige Schmerzen; 3 = starke Schmerzen): 3 Tage nach der Operation beim postoperativen Kontrolltermin von einem blinden Prüfer bewertet.
- Die Patienten berichteten selbst über postchirurgische Schwellungen auf einer ordinalen Skala (0 = keine Schwellung; 1 = leichte Schwellung; 2 = mäßige Schwellung; 3 = starke Schwellung): 3 Tage nach der Operation beim postoperativen Kontrolltermin von dem blinden Prüfer bewertet.
- Verbrauch von Schmerzmitteln: Anzahl der verwendeten Tabletten (von 12 bereitgestellten Tabletten [Ibuprofen 400 mg oder Paracetamol 1 g für Allergiker gegen NSAIDs]): 3 Tage nach der Operation beim postoperativen Kontrolltermin von dem blinden Prüfer aufgezeichnet.
- Histomorphometrische Analysen wurden verwendet, um die Volumenanteile des Gewebes (ausgedrückt als Prozentsatz des Gesamtvolumens), die die Probe (Knochen, Biomaterial, Weichgewebe) zusammensetzten, zu berechnen. Histologische Proben wurden entnommen und in 10% Formalin fixiert und dann in zunehmenden Mengen von Alkohollösungen (70%, 80%, 90%, 96%, 100%) dehydriert, in Alkoholharz in abnehmendem Verhältnis infiltriert (3 Alkohol:1 Harz, 1:1, 1:3, reines Harz) und schließlich in reinem Methylmethacrylat-Harz (Technovit 7200 VLC, Exact Kulzer, Bio-Optica, Mailand, Italien) eingebettet. Danach wurden die Proben in der Mitte mit einer Diamantklinge geschnitten, um zwei Abschnitte für jede Probe zu erhalten. Diese Abschnitte wurden auf Kunststoffobjektträger geklebt, auf eine Dicke von 100 μm geschliffen und schließlich mit Aluminiumoxid 0,1% poliert. Die Proben wurden mit einer dichromatischen Färbung gefärbt, die aus Toluidinblau und Pyronin-Gelb besteht und alle verschiedenen Gewebsfraktionen hervorhebt. Die Objektträger wurden mit einem Licht- und Polarisationsmikroskop (Nikon Eclipse, Nikon Instruments S.p.A, Florenz, Italien) beobachtet und fotografiert.
Statistische Analyse
Alle Datenanalysen wurden gemäß einem vorab festgelegten Analyseplan durchgeführt. Die deskriptive Analyse wurde unter Verwendung des Mittelwerts ± Standardabweichung (SD), Median und 95% Konfidenzintervall (CI) (SPSS für Mac OS X Version 22.0, IBM Corporation, Armonk, New York, USA) durchgeführt. Vergleiche zwischen den verschiedenen Follow-up-Endpunkten und den Basiswertmessungen wurden mittels eines gepaarten Student-t-Tests durchgeführt, um Änderungen festzustellen. Alle statistischen Vergleiche wurden auf dem Signifikanzniveau von 0,05 durchgeführt. Die Patienten wurden als statistische Einheit verwendet.
Ergebnisse
Insgesamt wurden 33 Patienten auf ihre Eignung überprüft, aber drei weigerten sich dann, am Forschungsprotokoll teilzunehmen. Daher nahmen 30 aufeinanderfolgende Teilnehmer (17 Frauen, 13 Männer) mit einem Durchschnittsalter von 54,2 ± 9,4 Jahren (Bereich: 28–75) und schwerer Atrophie des hinteren Oberkiefers an der transkrestalen Elevation der Sinusmembran, der Einsetzung von Knochenersatzmaterial und der Implantatplatzierung an der geplanten Stelle teil, ohne Abweichung vom ursprünglichen Protokoll. Die durchschnittliche Nachbeobachtungszeit betrug 15,8 ± 2,1 Monate nach der Implantatbelastung (Bereich: 12–18). Die wichtigsten Patienten- und Implantateigenschaften sind in Tabelle 2 aufgeführt.
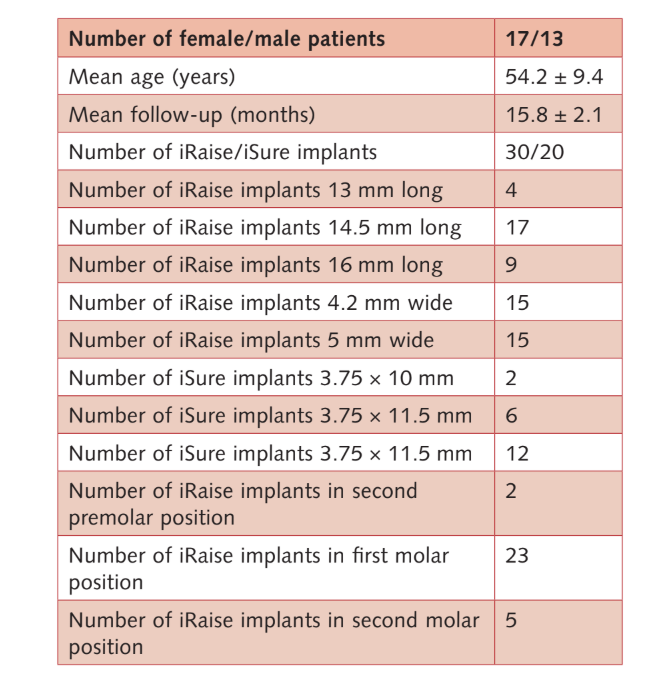
Insgesamt wurden 50 Implantate eingesetzt (30 iRaise-Implantatsysteme und 20 ergänzende iSure-Implantate. Ein Patient brach nach der 1-Jahres-Nachuntersuchung (Patient wollte nicht zu den Bewertungen zurückkommen) aus. Während des Nachbeobachtungszeitraums gab es keine Implantat- und keine Prothesenfehler. Ein Patient erlitt einen kleinen Membranriss, der mit einem Kollagenschwamm (Parasorb Cone, RESORBA Medical GmbH, Nürnberg, Deutschland) versiegelt wurde. Der Eingriff wurde abgebrochen und 2 Monate später erfolgreich wiederholt. Es wurden keine weiteren intraoperativen oder postoperativen unerwünschten Ereignisse beobachtet.
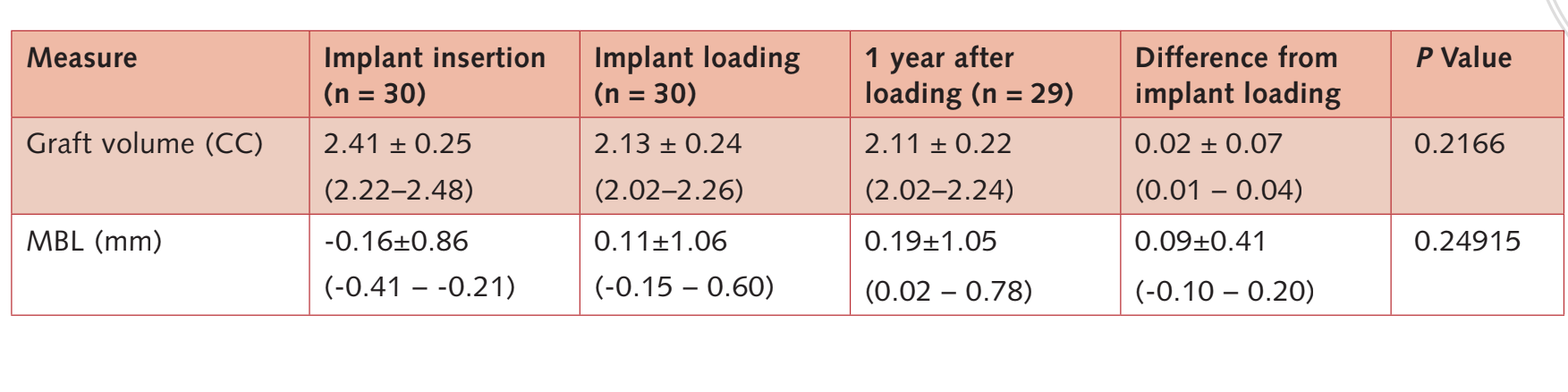
Vor der Implantation betrug die durchschnittliche Höhe des verbleibenden Alveolarkamms 4,64 ± 0,86 mm (Bereich: 3,4–6,4 mm; 95% CI: 4,39 bis 5,01 mm). Unmittelbar nach der Implantation betrug die Knochenhöhe 17,92 ± 2,63 mm (95% CI 17,02 bis 18,90). Ein Jahr nach der Belastung blieb die Knochenhöhe stabil, mit einem Mittelwert von 16,86 ± 3,13 mm (95% CI 15,83 bis 18,07). Der Unterschied betrug 1,09 ± 1,60 mm (95% CI 0,00 bis 1,16; P = 0,0010). Der durchschnittliche Knochenzuwachs (iBH - aBH) im Vergleich zur Ausgangsbasis betrug 12,15 ± 2,96 mm (95% CI 11,22 bis 13,38; P = 0,0000).
Der durchschnittliche marginale Knochenstand bei der Implantation betrug -0,16 ± 0,86 mm (95% CI -0,41 bis -0,21).
Bei der Implantatbelastung betrug der durchschnittliche marginale Knochenstand 0,11 ± 1,06 mm (95% CI -0,15 bis 0,60). Bei der Nachuntersuchung ein Jahr nach der Belastung betrug der durchschnittliche MBL 0,19 ± 1,05 mm (95% CI 0,02 bis 0,78). Der Unterschied zur Ausgangsbasis betrug 0,36 ± 0,53 mm; 95% CI 0,08 bis 0,47; P = 0,00095). Die Daten sind in Tabelle 3 aufgeführt.
Die durchschnittliche Einfügedrehmoment bei der Implantation betrug 31,6 ± 8,1 Ncm (95% CI 29,9 bis 35,7) (iChiro Pro, BienAir). Der durchschnittliche ISQ bei der Implantation betrug 65,2 ± 5,4 (95% CI 63,6 bis 67,4) und nahm während der Heilungsphase zu, wobei ein Durchschnittswert von 73,6 ± 3,7 (95% CI 73,1 bis 75,9; Bereich 62–79) bei der Verbindung des Heilungsabutments (6 Monate nach der Implantation) erreicht wurde. Der Unterschied war statistisch signifikant (8,4 ± 5,3; 95% CI 5,9 bis 39,7; P = 0,0000).
Bei der Implantation wiesen 24 von 30 Implantaten Knochenersatzmaterial über der Implantatspitze auf. Insgesamt (n = 30) betrug der Durchschnittswert 2,95 ± 2,56 mm (95% CI 2,18 bis 4,0). Ein Jahr nach der Belastung wurde durchschnittlich Knochenersatzmaterial über der Spitze in 23 Implantaten beobachtet. Insgesamt (n = 29) betrug der Durchschnittswert 2,29 ± 2,41 mm (95% CI 1,22 bis 2,98).
Das Knochenvolumen bei der Implantation betrug 2,41 ± 0,25 CC (95% CI 2,22 bis 2,48). Während der 6-monatigen submersen Heilungsphase wurde eine leichte Knochenkontraktion von 11,3% beobachtet. (2,13 ± 0,24 CC; 95% CI 2,02 bis 2,26; Unterschied = 0,27 ± 0,25 CC; 95% CI 0,10 bis 0,36; P = 0,0011). Während der ersten postbelastungsphase blieb der Knochenersatz stabil (2,11 ± 0,22 CC; 95% CI 2,02 bis 2,24).
Der Unterschied war statistisch nicht signifikant (0,02 ± 0,07 CC; 95% CI 0,01 bis 0,04; P = 0,2166).
Die Daten sind in Tabelle 3 aufgeführt.
Die Patienten berichteten über ihre Erfahrungen nach der Operation. Der durchschnittliche Schmerzwert betrug 0,52 ± 0,74 (Bereich 0–3); der durchschnittliche Schwellungswert betrug 0,27 ± 0,52 (Bereich 0–2); und der durchschnittliche Verbrauch von Analgetika betrug 0,87 ± 4,94 Tabletten (Bereich 0–4).
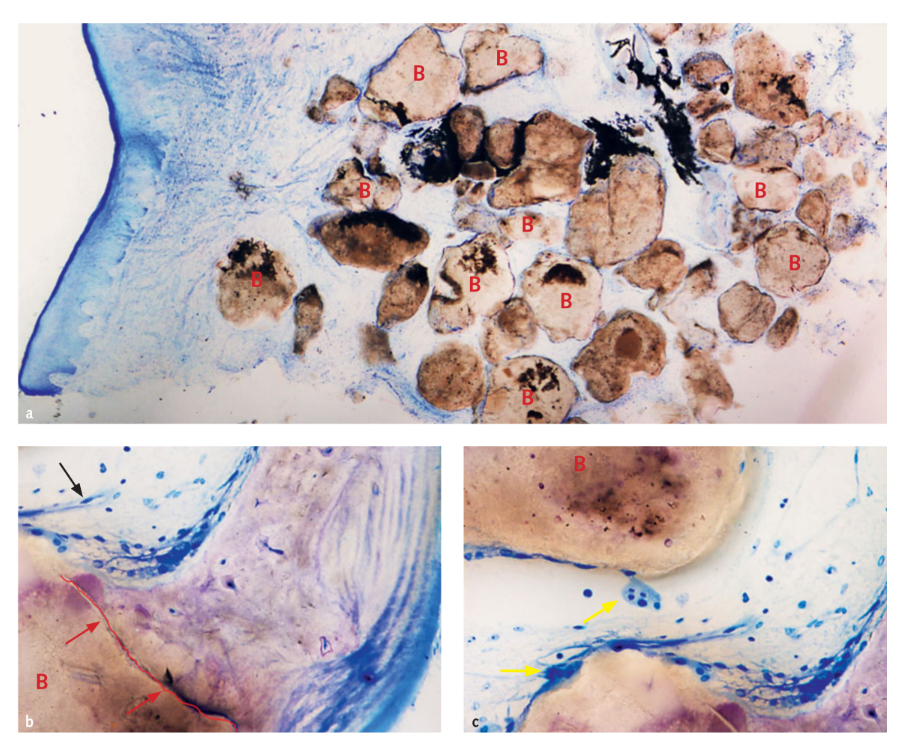
In drei Fällen, in denen ein gestufter, ergänzender Implantat eingesetzt wurde, wurde eine Probe des Transplantats für die histologische Analyse entnommen. Morphologische und histomorphometrische Analysen zeigten, dass nach 6 Monaten Heilung alle Proben eine normale Struktur ohne das Vorhandensein eines entzündlichen Infiltrats aufwiesen (Abb. 10). Das Biomaterial erschien umgeben von mineralisierter Matrix, die auf große Bereiche der Mineralisation sowohl bei niedriger (Abb. 10a) als auch bei hoher Vergrößerung hinweist. In Abbildung 10b zeigt das Mikrofotograph die enge Verbindung zwischen Transplantat und neuer Knochenmatrix. Blutgefäße waren in den Markräumen offensichtlich, vermutlich um das Gewebe während der Phasen der Bildung und Organisation zu unterstützen (Abb. 10b und 10c). Viele Knochenzellen wurden nachgewiesen, insbesondere osteoblastenähnliche Zellen an den Rändern des neuen trabekulären Knochens in engem Kontakt mit Osteoklastenzellen während der aktiven Phase der neuen Knochenbildung und -umbau (Abb. 10c). Die histomorphometrische Analyse zeigte die folgenden Gewebsfraktionen (%): Knochen (unreifer Knochen + reifer Knochen): 44,07% ± 4,91; restliches Biomaterial: 23,98% ± 2,64; Markräume: 31,95% ± 3,16.
Diskussion
Ziel der vorliegenden prospektiven Studie war es, die 1-Jahres-Daten nach der Belastung eines neuartigen Implantatsystems zu berichten, das eine gleichzeitige Sinusgraft- und Implantatplatzierung mittels eines transkrestalen Ansatzes ermöglicht. Da es als prospektive Kohortenstudie konzipiert wurde, besteht die Hauptbeschränkung in der fehlenden Kontrollgruppe. Dennoch ist die vorliegende Studie eine der ersten, die klinische und radiografische Daten aus einem krestalen Sinuslift-Verfahren mit einem speziellen Implantat mit einem internen L-förmigen Kanal 1 Jahr nach der Belastung bewertet. Eine weitere Einschränkung der vorliegenden Studie könnte die Technologie sein, die zur Messung der Knochenvolumenverringerung verwendet wird. Obwohl diese Technologie die Überlagerung und Segmentierung verschiedener Knochenvolumina ermöglicht, liegen keine wissenschaftlichen Beweise vor. Daher sollten die Daten mit Vorsicht interpretiert werden.
Während des gesamten Nachbeobachtungszeitraums gab es keinen Implantatfehler, und es trat nur ein Membranriss auf, ohne weitere unerwünschte Ereignisse. Daher war die wichtigste klinische Überlegung dieser prospektiven Studie, dass die Elevation der Sinusmembran sicher mittels hydraulischem Druck direkt durch den Implantatkanal durchgeführt werden kann, was eine gleichzeitige Knochenaugmentation (auch durch den Kanal) und Implantatplatzierung ermöglicht. Der vorgestellte Ansatz kann mit einem minimalen Restknochen von 3 mm zwischen der Knochenkuppe und dem Sinusboden durchgeführt werden.
Laut der aktuellen Cochrane-Überprüfung von Esposito et al. zu Sinuslift-Verfahren ist die Verwendung von Knochenersatz fraglich, wenn mehr als 3 mm Knochenhöhe vorhanden sind. Dennoch wurden eine Vielzahl von Transplantationsmaterialien, entweder allein oder in Kombination, für die effektive Anwendung in Sinusaugmentation-Verfahren validiert, einschließlich autogenem Knochen, allogenem Knochen, xenogenem Knochen und alloplastischen Materialien (z. B. Hydroxylapatit [HA], beta-Tricalciumphosphat [β-TCP]). In der vorliegenden Studie wurde eine Mischung aus 60% HA und 40% β-TCP verwendet. Ein vorläufiges Manuskript, das die 6 Monate nach der Implantation gesammelten Daten von 18 Patienten berichtete, kam zu dem Schluss, dass während der Heilungsphase eine physiologische Kontraktion von 13,9% des ursprünglichen Volumens des Transplantats auftrat. Die vorliegende Studie analysierte die Gesamtstichprobengröße von 30 Patienten und berichtete von einer leichten Knochenkontraktion von 11,3% während des 6-monatigen Zeitraums der submersion Heilung. Danach blieb das Knochenimplantat stabil, mit einer Kontraktion von 0,95%. Eine aktuelle systematische Überprüfung von Shanbhag et al. zu Sinusaugmentation-Verfahren, die mit einem konventionellen lateralen Ansatz durchgeführt wurden, berichtete von Reduzierungen des Augmentationsvolumens während der frühen Heilung von 18% bis 22%, wenn Knochenersatzstoffe verwendet wurden, ohne signifikante Unterschiede zwischen den Transplantationsmaterialien. Insbesondere in einer randomisierten kontrollierten Studie von Kühl et al. verringerte sich das Volumen innerhalb der ersten 6 Monate der maxillären Sinusaugmentation um 15% für biphasisches Calciumphosphat (BCP, 60% HA und 40% β-TCP) und um 18%, als die Forscher partikulierten autologen Knochen an der Teststelle hinzufügten, ohne statistisch signifikante Unterschiede zwischen den beiden Gruppen. Mehrere andere Studien bestätigten ebenfalls eine Reduzierung des Volumens des Transplantationsmaterials. Hatano et al. schlugen vor, dass autogener Knochen oder Knochenersatz eine dimensionale Kontraktion in der Höhe von 20% bis zu 2 Jahren aufweist. Obwohl autologer Knochen als der Goldstandard gemäß Wiltfang gilt, sind viele Bedenken mit einer beobachteten unvorhersehbaren Resorption verbunden. Diese Aussage wurde von Shanbhag et al. in einer systematischen Überprüfung bestätigt, als autologe Knochenblöcke verwendet wurden, die im Volumen über die Zeit um 45% nach 6 bis 24 Monaten abnahmen. Dieselben Autoren bestätigten, dass anorganischer Rinderknochen, der entweder allein oder in Kombination mit autologem Knochen verwendet wurde, eine Volumenänderung von 15% bis 21% zeigte, was auf eine bessere Volumenstabilität im Vergleich zu autologem Knochen allein hindeutet. Die Ergebnisse dieser Studien unterstützen die Ergebnisse dieser Studie.
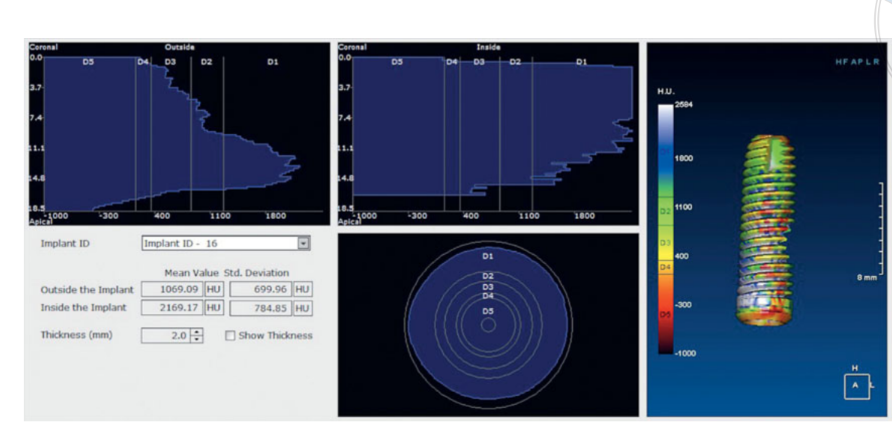
Die Histologie zeigte, dass die Proben nach 6 Monaten durch 44,07 % ± 4,91 Knochen in verschiedenen Mineralisierungsstadien, 23,98 % ± 2,64 verbleibende Transplantatpartikel und 31,95 % ± 3,16 Markräume gekennzeichnet waren. Obwohl etwa die Hälfte des ursprünglich transplantierten Materials 6 Monate nach der submersen Heilung noch vorhanden war, deuteten radiologische Daten aus einer früheren vorläufigen Studie23 darauf hin, dass die Transplantatdichte signifikant von 322,0 ± 100,42 Hounsfield-Einheiten (HU) (Bereich: 177–449 HU; 95 % CI: 246,4 bis 377,6) auf 1.062,0 ± 293,7 HU (Bereich: 573–1.489 HU; 95 % CI: 876,12 bis 1.259,88) verbessert wurde. Dieser Unterschied war statistisch signifikant (740,0 ± 295,35 HU; Bereich: 324–1.231; 95 % CI: 426,04 bis 811,96; P = 0,0001).
Hounsfield-Einheiten beziehen sich auf eine D1-D5-Skala, die auf medizinischen Computertomographie-Werten basiert und bei CBCT-Scans nicht vollständig zuverlässig ist. Laut Cassetta et al. war die HU jedoch gleich den Graudichtewerten multipliziert mit einem Umrechnungsverhältnis von 0,7. Daher deuteten frühere vorläufige Forschungen der vorliegenden Studie auf eine durchschnittliche Transplantatdichte (Abbildung 11) hin, die einem D2-Wert gemäß der Klassifikation von Lekholm und Zarb vergleichbar war. Darüber hinaus zeigten klinische Daten, dass der durchschnittliche ISQ bei der Implantation 65,2 ± 5,4 (95 % CI 63,6 bis 67,4) betrug und während der Heilungsphase anstieg und den Mittelwert von 73,6 ± 3,7 (95 % CI 73,1 bis 75,9; Bereich 62–79) erreichte. Der Unterschied war statistisch signifikant (8,4 ± 5,3; 95 % CI 5,9 bis 39,7; P = 0,0000). Alle diese Daten stimmen mit den hohen Überlebensraten der Implantate überein, wobei während des gesamten Nachbeobachtungszeitraums keine Ausfälle auftraten.
Kurze Implantate wurden als Alternative zu Sinuslift-Verfahren vorgeschlagen. Vorteile von kurzen Implantaten sind ein weniger technisch anspruchsvoller Eingriff, daher potenziell weniger Komplikationen und geringere Kosten (kein Knochenersatz). Daten aus mehreren randomisierten kontrollierten Studien zeigten, dass kurze Implantate von 4 bis 8 mm eine geeignete, einfachere, kostengünstigere und schnellere Alternative zu längeren Implantaten darstellen können, die in augmentiertem Knochen platziert werden. Es wurde auch nachgewiesen, dass Sinuslift-Verfahren mit hydraulischem Druck eine hohe Vorhersagbarkeit der klinischen Ergebnisse bieten, zusammen mit extrem niedriger Morbidität und verkürzten chirurgischen Geweben. Daher stellen sowohl kurze als auch längere Implantate, die in Verbindung mit hydraulischer Sinushöhenhebung platziert werden, tragfähige Behandlungsoptionen dar. Dennoch sind randomisierte kontrollierte Studien erforderlich, und die Nachbeobachtungszeiträume sind noch zu kurz, um definitive Schlussfolgerungen über die beste Behandlung für spezifische Indikationen zu ziehen.
Fazit
Die Sinusbodenaugmentation kann erfolgreich mit einem transkrestalen Ansatz unter Verwendung eines speziellen Implantatsystems durchgeführt werden, das eine hydraulische Elevation der Schneider-Membran, die Injektion eines fließfähigen Knochenersatzmaterials und die gleichzeitige Platzierung von Zahnimplantaten ermöglicht, mit minimalem Patientenunbehagen. Während der Heilung wurde eine physiologische Kontraktion von 11,3 % des ursprünglichen Volumens des Knochenersatzmaterials festgestellt. Danach wurde keine zusätzliche Volumenreduktion des Transplantats beobachtet. Langfristige klinische Studien sind erforderlich, um diese Ergebnisse zu bestätigen.
Marco Tallarico, David L Cochran, Erta Xhanari, Claudia Dellavia, Elena Canciani, Eitan Mijiritsky, Silvio Mario Meloni
Literaturverzeichnis
- Nickenig HJ, Wichmann M, Zoller JE, Eitner S. 3-D basierte minimalinvasive einzeitige laterale Sinuserhöhung – eine prospektive randomisierte klinische Pilotstudie mit blinder Bewertung der postoperativen sichtbaren Veränderungen des Volumens der Gesichtshaut. J Craniomaxillofac Surg 2014;42:890–895.
- Bechara S, Kubilius R, Veronesi G, Pires JT, Shibli JA, Mangano FG. Kurze (6-mm) Zahnimplantate versus Sinusbodenhebung und Platzierung längerer (≥10-mm) Zahnimplantate: eine randomisierte kontrollierte Studie mit einer Nachbeobachtungszeit von 3 Jahren. Clin Oral Implants Res 2016 Jul 12. doi: 10.1111/ clr.12923. [Epub ahead of print].
- Katranji A, Fotek P, Wang HL. Komplikationen bei der Sinusaugmentation: Ätiologie und Behandlung. Implant Dent 2008;17: 339–349.
- Tatum H Jr. Maxilläre und sinusimplantatrekonstruktionen. Dent Clin North Am 1986;30:207–229.
- Boyne PJ, James RA. Transplantation des maxillären Sinusbodens mit autogenem Knochenmark und Knochen. J Oral Surg 1980;38:613–616.
- Misch CE. Maxilläre Sinusaugmentation für endostale Implantate. Organisierte alternative Behandlungspläne. Int J Oral Implantol 1987;4:49–58.
- Smiler DG, Holmes RE. Sinuslift-Verfahren mit porösem Hydroxylapatit: ein vorläufiger Bericht. J Oral Implantol 1987;13:239–253.
- Wood R, Moor P. Transplantation des maxillären Sinus mit intraoral entnommenem autogenem Knochen vor der Implantatplatzierung. Int J Oral Maxillofac Implants 1988;3:209–214.
- Kent JN, Block MS. Gleichzeitige Knochenaugmentation des maxillären Sinusbodens und Platzierung von hydroxylapatit-beschichteten Implantaten. J Oral Maxillofac Surg 1989;47:238–242.
- Misch CE, Dietsh F. Knochenersatzmaterialien in der Implantatdentistry. Implant Dent 1993;2:158–167.
- Better H, Slavescu D, Barbu H, Cochran DL, Chaushu G. Minimalinvasive Sinuslift-Implantatvorrichtung: vorläufige Ergebnisse einer multizentrischen Sicherheits- und Wirksamkeitsstudie. Clin Implant Dent Relat Res 2014;16:520–526.
- Johansson B, Grepe A, Wannfors K, Hirsch JM. Eine klinische Studie zu Veränderungen im Volumen von Knochenersatzmaterialien im atrophen Oberkiefer. Dentomaxillofac Radiol 2001;30:157–161.
- Hallman M, Sennerby L, Zetterqvist L, Lundgren S. Eine 3-jährige prospektive Nachbeobachtungsstudie zu implantatgetragenen festen Prothesen bei Patienten, die einer maxillären Sinusbodenaugmentation mit einem 80:20-Gemisch aus deproteinisiertem bovinem Knochen und autogenem Knochen unterzogen wurden: klinische, radiografische und Resonanzfrequenzanalyse. Int J Oral Maxillofac Surg 2005;34:273–280.
- Wanschitz F, Figl M, Wagner A, Rolf E. Messung von Volumenveränderungen nach Sinusbodenaugmentation mit einem psychogenen Hydroxylapatit. Int J Oral Maxillofac Implants 2006;21:433–438.
- Kirmeier R, Payer M, Wehrschuetz M, Jakse N, Platzer S, Lorenzoni M. Bewertung dreidimensionaler Veränderungen nach Sinusbodenaugmentation mit verschiedenen Transplantationsmaterialien. Clin Oral Implants Res 2008;19:366–372.
- Klijn RJ, van den Beucken JJ, Bronkhorst EM, Berge SJ, Meijer GJ, Jansen JA. Prädiktiver Wert der Kammabmessungen auf die Resorption von autologem Knochenmaterial bei gestaffelter maxillärer Sinusaugmentation mit Cone-Beam-CT. Clin Oral Implants Res 2012;23:409–415.
- Umanjec-Korac S, Wu G, Hassan B, Liu Y, Wismeijer D. Eine retrospektive Analyse der Resorptionsrate von deproteinisiertem bovinem Knochen als maxilläres Sinus-Transplantationsmaterial mittels Cone-Beam-Computertomographie. Clin Oral Implants Res 2014;25:781–785.
- Meloni SM, Jovanovic SA, Lolli FM, Cassisa C, De Riu G, Pisano M, Lumbau A, Luglie PF, Tullio A. Transplantation nach Sinuslift mit anorganischem bovinem Knochen allein im Vergleich zu 50:50 anorganischem bovinem Knochen und autogenem Knochen: Ergebnisse einer Pilotstudie mit randomisierter Kontrolle nach einem Jahr. Br J Oral Maxillofac Surg 2015;53:436–441.
- Frayssinet P, Trouillet JL, Rouquet N, Azimus E, Autefage A. Osseointegration von makroporösen Calciumphosphatkeramiken mit unterschiedlicher chemischer Zusammensetzung. Biomaterials 1993;14:423–429.
- Daculsi G, Laboux O, Malard O, Weiss P. Aktueller Stand der Technik biphasischer Calciumphosphat-Biokeramiken. J Mater Sci Mater Med 2003;14:195–200.
- Le Nihouannen D, Saffarzadeh A, Aguado E, Goyenvalle E, Gauthier O, Moreau F, Pilet P, Spaethe R, Daculsi G, Layrolle P. Osteogene Eigenschaften von Calciumphosphatkeramiken und auf Fibrinkleber basierenden Kompositen. J Mater Sci Mater Med 2007;18:225–235.
- Esposito M, Felice P, Worthington HV. Interventionen zum Ersatz fehlender Zähne: Augmentationsverfahren des maxillären Sinus. Cochrane Database Syst Rev 2014;13:CD008397.
- Tallarico M, Meloni SM, Xhanari E, Pisano M, Cochran DL. Minimalinvasive Sinusaugmentation mit einem speziellen hydraulischen Sinuslift-Implantatgerät: Eine prospektive Fallserie zu klinischen, radiologischen und patientenorientierten Ergebnissen. Int J Periodontics Restorative Dent 2017;37: 125–135.
- Tallarico M, Better H, De Riu G, Meloni SM. Ein neuartiges Implantatsystem, das der hydraulischen Elevation der Schneider-Membran und gleichzeitig der Knochenaugmentation gewidmet ist: Eine bis zu 45 Monate retrospektive klinische Studie. J Craniomaxillofac Surg. 2016;44:1089–1094.
- Shanbhag S, Shanbhag V, Stavropoulos A. Volumenveränderungen von maxillären Sinusaugmentationen über die Zeit: eine systematische Übersicht. Int J Oral Maxillofac Implants 2014;29:881–892.
- Kühl S, Payer M, Kirmeier R, Wildburger A, Acham S, Jakse N. Der Einfluss von partikuliertem autogenem Knochen auf die frühe Volumenstabilität von maxillären Sinus-Transplantaten mit biphasischem Calciumphosphat: eine randomisierte klinische Studie. Clin Implant Dent Relat Res 2015;17:173–178.
- Hatano N, Shimizu Y, Ooya K. Eine klinische Langzeit-radiografische Bewertung von Transplantathöhenveränderungen nach maxillären Sinusbodenaugmentationen mit einem 2:1-Gemisch aus autogenem Knochen/xenogenem Material und gleichzeitiger Platzierung von Zahnimplantaten. Clin Oral Implants Res 2004;15:339–345.
- Wiltfang J, Schultze-Mosgau S, Nkenke E, Thorwarth M, Neukam FW, Schlegel KA. Onlay-Augmentation versus Sinuslift-Verfahren bei der Behandlung des stark resorbierten Oberkiefers: eine 5-jährige vergleichende Längsschnittstudie. Int J Oral Maxillofac Surg 2005;34:885–889.
- Lekholm U, Zarb GA. Patientenauswahl und -vorbereitung. In: Brånemark PI, Zarb GA, Albrektsson T, Herausgeber. Gewebeintegrierte Prothesen: Osseointegration in der klinischen Zahnmedizin. Chicago: Quintessence Publishing Co. 1985;1–356.
- Cassetta M, Stefanelli LV, Pacifici A, Pacifici L, Barbato E. Wie genau ist CBCT bei der Messung der Knochendichte? Eine vergleichende CBCT-CT in vitro Studie. Clin Implant Dent Relat Res 2014;16:471–478.
- Esposito M, Pellegrino G, Pistilli R, Felice P. Rehabilitation von posterioren atrophen zahnlosen Kiefern: Prothesen, die von 5 mm kurzen Implantaten oder von längeren Implantaten in augmentiertem Knochen unterstützt werden? Einjährige Ergebnisse aus einer Pilotstudie mit randomisierter Kontrolle. Eur J Oral Implantol 2011;4:21–30.
- Pistilli R, Felice P, Cannizzaro G, Piatelli M, Corvino V, Barausse C, Buti J, Soardi E, Esposito M. Posterior atrophische Kiefer, die mit Prothesen rehabilitiert wurden, die von 6 mm langen und 4 mm breiten Implantaten oder von längeren Implantaten in augmentiertem Knochen unterstützt werden. Ergebnisse ein Jahr nach der Belastung aus einer Pilotstudie mit randomisierter Kontrolle. Eur J Oral Implantol 2013;6:359–372.
- Pistilli R, Felice P, Piattelli M, Gessaroli M, Soardi E, Barausse C, Buti J, Corvino V. Posterior atrophische Kiefer, die mit Prothesen rehabilitiert wurden, die von 5 x 5 mm Implantaten mit einer neuartigen nanostrukturierten calciumincorporierten Titanoberfläche oder von längeren Implantaten in augmentiertem Knochen unterstützt werden. Ergebnisse nach einem Jahr aus einer randomisierten kontrollierten Studie. Eur J Oral Implantol 2013;6:343–357.
- Gulje FL, Raghoebar GM, Vissink A, Meijer HJ. Einzelkronen im resorbierten posterioren Oberkiefer, die entweder von 6-mm-Implantaten oder von 11-mm-Implantaten in Kombination mit einer Sinusbodenhebung unterstützt werden: Eine 1-jährige randomisierte kontrollierte Studie. Eur J Oral Implantol 2014;7:247–255.
- Esposito M, Barausse C, Pistilli R, Sammartino G, Grandi G, Felice P. Kurze Implantate versus Knochenaugmentation zur Platzierung längerer Implantate in atrophischen Oberkiefern: Ergebnisse ein Jahr nach der Belastung aus einer Pilotstudie mit randomisierter Kontrolle. Eur J Oral Implantol 2015;8:257–268.
- Esposito M, Pistilli R, Barausse C, Felice P. Dreijährige Ergebnisse aus einer randomisierten kontrollierten Studie, die Prothesen vergleicht, die von 5 mm langen Implantaten oder von längeren Implantaten in augmentiertem Knochen in posterioren atrophischen zahnlosen Kiefern unterstützt werden. Eur J Oral Implantol 2014;7:383–395.