Zustände des peri-implantären Gewebes bei Implantaten, die mit der subperiostalen peri-implantären augmentierten Schichttechnik behandelt wurden: Eine retrospektive Fallserie
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziele: Die peri-implantären Gewebezustände kurzfristig bei Patienten zu bewerten, die die Sub-periosteale Peri-implant Augmented Layer (SPAL) Technik erhalten haben, und bei Patienten mit ausreichender Dicke (≥2 mm) der peri-implantären buccalen Knochenplatte (PBBP) bei der Platzierung.
Methoden: Patienten, bei denen entweder ein Dehiszenzdefekt oder eine dünne PBBP bei der Implantatplatzierung durch die SPAL-Technik korrigiert wurde (SPALdehiscence und SPALthin Gruppen, jeweils) und Patienten, die eine verbleibende PBBP-Dicke von ≥2 mm bei der Implantatplatzierung aufwiesen (Kontrollgruppe), wurden retrospektiv ausgewählt. Die Anzahl der peri-implantären Stellen, die positiv auf Blutung bei der Sondierung (BoP) 6 Monate nach prothetischer Belastung waren, war das primäre Ergebnis. Außerdem wurden die Höhe der keratinisierten Mukosa, der marginale Weichgewebsniveau, der Plaque-Index, die peri-implantäre Sondierungstiefe, die Suppuration bei der Sondierung und der interproximale radiografische Knochenstand (RBL) bewertet.
Ergebnisse: Vierunddreißig Patienten (11 in der SPALdehiscence-Gruppe, 11 in der SPALthin-Gruppe und 12 in der Kontrollgruppe) wurden einbezogen. In jeder SPAL-Gruppe zeigten 10 Patienten (90,9%) eine peri-implantäre Gewebedicke von ≥2 mm an der koronalsten Stelle des Implantats bei der Freilegung. Die Prävalenz (Anzahl) der BoP-positiven Stellen betrug 2, 1 und 0 in den SPALdehiscence-, SPALthin- und Kontrollgruppen. Der RBL betrug 0,3 mm in der SPALdehiscence-Gruppe, 0,2 mm in der SPALthin-Gruppe und 0 mm in der Kontrollgruppe.
Schlussfolgerung: Nach 6 Monaten prothetischer Belastung zeigen Patienten, die mit der SPAL-Technik behandelt wurden, eine begrenzte peri-implantäre Mukosainflammation in Verbindung mit flachem PD und ausreichendem KM. Bei Implantaten, die die SPAL-Technik erhalten haben, wurde jedoch interproximale RBL apikal zu ihrer idealen Position festgestellt.
Einleitung
Die prothetisch gesteuerte Implantation in einer reduzierten horizontalen Knochendimension führt häufig zu einer peri-implantären Knochendehiszenz oder Fenestration. Selbst in Anwesenheit einer intakten, aber dünnen buccalen Kortikalis kann chirurgisches Trauma und die daraus resultierende Knochenremodellierung nach der Implantation zu einem vertikalen Knochenverlust führen, wobei der koronale Teil des Implantats bei der Freilegung exponiert wird (Merheb et al., 2017, Monje et al., 2019, Spray, Black, Morris, 2000). Obwohl gezeigt wurde, dass das Ausmaß der Knochenremodellierung nach der Implantation sowohl bei dünnen als auch bei dicken buccalen Knochenplatten ähnlich ist (Merheb et al., 2017), kann eine solche Remodellierung unterschiedliche Auswirkungen auf die Integrität der peri-implantären buccalen Knochenplatte (PBBP) haben. In dieser Hinsicht wurde in präklinischen (Monje et al., 2019) und klinischen (Schwarz, Sahm, Becker, 2012, Jung et al., 2017) Studien ein erhöhtes Risiko für ästhetische und biologische Komplikationen nach der Implantation an Stellen mit entweder einem Dehiszenzdefekt oder einer dünnen PBBP im Vergleich zu dicken PBBP gezeigt. Insgesamt unterstreichen diese Ergebnisse die Relevanz der Integrität und Dicke der PBBP bei der Implantation, um stabile, gesunde Bedingungen des peri-implantären Gewebes im Laufe der Zeit zu fördern (Sanz-Sánchez et al., 2018).
Das am besten dokumentierte und wirksamste Verfahren zur chirurgischen Korrektur eines Dehiszenz-Defekts basiert auf der Verwendung von Barrieremembranen in Kombination mit Knochenersatzmaterialien gemäß den Prinzipien der geführten Knochenregeneration (GBR) (Sanz-Sánchez, Ortiz-Vigón, Sanz-Martín, Figuero, Sanz, 2015). Die Reduktion oder Auflösung der peri-implantären Knochen-Dehiszenz, die nach GBR berichtet wurde (Thoma, Bienz, Figuero, Jung, Sanz-Martín, 2019), scheint sich positiv auf die Langzeitbedingungen von Implantaten auszuwirken, sowohl hinsichtlich der Implantatüberlebensrate als auch der Stabilität des peri-implantären Gewebes (Sanz-Sánchez et al., 2018). Leider ist nicht vollständig geklärt, ob und inwieweit eine erhöhte Dicke des peri-implantären Knochens, die mit einer vollständigen Abdeckung der exponierten Implantatoberfläche verbunden ist, die peri-implantäre Gesundheit unterstützen kann.
Kürzlich wurde ein vereinfachtes Verfahren zur Knochenaugmentation, nämlich die Sub-periostale Peri-implantäre Augmentierte Schicht (SPAL)-Technik, beschrieben, die auf der Verwendung des Periosts als Barrieremembran und eines Transplantats als raumschaffendes „Gerät“ zur Knochenaugmentation in Verbindung mit der Implantatinsertion basiert (Trombelli, Severi, Pramstraller, Farina, 2018). Die Wirksamkeit dieser Technik zur Korrektur einer peri-implantären Knochen-Dehiszenz und/oder zur Augmentation der Dicke des peri-implantären Knochens wurde zuvor berichtet (Trombelli, Severi, Pramstraller, Farina, 2019), und ihre Anwendung wurde auch bei der Behandlung von peri-implantären Defekten untersucht (Trombelli et al. 2020). Ziel der vorliegenden retrospektiven Fallserie war es, die Bedingungen des peri-implantären Gewebes kurzfristig bei Patienten, die die SPAL-Technik erhielten, im Vergleich zu Patienten mit ausreichender Dicke (≥2 mm) des PBBP bei der Implantatinsertion zu bewerten.
Material und Methoden
2.1 Studiendesign und ethische Aspekte
Die vorliegende Studie wurde gemäß den STROBE-Richtlinien Anhang S1 entworfen. Das Protokoll wurde vom Ethikkomitee des Area Vasta Emilia Centro, Italien (Protokollnummer 637/2018/ Oss/UniFe, Genehmigungsdatum 12.12.2018) genehmigt. Jeder Patient hatte vor der chirurgischen Behandlung eine schriftliche Einwilligung gegeben. Alle klinischen Verfahren wurden in Übereinstimmung mit der Deklaration von Helsinki und den Richtlinien für Gute Klinische Praxis (GCP) durchgeführt.
2.2 Studienpopulation
Die Aufzeichnungen der Patienten, die im Zeitraum von Dezember 2015 bis Juli 2018 eine implantatgestützte prothetische Rehabilitation im Forschungszentrum für die Studie von Parodontal- und Peri-Implantat-Erkrankungen der Universität Ferrara und einer privaten Zahnarztpraxis in Ferrara erhalten haben, wurden überprüft, um die Eignung der Patienten für die Studie zu bestimmen. Die Aufnahme der Patienten in die Studie war an die folgenden Kriterien gebunden:
- Nichtraucher oder Raucher ≤10 Zigaretten/Tag zum Zeitpunkt der Operation;
- Nicht-Diabetiker oder gut kontrollierte Diabetiker (HbA1c ≤ 7%) zum Zeitpunkt der Operation;
- Verfügbarkeit klinischer Parameter und radiographischer Untersuchungen für die Studie (siehe „Studienparameter“ für Details).
- Keine Einnahme von Medikamenten, die den Knochenstoffwechsel beeinflussen (z.B. Bisphosphonate, Kortikosteroide);
- Implantatplatzierung vollständig im nativen Knochen (mit einer verbleibenden PBBP-Dicke ≥2 mm nach der Implantation) oder gleichzeitig mit der SPAL-Technik.
Die Aufnahme des Implantats in die Studie war an die folgenden Kriterien gebunden:
- Platzierung im geheilten Kamm (Typ IV Implantate, Hämmerle, Chen, Wilson, 2004);
- Primäre Stabilität, bewertet durch den Einsatztorque.
Basierend auf den Bedingungen des PBBP zum Zeitpunkt der Implantation und dessen klinischer Behandlung wurden die Patienten in drei Gruppen eingeteilt:
- Patienten mit Implantat/en, die eine verbleibende PBBP-Dicke von ≥2 mm nach der Implantation aufweisen (Kontrollgruppe);
- Patienten mit Implantat/en, die mit der SPAL-Technik behandelt wurden, um eine peri-implantäre Knochendefizienz von ≥3 mm gleichzeitig mit der Implantation zu korrigieren (SPALdehiscence Gruppe);
- Patienten mit Implantat/en, die mit der SPAL-Technik behandelt wurden, um eine dünne (≤1 mm) PBBP gleichzeitig mit der Implantation zu augmentieren (SPALthin Gruppe).
2.3 Klinische Verfahren
Vor der Implantation hatten alle Patienten eine aktive Therapie zur Behandlung von Kariesläsionen und Parodontalerkrankungen durchlaufen und waren in eine professionelle Nachsorge aufgenommen worden, wobei die Häufigkeit der Rückrufe gemäß dem PerioRisk-Bewertungstool geplant wurde (Trombelli, Farina, Ferrari, Pasetti, Calura, 2009, Trombelli et al., 2017).
Alle chirurgischen Eingriffe wurden von zwei erfahrenen Parodontologen (L.T. und M.P.) durchgeführt. Den Patienten wurden eine Stunde vor der Operation 2 g Amoxicillin + Clavulansäure (Augmentin, GlaxoSmithKline) verabreicht. Die lokale Anästhesie wurde mit Articain und 1:100.000 Epinephrin durch lokale Infiltration erreicht.
2.3.1 Chirurgische Verfahren—SPAL-Gruppen
Bei Patienten, bei denen entweder ein Dehiszenzdefekt oder dünnes PBBP bei der Platzierung durch die SPAL-Technik korrigiert wurde (Abbildungen 1 und 2), wurde der chirurgische Zugang zur Knochenkante wie zuvor beschrieben durchgeführt (Trombelli, Severi, Pramstraller, & Farina, 2018). Kurz gesagt, wurde eine Schleimhautschicht an der bukkalen Seite durch eine Teil-Dickenschichtung mit einem 15C-Messer sowie Tunnelmessern (KPAX, TKN1X und TKN2X, Hu-Friedy) mit unterschiedlich gewinkelten scharfen Kanten entsprechend der anatomischen Lage angehoben. Dann wurde die periostale Schicht mit einem Periostheber (PTROM, Hu-Friedy) vom Knochen abgehoben, wodurch eine Tasche geschaffen wurde, die ein Transplantat aufnehmen konnte. Ein Volldickenschlitz wurde an der oralen (lingualen/palatalen) Seite angehoben.
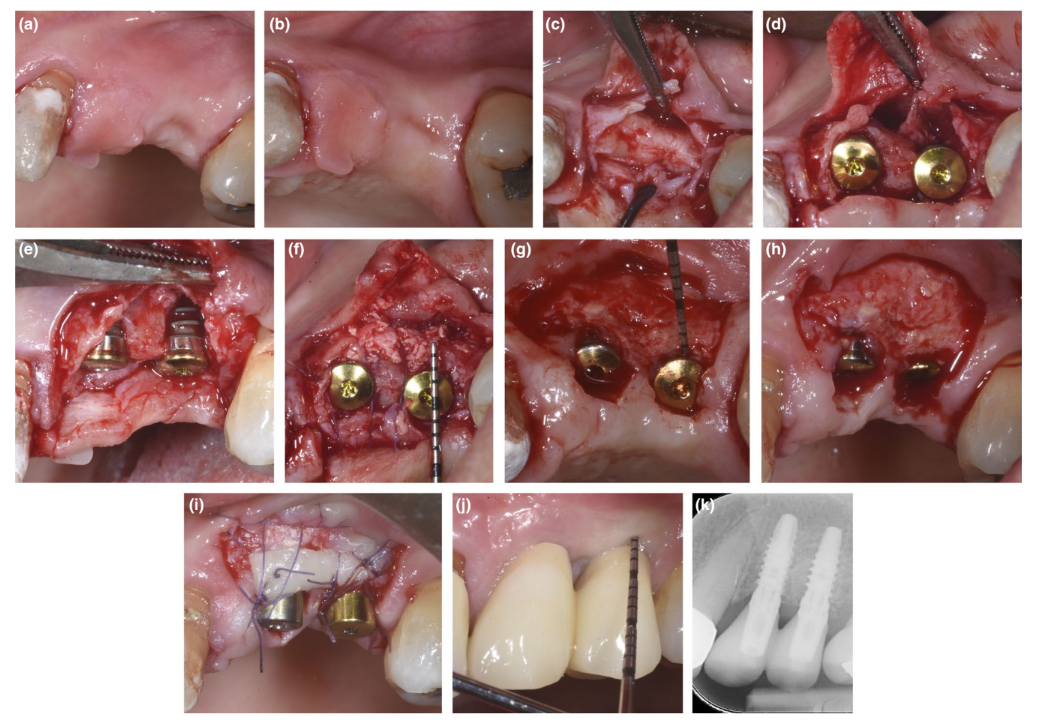
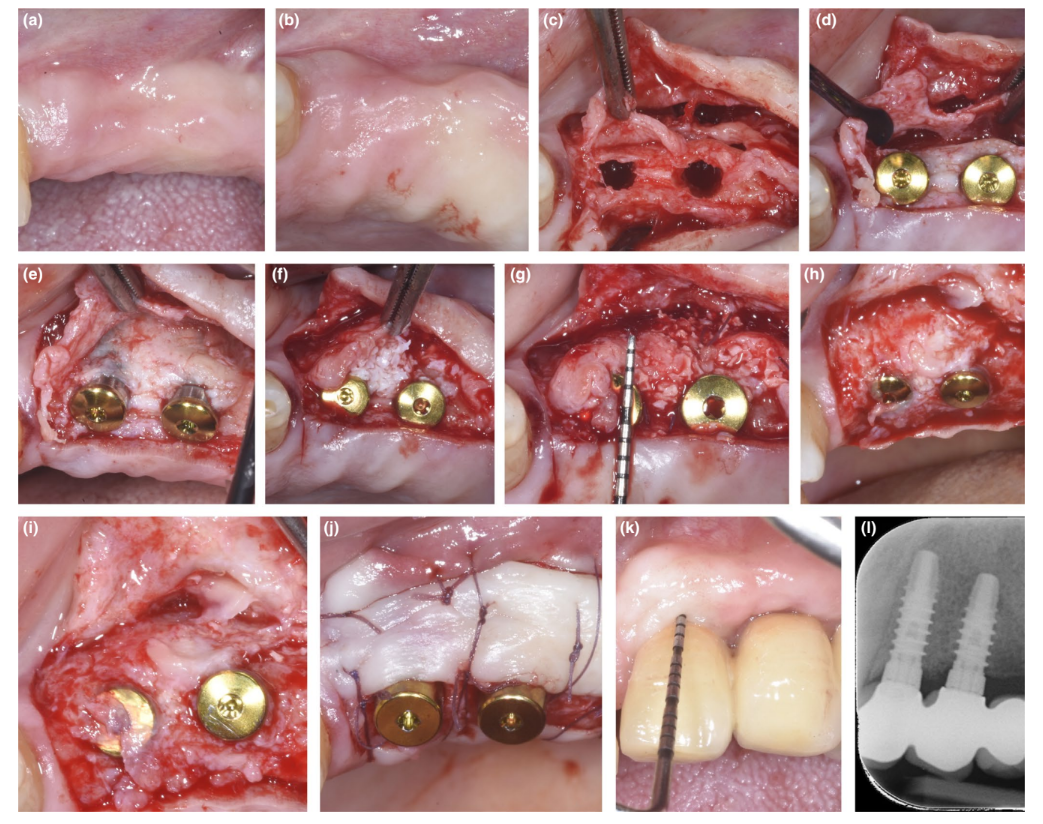
Gewebeebene Implantate (SPI Element™; Thommen Medical) wurden eingesetzt. Ein bovines Xenograft (Bio-Oss® Spongiosa-Granulate, Partikelgröße 0,25–1,0 mm; Geistlich Pharma, AG) wurde allein oder in Kombination mit autogenen kortikalen Knochenpartikeln verwendet, um den chirurgisch geschaffenen Raum zwischen der periostalen Schicht und entweder der dünnen buccalen Knochenplatte oder der freiliegenden Implantatoberfläche zu füllen. In Anwesenheit einer Dehiszenz wurde ein Grafting durchgeführt, um den peri-implantären Defekt bis zum polierten Kragen vollständig zu korrigieren. In allen Fällen bot das subperiostale Graft mindestens 2 mm Dicke im koronalsten Bereich des Implantats.
Der koronale Teil der periostalen Schicht wurde durch resorbierbare interne Matratzennaht (Vicryl 6/0, Ethicon) an den oral-mukoperiostalen Lappen stabilisiert. Die Schleimhautschicht wurde dann koronale vorverlagert und spannungsfrei mit horizontalen internen Matratzen- und unterbrochenen Nähten genäht, um sowohl das Graft als auch die Implantate zu submergieren.
Bei dem Wiedereintrittsverfahren zur Freilegung des Implantats wurde ein bukkaler, schichtdicker Lappen präpariert, um das Heilungsabutment zu positionieren. Um angemessene Dimensionen der keratinisierten peri-implantären Mukosa zu gewährleisten, wurde entweder ein apikal positionierter Lappen oder ein freies Zahnfleischtransplantat durchgeführt (Trombelli, Severi, Pramstraller, & Farina, 2019).
2.3.2 Chirurgische Verfahren—Kontrollgruppe
Ein bukkaler und lingualer/palatinaler Vollschichtlappen wurde angehoben, um den Knochenrand freizulegen. Der Implantatstandort wurde gemäß den Anweisungen des Herstellers vorbereitet, und Gewebe-Implantate (SPI Element™; Thommen Medical) wurden eingesetzt. Aufgrund der Anwesenheit einer residualen PBBP-Dicke von ≥2 mm wurde kein Knochenaufbauverfahren durchgeführt. In allen Fällen wurde der Lappen zugeschnitten und um das Heilungsabutment mit resorbierbaren Nähten (Vicryl 6/0, Ethicon) positioniert. Das Design und die Manipulation des Lappens sowie die Nahttechnik wurden durchgeführt, um angemessene Dimensionen (Höhe, Dicke) der keratinisierten peri-implantären Mukosa sicherzustellen.
2.3.3 Postoperative Verfahren
Die Patienten wurden angewiesen, für mindestens 4 Wochen keine herausnehmbaren Prothesen zu tragen, um Druck auf die chirurgische Stelle zu vermeiden, und für ungefähr 2 Wochen nicht im behandelten Bereich zu kauen oder zu putzen.
Die Anwendung einer 0,12%igen Chlorhexidinlösung (Curasept ADS Trattamento Rigenerante®; Curaden Healthcare) wurde zur chemischen Plaque-Kontrolle verschrieben (1-minütiges Spülen b.i.d. für 3 Wochen). Die Nähte wurden 2 Wochen nach der Operation entfernt.
2.3.4 Zeitpunkt der prothetischen Rehabilitation
Die prothetische Rehabilitation begann 3–4 Monate nach der Implantation in der Kontrollgruppe, während sie in den SPAL-Gruppen mindestens 4 Wochen nach der Freilegung des Implantats begann.
2.4 Studienparameter
2.4.1 Klinische Parameter
Nach 6 Monaten prothetischer Belastung führte ein geschulter Prüfer (M.S.), der an früheren Studien zur SPAL-Technik (Trombelli, Severi, Pramstraller, Farina, 2019) beteiligt war, die folgenden klinischen Messungen mit einer UNC-15 Parodontalsonde in der folgenden chronologischen Reihenfolge durch:
- Höhe der keratinisierten Mukosa (KM): gemessen an der mittleren bukkalen Seite des Implantats als der Abstand zwischen dem bukkalen peri-implantären Mukosarand und der mukogingivalen Grenze und auf den nächsten Millimeter aufgezeichnet;
- Marginales Weichgewebsniveau (MSTL) (Zitzmann, Schärer, Marinello, 2001): gemessen an der mittleren bukkalen Seite des Implantats als der Abstand zwischen dem bukkalen peri-implantären Mukosarand und der Implantat-Abutment-Grenze und auf den nächsten Millimeter aufgezeichnet. MSTL wurde als positiv oder negativ aufgezeichnet, wenn sich der Abutmentrand über oder unter dem Mukosarand befand;
- Plaque-Index (PlI; O'Leary, Drake, Naylor, 1972): aufgezeichnet an den mesio-bukkalen, mittleren bukkalen, disto-bukkalen, mittleren lingualen/palatinalen Implantatseiten als supragingivale Plaque, die nach der Untersuchung des juxtagingivalen prothetischen Randes mit der Sondenspitze vorhanden oder nicht vorhanden war;
- Sondierungstiefe (PD): gemessen vom Mukosarand bis zur tiefsten Sondenpenetration an sechs Stellen (mesio-bukkal, mittel-bukkal, disto-bukkal, disto-lingual, mittel-lingual und mesio-lingual) unter Verwendung einer Kraft von 0,2–0,3 N und auf den nächsten Millimeter aufgezeichnet;
- Bluten bei Sondierung (BoP; Ainamo und Bay, 1975): aufgezeichnet als vorhanden oder nicht vorhanden bei der PD-Bewertung;
- Eiterung bei Sondierung (SoP): aufgezeichnet als vorhanden oder nicht vorhanden bei der PD-Bewertung.
2.4.2 Radiographischer Knochenstand
Nicht standardisierte periapikale Röntgenaufnahmen, die mit der Langkegel-Paralleltechnik 6 Monate nach der prothetischen Belastung aufgenommen wurden, wurden digitalisiert und mit einer speziell entwickelten Software (NIS elements v4.2; Nikon Instruments, Campi Bisenzio) analysiert. Der radiographische Knochenstand (RBL) wurde als der Abstand (auf die nächstgelegene 0,1 mm gerundet) zwischen dem apikalen Rand des polierten Kragens des Implantats und dem Knochencrest an der mesialen (mRBL) und distalen (dRBL) Seite jedes Implantats unter Verwendung einer 10x–15x Vergrößerung gemessen. Ein 1 mm hoher Referenzpunkt, der auf dem digitalen Röntgenbild vorhanden war, wurde zur Kalibrierung verwendet.
Ein Prüfer (A.S.) führte die radiographischen Messungen durch. Der Prüfer war an einer Kalibrierungssitzung mit einer Stichprobe von Röntgenaufnahmen beteiligt, die von Patienten aufgenommen wurden, die nicht für die vorliegende Studie ausgewählt wurden. Die Kalibrierungssitzung bestand aus zwei Sitzungen von RBL-Messungen, die im Abstand von 7 Tagen durchgeführt wurden, und ermöglichte eine hervorragende Übereinstimmung innerhalb des Prüfers (k-Wert = 0,89), mit einem Mittelwert der Differenz zwischen gepaarten Messungen von 0,04 ± 0,15 mm.
2.5 Statistische Analyse
Der Patient wurde als statistische Einheit betrachtet. Wenn zwei oder mehr Implantate im selben Patienten für die Studie in Frage kamen, wurde nur ein Implantat zufällig zur Analyse ausgewählt. Die Daten wurden unter Verwendung von Mittelwert und Standardabweichung (SD), Median und Interquartilsbereich (IR), Minimal- und Maximalwerten für quantitative Variablen sowie Häufigkeit und Prozentsatz für kategoriale Variablen beschrieben.
Die mediane Anzahl der BoP-positiven Stellen, die 6 Monate nach der Implantatbelastung bewertet wurden, war die primäre Ergebnisvariable der Studie. Medianwerte von PD, KM, MSTL, RBL, Anzahl der PlI-positiven Stellen und Anzahl der SoP-positiven Stellen waren sekundäre Ergebnisvariablen.
Aufgrund der begrenzten Stichprobengröße wurden keine inferenzstatistischen Analysen durchgeführt, und die Ergebnisse wurden narrativ berichtet. Der Effektgrößenschätzer (ES) wurde jedoch für jede Ergebnisvariable gemäß dem nichtparametrischen Kruskal-Wallis-Test berechnet. Der ES wurde als klein (d = 0.1–0.3), mittel (d = 0.3–0.5) oder groß (d ≥ 0.5) klassifiziert (Cohen, 1988).
Ergebnisse
3.1 Studienpopulation
Vierunddreißig Patienten mit 34 Implantaten (11 in der SPALdehiscence-Gruppe, 11 in der SPALthin-Gruppe und 12 in der Kontrollgruppe) wurden zur Analyse einbezogen. Die überwiegende Mehrheit der Patienten waren Nichtraucher (90,9% in der SPALdehiscence-Gruppe, 90,9% in der SPALthin-Gruppe und 75% in der Kontrollgruppe). Die Implantate in der SPALdehiscence-Gruppe waren überwiegend im Unterkiefer lokalisiert, während die Implantate in der SPALthin- und Kontrollgruppe überwiegend im Oberkiefer platziert wurden (Tabelle 1). Während des Nachbeobachtungszeitraums gingen keine Patienten oder Implantate verloren.
In der SPALdehiszenz-Gruppe zeigte 1 Patient nach 2 Wochen eine Wunddehiszenz mit teilweiser Exposition der Implantatgewinde. Der Patient wurde monatlich bis zur Wiederöffnung gesehen, und die Stelle wurde bei jedem Recall-Besuch lokal mit einer 0,12%igen Chlorhexidinlösung desinfiziert.
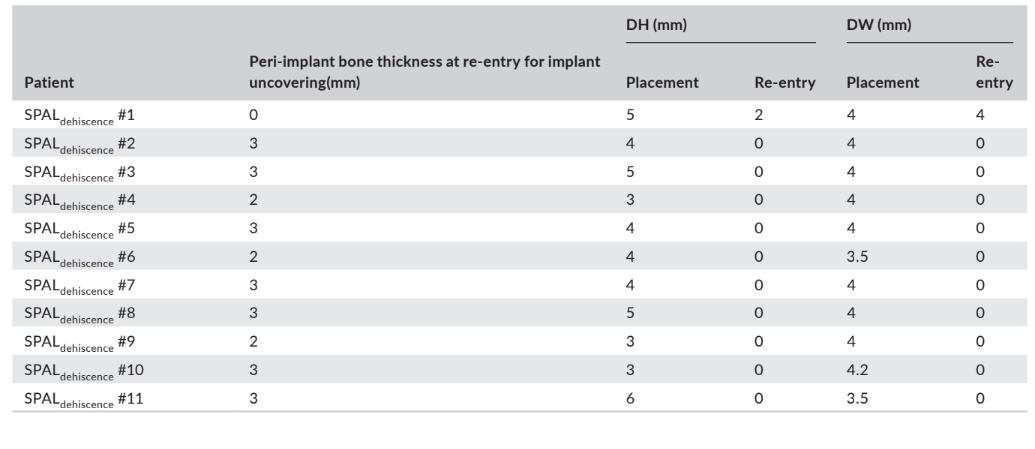
In sowohl der SPALdehiszenz- als auch der SPALdünn-Gruppe wurde die Wiederöffnung 3–6 Monate nach der Implantation durchgeführt (Median: 4,0 Monate in beiden Gruppen; p = 1; Tabelle 1). Die Dicke des peri-implantären Knochens sowie die Höhe und Breite der peri-implantären Knochendehiszenz, die für die SPALdehiszenz- und SPALdünn-Gruppen aufgezeichnet wurden, sind in den Tabellen 2 und 3 aufgeführt. In jeder SPAL-Gruppe zeigten 10 Patienten (90,9%) das Fehlen einer peri-implantären Dehiszenz in Kombination mit einer peri-implantären Knochendicke ≥2 mm (Tabellen 2 und 3). Ein Patient in der SPALdehiszenz-Gruppe wies eine residuale Dehiszenz von 2 mm auf (Tabelle 2), die mit einem freien Gingiva-Transplantat abgedeckt wurde. Ein Patient in der SPALdünn-Gruppe wies eine peri-implantäre Knochendicke von 1 mm ohne Dehiszenz auf (Tabelle 3).
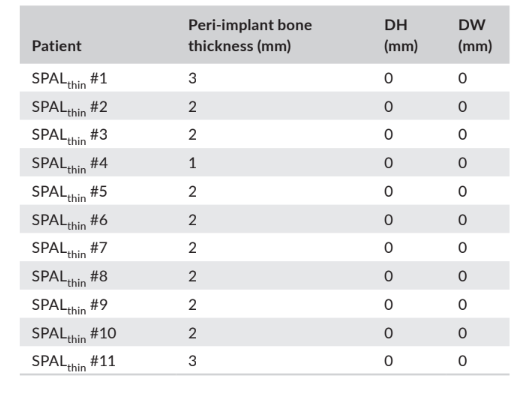
und -breite (DH und DW, jeweils) wie bei der Wiederöffnung für
Implantatfreilegung bei jedem Patienten der SPALthin Gruppe bewertet
In der SPALdehiscence Gruppe unterstützten 8 Implantate eine feste Teilprothese, 2 Implantate wurden mit einer Einzelkrone versorgt, und 1 Implantat war Teil einer Teleskopprothese. In der SPALthin Gruppe unterstützten 9 Implantate eine feste Teilprothese, 2 Implantate wurden mit einer Einzelkrone versorgt, und 1 war Teil einer Teleskopprothese. In der Kontrollgruppe waren 4 Implantate Teil einer festen Teilprothese und 8 Implantate wurden mit einer Einzelkrone versorgt.
3.2 Studienergebnisse
Daten zu klinischen Ergebnissen (d.h. PD, BoP, SoP, PlI, MSTL und KM) sowie RBL, die 6 Monate nach der Implantatbelastung bewertet wurden, sind in Tabelle 4 aufgeführt.
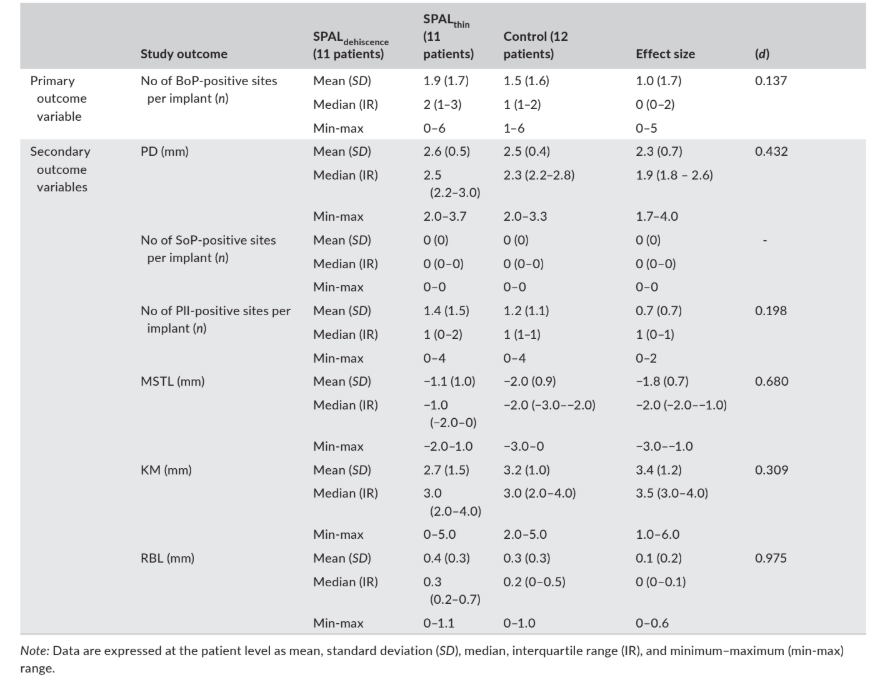
weiches Gewebelevel, MSTL; und Breite der keratinisierten Mukosa, KM) sowie radiographisches Knochenlevel (RBL), bewertet 6 Monate nach der Implantatbelastung.
Die mediane Prävalenz (Anzahl) der BoP-positiven Stellen betrug 2, 1 und 0 in den Gruppen SPALdehiscence, SPALthin und Kontrollgruppe.
Die mediane Anzahl der PlI-positiven Stellen betrug in allen Gruppen 1. SoP war an allen Implantatstandorten negativ.
Der mukosale Rand befand sich 1 mm (Gruppe SPALdehiscence) oder 2 mm (Gruppen SPALthin und Kontrollgruppe) über der Implantat-Abutment-Verbindung in allen Gruppen, und die Studiengruppen wiesen eine mediane KM von mindestens 3 mm auf.
Das radiographische Knochenniveau betrug 0,3 mm in der Gruppe SPALdehiscence, 0,2 mm in der Gruppe SPALthin und 0 mm in der Kontrollgruppe.
ES war gering für die Anzahl der BoP + Stellen (d = 0,137) und PlI (d = 0,198), mittel für KM (d = 0,309), PD (d = 0,432) und MSTL (d = 0,680), und groß für RBL (d = 0,975) (Tabelle 4).
Diskussion
Ziel der vorliegenden retrospektiven Fallserie war es, die peri-implantären Gewebebedingungen kurzfristig bei Patienten zu bewerten, die die SPAL-Technik erhalten haben, und bei Patienten mit ausreichender Dicke (≥2 mm) des PBBP bei der Implantation. Die Ergebnisse zeigten, dass Patienten, die mit der SPAL-Technik behandelt wurden, eine geringe Anzahl von peri-implantären entzündeten Stellen und eine flache PD (<4 mm) nach 6 Monaten prothetischer Belastung aufwiesen. Außerdem wurde der interproximale Knochenstand apikal (wenn auch in begrenztem Umfang) zum polierten Kragen des Implantats nur in den SPAL-Gruppen festgestellt.
Bluten bei der Sondierung wurde als primäres Ergebnis ausgewählt, da (a) die Beurteilung von BoP derzeit als klinisches Maß zur Unterscheidung zwischen peri-implantärer Gesundheit und Krankheit identifiziert wird und ein unveränderliches diagnostisches Element der peri-implantären Mukositis und Peri-Implantitis darstellt (Renvert, Persson, Pirih, Camargo, 2018, Berglundh et al., 2018), und (b) dessen Abwesenheit mit der Stabilität der peri-implantären Gewebebedingungen assoziiert ist (Jepsen, Rühling, Jepsen, Ohlenbusch, Albers, 1996, Luterbacher, Mayfield, Brägger, Lang, 2000). Der Anteil der entzündeten peri-implantären Stellen, wie in den Studiengruppen aufgezeichnet, vergleicht sich mit früheren Ergebnissen zur Bewertung der BoP-Prävalenz an 289 Implantaten (Farina, Filippi, Brazzioli, Tomasi, Trombelli, 2017). Auch ähnliche peri-implantäre Entzündungszustände wurden 18 Monate nach GBR berichtet (Jung et al., 2017).
In unserer Studie wurde eine niedrige Häufigkeit von entzündeten peri-implantären Mukosastellen in allen Studiengruppen beobachtet. Dies könnte teilweise auf ähnliche Merkmale für Faktoren zurückzuführen sein, die den Blutung auf Proben (BoP) um Implantate beeinflussen, wie z. B. die geringe Präsenz von juxtagingivalem Plaque (Pontoriero et al., 1994; Salvi et al., 2012), flache Sondierungstiefen (PD) (Farina, Filippi, Brazzioli, Tomasi, & Trombelli, 2017) und eine angemessene Menge an keratinisiertem Mukosa (KM) (Chung, Oh, Shotwell, Misch, Wang, 2006, Perussolo et al., 2018). Unsere Ergebnisse stimmen mit denen aus einer aktuellen systematischen Überprüfung zu biologischen Komplikationen von Zahnimplantaten überein, die entweder in unberührten oder in augmentierten Stellen platziert wurden. Die Meta-Analyse zeigte eine ähnliche Prävalenz von peri-implantärer Mukositis bei Patienten, die entweder Verfahren zur Erhaltung des Alveolarkamms erhielten (19,6%; 95% CI: 0%–40%) oder nicht erhielten (22,4%; 95% CI: 6%–38%) und/oder Verfahren zur vertikalen/lateralen Kammeraugmentation (Salvi, Monje, Tomasi, 2018). Auch ähnliche entzündliche Bedingungen wurden bei Implantaten berichtet, die in nativem Knochen platziert wurden, im Vergleich zu Implantaten, die gleichzeitig mit einem GBR-Verfahren platziert wurden (Benic, Jung, Siegenthaler, Hammerle, 2009; Benic, Bernasconi, Jung, Hammerle, 2017).
Es ist bemerkenswert, dass bei der Wiederaufnahme die überwiegende Mehrheit der Patienten, die die SPAL-Technik erhielten, eine peri-implantäre Knochendicke von ≥2 mm im koronalsten Bereich des Implantats aufwies. Obwohl die Messung der PBBP bei der Wiederaufnahme für die Kontrollgruppe (Einstufenverfahren) nicht verfügbar war, kann die Integrität der PBBP nach der peri-implantären Knochenremodellierung nach der Einsetzung basierend auf präklinischen (Monje et al., 2019) und klinischen (Spray, Black, Morris & Ochi, 2000) Daten zu kritischen Dimensionen der buccalen Knochenplatte angenommen werden. Insgesamt scheinen die verfügbaren Daten darauf hinzudeuten, dass angemessene vertikale und horizontale Dimensionen der peri-implantären Gewebe, die durch Augmentationsverfahren erreicht werden, Bedingungen begünstigen können, um die Entzündung des peri-implantären Gewebes zu begrenzen. Die Beziehung zwischen der Integrität der PBBP bis zur koronalsten Stelle des Implantats und der Schwere der peri-implantären mukosalen Entzündung ist jedoch nicht ganz klar (Jung et al., 2017).
Nach 6 Monaten prothetischer Belastung wurde eine unterschiedliche Position des interproximalen peri-implantären Knochenlevels zwischen den Gruppen beobachtet, mit einem weiter apikal gelegenen RBL in den SPAL-Gruppen. Bemerkenswert ist, dass in den SPAL-Gruppen die Gewebe-Niveau-Implantate leicht subkrestal positioniert waren (Abbildungen 1 und 2). Obwohl dies die Transplantation des periostalen Beutels bis zum kranialsten Teil des Implantats sowie die primäre Wundverschluss erleichtert haben könnte, könnte die subkrestale Positionierung auch zum interproximalen Knochenumbau beigetragen haben (Saleh et al., 2018). Darüber hinaus könnte der interproximalen Knochenumbau in den SPAL-Gruppen auch teilweise auf die nachteiligen Auswirkungen der Lappenhebung auf die lokale Blutversorgung zurückzuführen sein, da die Implantate, die die SPAL-Technik erhielten, eine zusätzliche Operation zum Freilegen durchliefen, einschließlich eines apikal positionierten Lappens oder eines freien Zahnfleischtransplantats. Konsistent wurde ein marginaler, peri-implantärer Knochenverlust zwischen dem Wiederzutritt zum Freilegen und der endgültigen Prothesenabgabe von anderen Autoren berichtet (Cardaropoli, Lekholm, Wennstrom, 2006, Nader et al., 2016). Es sollte auch berücksichtigt werden, dass bei einigen Patienten der SPALdehiszenz-Gruppe die Transplantation aufgrund einer interproximalen Erweiterung des peri-implantären Knochendefekts auf die mesiale und/oder distale Implantatseite ausgeweitet wurde. In der SPALdehiszenz-Gruppe könnte daher das Ausmaß des Transplantatumbaus an interproximalen Stellen negative Auswirkungen auf die RBL-Werte gehabt haben. Neueste Daten haben gezeigt, dass selbst langsam resorbierbare Transplantat-Biomaterialien, wie DBBM, mit einer erheblichen Reduktion der transplantierten Fläche bei der 12-monatigen radiografischen Bewertung nach endosinusalem Augmentationsverfahren assoziiert sind (Franceschetti et al., 2019). Das Ausmaß des in der vorliegenden Studie beobachteten RBL ist jedoch im Vergleich zu dem, was für Implantate berichtet wurde, die mit gleichzeitiger GBR oder in nativen Knochen platziert wurden (Urban et al., 2019), und Implantaten mit unbehandelter buccaler Dehiszenz (Jung et al., 2017) begrenzt.
Für die SPALdehiscence-Gruppe wurde ein leicht niedrigerer KM und MSTL beobachtet. Dies geschah, obwohl die Manipulation des peri-implantären Weichgewebes angemessen durchgeführt wurde, um angemessene Dimensionen der keratinisierten peri-implantären Mukosa und eine subgingivale Position der prothetischen Ränder zu gewährleisten. Dieses Ergebnis könnte teilweise mit dem erhöhten Knochenumbau (RBL) korreliert sein, der in der SPALdehiscence-Gruppe beobachtet wurde und möglicherweise auch die regenerierte buccale Knochenplatte betroffen hat. Eine aktuelle systematische Übersicht korrelierte den Umbau des buccalen Knochens mit dem Auftreten von peri-implantären Weichgewebsrezessionen (Aizcorbe-Vicente, Peñarrocha-Oltra, Canullo, Soto-Peñaloza, & Peñarrocha-Diago, 2020). In der SPALdehiscence-Gruppe erlebte 1 Patient (9,1%) eine Wunddehiszenz nach 2 Wochen, die zu einer teilweisen Exposition der Implantatgewinde bei der Wiederöffnung führte. Dieses Ergebnis steht im Vergleich zur Inzidenz von Wunddehiszenz und der daraus resultierenden Membranexposition nach GBR-Verfahren zur Korrektur von peri-implantären Knochendehiszenz bei der Platzierung, wie in einer aktuellen Metaanalyse berichtet, die sowohl prospektive als auch retrospektive Studien umfasste (Garcia et al., 2018). Insbesondere trat die Membranexposition mit einer Inzidenz von 16,7% (Tawil, El-Ghoule, & Mawla, 2001) bis 62,8% (Gher, Quintero, Assad, Monaco, & Richardson, 1994) auf und war mit einer signifikant niedrigeren Dehiszenzabdeckung assoziiert (Garcia et al., 2018). Die Einschränkungen dieses vorläufigen Berichts umfassen das retrospektive Design, die kleine Stichprobengröße und die kurze Nachbeobachtungszeit von 6 Monaten nach der Wiederherstellung der Implantate. Auch die Auswirkungen von patientenbezogenen Faktoren (z. B. Weichgewebedicke im zahnlosen Bereich, Rauchgewohnheiten, Diabetes) und operationsbezogenen Komplikationen (z. B. Perforationen der periostalen und/oder mukosalen Schicht) auf die klinischen Ergebnisse wurden nicht umfassend analysiert. Darüber hinaus wurden spezifische klinische Bedingungen (d. h. dünne PBBP oder peri-implantäre Knochendehiszenz mit begrenzter vertikaler Dimension) für die SPAL-Behandlung ausgewählt. Weitere Studien sind erforderlich, um zu bewerten, welche klinischen Bedingungen/Läsionen effektiv mit der SPAL-Technik behandelt werden können oder ob eine konventionellere Behandlung (z. B. GBR) bevorzugt werden sollte.
Zusammenfassend zeigen die Ergebnisse der vorliegenden Studie, dass Patienten, die mit der SPAL-Technik behandelt wurden, nach 6 Monaten prothetischer Belastung eine begrenzte peri-implantäre Mukosainflammation in Verbindung mit flachen PD und ausreichendem KM aufweisen. Bei Implantaten, die mit der SPAL-Technik behandelt wurden, wurde jedoch interproximale RBL apikal zu ihrer idealen Position festgestellt. Ob und inwieweit die günstigen kurzfristigen Ergebnisse, die nach der SPAL-Technik beobachtet wurden, für die langfristige Gesundheit der peri-implantären Gewebe und die Stabilität des buccalen Mukosaprofiles von Vorteil sein könnten, muss noch bewertet werden.
Leonardo Trombelli, Mattia Pramstraller, Mattia Severi, Anna Simonelli, Roberto Farina
Literaturverzeichnis
- Ainamo, J., & Bay, I. (1975). Probleme und Vorschläge zur Aufzeichnung von Gingivitis und Plaque. International Dental Journal, 25, 229–235.
- Aizcorbe-Vicente, J., Peñarrocha-Oltra, D., Canullo, L., Soto-Peñaloza, D., & Peñarrocha-Diago, M. (2020). Einfluss der Dicke des Gesichtsknochens nach der Implantation in die geheilten Kämme auf den umgebauten Gesichtsknochen unter Berücksichtigung des Rückgangs des Weichgewebes: Eine systematische Übersicht. International Journal of Oral and Maxillofacial Implants, 35, 107–119. https://doi.org/10.11607/jomi.7259
- Benic, G. I., Bernasconi, M., Jung, R. E., & Hammerle, C. H. F. (2017). Klinische und radiografische intraindividuelle Vergleich von Implantaten, die mit oder ohne geführte Knochenregeneration platziert wurden: 15-Jahres-Ergebnisse. Journal of Clinical Periodontology, 44, 315–325. https://doi.org/10.1111/jcpe.12665
- Benić, G. I., Jung, R. E., Siegenthaler, D. W., & Hämmerle, C. H. F. (2009). Klinischer und radiografischer Vergleich von Implantaten in regeneriertem oder nativen Knochen: 5-Jahres-Ergebnisse. Clinical Oral Implant Research, 20, 507–513. https://doi.org/10.1111/j.1600-0501.2008.01583.x
- Berglundh, T., Armitage, G., Araujo, M. G., Avila-Ortiz, G., Blanco, J., Camargo, P. M., Zitzmann, N. (2018). Peri-implantäre Erkrankungen und Zustände: Konsensbericht der Arbeitsgruppe 4 des 2017 World Workshop zur Klassifikation von Parodontal- und Peri-Implant-Erkrankungen und -Zuständen. Journal of Clinical Periodontology, 45(Suppl 20), S286–S291. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Cardaropoli, G., Lekholm, U., & Wennstrom, J. L. (2006). Gewebeveränderungen bei implantatgestützten Einzelzahnprothesen: Eine 1-jährige prospektive klinische Studie. Clinical Oral Implant Research, 17, 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x
- Chung, D. M., Oh, T. J., Shotwell, J. L., Misch, C. E., & Wang, H. L. (2006). Bedeutung der keratinisierten Mukosa für die Erhaltung von Zahnimplantaten mit unterschiedlichen Oberflächen. Journal of Periodontology, 77, 1410–1420. https://doi.org/10.1902/jop.2006.050393
- Cohen, J. (1988). Statistische Poweranalyse für die Verhaltenswissenschaften, 2. Aufl. Mahwah, NJ: Lawrence Erlbaum Associated Publishers.
- Farina, R., Filippi, M., Brazzioli, J., Tomasi, C., & Trombelli, L. (2017). Blutung bei Sondierung um Zahnimplantate: Eine retrospektive Studie zu assoziierten Faktoren. Journal of Clinical Periodontology, 44, 115–122. https://doi.org/10.1111/jcpe.12647
- Franceschetti, G., Farina, R., Minenna, L., Riccardi, O., Stacchi, C., Di Raimondo, R., … Trombelli, L. (2019). Der Einfluss der Transplantatumgestaltung auf die peri-implantäre Knochensupport bei Implantaten, die gleichzeitig mit einer transkrestalen Sinusbodenerhöhung platziert wurden: Eine multizentrische, retrospektive Fallserie. Clinical Oral Implant Research, 31(2), 1–16. https://doi.org/10.1111/clr.13541
- Garcia, J., Dodge, A., Luepke, P., Wang, H. L., Kapila, Y., & Lin, G. H. (2018). Einfluss der Membranexposition auf die geführte Knochenregeneration: Eine systematische Übersicht und Metaanalyse. Clinical Oral Implants Research, 29, 328–338. https://doi.org/10.1111/clr.13121
- Gher, M. E., Quintero, G., Assad, D., Monaco, E., & Richardson, A. C. (1994). Knochenaugmentation und geführte Knochenregeneration für sofortige Zahnimplantate beim Menschen. Journal of Periodontology, 65, 881–891. https://doi.org/10.1902/jop.1994.65.9.881
- Hämmerle, C. H., Chen, S. T., & Wilson, T. G. Jr (2004). Konsenserklärungen und empfohlene klinische Verfahren bezüglich der Platzierung von Implantaten in Extraktionssockets. International Journal of Oral and Maxillofacial Implants, 19(suppl), 26–28.
- Jepsen, S., Rühling, A., Jepsen, K., Ohlenbusch, B., & Albers, H. K. (1996). Progressive Peri-Implantitis. Inzidenz und Vorhersage des peri-implantären Attachmentverlusts. Clinical Oral Implants Research, 7, 133–142. https://doi.org/10.1034/j.1600-0501.1996.070207.x
- Jung, R. E., Herzog, M., Wolleb, K., Ramel, C. F., Thoma, D. S., & Hammerle, C. H. F. (2017). Eine randomisierte kontrollierte klinische Studie zum Vergleich kleiner buccaler Dehiszenzdefekte um Zahnimplantate, die mit geführter Knochenregeneration behandelt oder zur spontanen Heilung überlassen wurden. Clinical Oral Implants Research, 28, 348–354. https://doi.org/10.1111/clr.12806
- Luterbacher, S., Mayfield, L., Brägger, U., & Lang, N. P. (2000). Diagnostische Merkmale klinischer und mikrobiologischer Tests zur Überwachung der parodontalen und peri-implantären Mukosabedingungen während der unterstützenden parodontalen Therapie (SPT). Clinical Oral Implants Research, 11, 521–529. https://doi.org/10.1034/j.1600-0501.2000.011006521.x
- Merheb, J., Vercruyssen, M., Coucke, W., Beckers, L., Teughels, W., & Quirynen, M. (2017). Das Schicksal des buccalen Knochens um Zahnimplantate. Eine 12-monatige Nachuntersuchung nach der Belastung. Clinical Oral Implants Research, 28, 103–108. https://doi.org/10.1111/clr.12767
- Monje, A., Chappuis, V., Monje, F., Muñoz, F., Wang, H. L., Urban, I. A., & Buser, D. (2019). Die kritische Dicke der peri-implantären buccalen Knochenwand neu betrachtet: Eine experimentelle Studie am Beagle-Hund. Int J Oral Maxillofac Implants, 34, 1328–1336. https://doi.org/10.11607/jomi.7657
- Nader, N., Aboulhosn, M., Berberi, A., Manal, C., & Younes, R. (2016). Marginaler Knochenumbau um Heilungsabutment vs. endgültige Abutmentplatzierung bei der zweiten Operationsstufe: Eine 12-monatige randomisierte klinische Studie. Journal of Contemporary Dental Practice, 17, 7–15. https://doi.org/10.5005/jp-journals-10024
- O'Leary, T. J., Drake, R. B., & Naylor, J. E. (1972). Der Plaque-Kontrollbericht. Journal of Periodontology, 43, 38. https://doi.org/10.1902/jop.1972.43.1.38
- Perussolo, J., Souza, A. B., Matarazzo, F., Oliveira, R. P., & Araújo, M. G. (2018). Einfluss der keratinisierten Mukosa auf die Stabilität der peri-implantären Gewebe und das Bürstenunbehagen: Eine 4-jährige Nachuntersuchung. Clinical Oral Implant Research. Journal of Clinical Periodontology, 29, 1177–1185. https://doi.org/10.1111/clr.13381
- Pontoriero, R., Tonelli, M. P., Carnevale, G., Mombelli, A., Nyman, S. R., & Lang, N. P. (1994). Experimentell induzierte peri-implantäre Mukositis. Eine klinische Studie am Menschen. Clinical Oral Implants Research, 5, 254–259. https://doi.org/10.1034/j.1600-0501.1994.050409.x
- Renvert, S., Persson, G. R., Pirih, F. Q., & Camargo, P. M. (2018). Peri-implantäre Gesundheit, peri-implantäre Mukositis und peri-implantäre Entzündung: Falldefinitionen und diagnostische Überlegungen. Journal of Clinical Periodontology, 45(Suppl 20), S278–S285. https://doi.org/10.1111/jcpe.12956
- Saleh, M. H. A., Ravidà, A., Suárez-López Del Amo, F., Lin, G.-H., Asa'ad, F., & Wang, H.-L. (2018). Der Einfluss der Position der Implantat-Abutment-Verbindung auf den crestal Knochenverlust: Eine systematische Übersicht und Metaanalyse. Clinical Implant Dentistry and Related Research, 20, 617–633. https://doi.org/10.1111/cid.12600
- Salvi, G. E., Aglietta, M., Eick, S., Sculean, A., Lang, N. P., & Ramseier, C. A. (2012). Umkehrbarkeit der experimentellen peri-implantären Mukositis im Vergleich zur experimentellen Gingivitis beim Menschen. Clinical Oral Implants Research, 23, 182–190. https://doi.org/10.1111/j.1600-0501.2011.02220.x
- Salvi, G. E., Monje, A., & Tomasi, C. (2018). Langfristige biologische Komplikationen von Zahnimplantaten, die entweder in unberührten oder in augmentierten Bereichen platziert wurden: Eine systematische Übersicht und Metaanalyse. Clinical Oral Implant Research, 29(Suppl. 16), 294–310. https://doi.org/10.1111/clr.13123
- Sanz-Sánchez, I., Carrillo de Albornoz, A., Figuero, E., Schwarz, F., Jung, R., Sanz, M., & Thoma, D. (2018). Auswirkungen von lateralen Knochenaugmentationverfahren auf die peri-implantäre Gesundheit oder Erkrankung: Eine systematische Übersicht und Metaanalyse. Clinical Oral Implants Research, 29, 18–31. https://doi.org/10.1111/clr.13126
- Sanz-Sánchez, I., Ortiz-Vigón, A., Sanz-Martín, I., Figuero, E., & Sanz, M. (2015). Effektivität der lateralen Knochenaugmentation auf die Dimension des Alveolarkamms: Eine systematische Übersicht und Metaanalyse. Journal of Dental Research, 94, 1s–15s. https://doi.org/10.1177/0022034515594780
- Schwarz, F., Sahm, N., & Becker, J. (2012). Einfluss des Ergebnisses der geführten Knochenregeneration bei Dehiszenztyp-Defekten auf die langfristige Stabilität der peri-implantären Gesundheit: Klinische Beobachtungen nach 4 Jahren. Clinical Oral Implants Research, 23, 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x
- Spray, J. R., Black, C. G., Morris, H. F., & Ochi, S. (2000). Der Einfluss der Knochendicke auf die Reaktion des marginalen Gesichts: Platzierung der Stufe 1 bis zur Freilegung der Stufe 2. Annals of Periodontology, 5, 119–128. https://doi.org/10.1902/annals.2000.5.1.119
- Tawil, G., El-Ghoule, G., & Mawla, M. (2001). Klinische Bewertung einer bilayered Kollagenmembran (bio-gide), die von Autotransplantaten unterstützt wird, zur Behandlung von Knochendefekten um Implantate. The International Journal of Oral & Maxillofacial Implants, 16, 857–863.
- Thoma, D. S., Bienz, S. P., Figuero, E., Jung, R. E., & Sanz-Martín, I. (2019). Auswirkungen von Weichgewebeaugmentationverfahren auf die peri-implantäre Gesundheit oder Erkrankung: Eine systematische Übersicht und Metaanalyse. Journal Clinical Periodontology, 46(Suppl 21), 257–276. https://doi.org/10.1111/jcpe.13050
- Trombelli, L., Farina, R., Ferrari, S., Pasetti, P., & Calura, G. (2009). Vergleich zwischen zwei Methoden zur Beurteilung des parodontalen Risikos. Minerva Stomatologica, 58, 277–287.
- Trombelli, L., Minenna, L., Toselli, L., Zaetta, A., Checchi, L., Checchi, V., … Farina, R. (2017). Prognostischer Wert einer vereinfachten Methode zur Beurteilung des parodontalen Risikos während der unterstützenden parodontalen Therapie. Journal of Clinical Periodontology, 44, 51–57. https://doi.org/10.1111/jcpe.12645
- Trombelli, L., Severi, M., Farina, R., & Simonelli, A. (2020). Subperiostale peri-implantäre augmentierte Schichttechnik zur Behandlung von peri-implantären Entzündungsherden. Clinical Advances in Periodontics. https://doi.org/10.1002/ cap.10107. [Epub ahead of print].
- Trombelli, L., Severi, M., Pramstraller, M., & Farina, R. (2018). Subperiostale peri-implantäre augmentierte Schichttechnik zur horizontalen Knochenaugmentation bei der Implantation. Minerva Stomatologica, 67, 217–224. https://doi.org/10.23736/S0026-4970.18.04161-4
- Trombelli, L., Severi, M., Pramstraller, M., & Farina, R. (2019). Eine vereinfachte Weichgewebeverwaltung zur peri-implantären Knochenaugmentation. International Journal of Oral and Maxillofacial Implants, 34, 197–204. https://doi.org/10.11607/jomi.6959
- Urban, I. A., Wessing, B., Alández, N., Meloni, S., González-Martin, O., Polizzi, G., … Zechner, W. (2019). Eine multizentrische randomisierte kontrollierte Studie mit einer neuartigen Kollagenmembran zur geführten Knochenregeneration an dehiszierten Einzelimplantatstandorten: Ergebnis bei prothetischer Lieferung und bei der Nachuntersuchung nach 1 Jahr. Clinical Oral Implant Research, 30, 487–497. https://doi.org/10.1111/clr.13426
- Zitzmann, N. U., Schärer, P., & Marinello, C. P. (2001). Langzeitresultate von Implantaten, die mit geführter Knochenregeneration behandelt wurden: Eine 5-jährige prospektive Studie. International Journal of Oral and Maxillofacial Implants, 16, 355–366.