Korrektur der peri-implantären buccalen Knochendehiszenz nach subperiostaler peri-implantärer augmentierter Schichttechnik mit Block- oder Partikels-Xenograft: Eine retrospektive Studie
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziel: Die Wirksamkeit der Sub-periostalen Peri-Implantat Augmentierten Schicht (SPAL) Technik, die mit deproteinisiertem bovinem Knochenmineral (DBBM) durchgeführt wurde, entweder als Partikel (pDBBM) oder Block (bDBBM), zur Korrektur einer peri-implantären Knochendehiszenz (PIBD) zu bewerten. Auch Implantate mit einer dicken (≥ 2 mm) peri-implantären bukkalen Knochenplatte (PBBP) bei der Platzierung wurden untersucht.
Material und Methoden: Patienten mit einer PIBD ≥ 1 mm, die mit SPAL entweder mit pDBBM (SPALpartikular) oder bDBBM (SPALblock) behandelt wurden, sowie Patienten mit einem Implantat, das bei der Einsetzung eine PBBP ≥ 2 mm aufwies (KONTROLLE), wurden einbezogen. Die Wiedereröffnung erfolgte entweder nach 6 Monaten (SPAL-Gruppen) oder nach 3 Monaten (KONTROLLE). Die Rate der Patienten, die bei der Wiedereröffnung keine PIBD aufwiesen, war das primäre Ergebnis. Die Höhe der Knochendehiszenz (BDH) und die Breite (BDW), die Dicke des bukkalen Gewebes (BTT) und der marginale Knochenstand (MBL) waren sekundäre Ergebnisse.
Ergebnisse: Neununddreißig Implantate bei 39 Patienten (14 in SPALpartikular, 14 in SPALblock und 11 in KONTROLLE) wurden analysiert. Es wurden keine PIBD in SPALpartikular gefunden, während in SPALblock eine PIBD vorhanden war. Zwei Patienten in KONTROLLE wiesen eine PIBD auf. Eine Reduktion sowohl in BDH als auch in BDW wurde sowohl in SPALpartikular (2.7 ± 1.6 mm für BDH und 3.9 ± 0.2 mm für BDW) als auch in SPALblock (2.5 ± 1.8 mm für BDH und 3.8 ± 1.1 mm für BDW) beobachtet. SPALblock wies eine höhere BTT als SPALpartikular bei der Wiedereröffnung auf (3.6 ± 1.3 mm für SPALblock und 2.6 ± 0.6 mm für SPALpartikular, p = 0.0160). Alle Gruppen zeigten ähnliche MBL.
Einführung
Prothetisch gesteuerte Implantatplatzierung in einer reduzierten horizontalen Knochendimension führt häufig zu einer peri-implantären Knochendehiszenz (PIBD) (Bressan et al. 2017; Pramstraller et al. 2018).
Kleine knöcherne Dehiszenzdefekte, die zur spontanen Heilung belassen wurden, zeigten nach der Implantatinsertion einen größeren vertikalen Knochenverlust an der buccalen Seite sowie einen höheren marginalen Knochenverlust im Vergleich zu Stellen, die mit GBR behandelt wurden (Jung et al. 2017; Monje et al. 2023). Obwohl Implantate mit kleinen, nicht enthaltenen buccalen Knochendehiszenzen hohe Implantatüberlebensraten und gesunde peri-implantäre Gewebe bei einer Nachuntersuchung von 7,5 Jahren aufwiesen (Waller et al. 2020), war das Vorhandensein einer offensichtlichen PIBD mit einer höheren Inzidenz von Mukositis und Peri-Implantitis sowie einer schnelleren Progression der Peri-Implantitis im Vergleich zu Implantaten, die vollständig von Knochen umgeben sind, assoziiert (Schwarz, Sahm und Becker 2012; Monje et al. 2019). Trotz des prognostischen Wertes einer PIBD für die langfristige Gesundheit des peri-implantären Gewebes ist weiterhin umstritten, wurde die Korrektur einer buccalen Knochendehiszenz bei der Implantatplatzierung kürzlich empfohlen, um die Stabilität und gesunde Bedingungen des peri-implantären Gewebes im Laufe der Zeit zu fördern (Herrera et al. 2023; Monje et al. 2023; Song et al. 2024).
Um ein PIBD zu behandeln, wurden entweder Verfahren zur Knochen- oder Weichgewebeaugmentation vorgeschlagen. Beide Behandlungen zeigten stabile klinische und radiografische Ergebnisse im mittel- und langfristigen Zeitraum (Jensen et al. 2023; Monje et al. 2023). Unter den verschiedenen Verfahren zur lateralen Knochenaugmentation bei gleichzeitiger Implantation wurden die Geführte Knochenregeneration (GBR) und die Subperiostale peri-implantäre augmentierte Schichttechnik (SPAL, Trombelli et al. 2018) mit einer hohen Wahrscheinlichkeit in Verbindung gebracht, ein PIBD vollständig zu korrigieren (Severi et al. 2022). Insbesondere basiert SPAL auf der Verwendung des Periosts des Patienten als Barrieremembran, um ein Transplantat zu halten, das als „Raum schaffendes“ Gerüst fungiert. Bei der Durchführung in Kombination mit einem deproteinisierten bovinen Knochenmineral (DBBM) Partikelsubstrat (pDBBM) wurde gezeigt, dass SPAL effektiv bis zu 90,9 % der PIBDs vollständig korrigiert (Trombelli et al. 2019, 2020). Eine kürzlich durchgeführte retrospektive Studie verglich die Bedingungen des peri-implantären Hart- und Weichgewebes bei Implantaten, die entweder ein PIBD hatten, das mit SPAL behandelt wurde, oder ein dickes (≥ 2 mm) PBBP bei der Implantation (Trombelli et al. 2020). Obwohl in beiden Gruppen ähnliche gesunde Bedingungen des peri-implantären Gewebes festgestellt wurden, wurde in der SPAL-Gruppe eine weiter apikale Position des radiografischen marginalen Knochenlevels (MBL) festgestellt, was auf ein anderes Remodellierungsmuster des Transplantats im Vergleich zu native Knochen hindeutet (Trombelli et al. 2020). Diese Ergebnisse könnten die Relevanz der physiko-chemischen Eigenschaften des Transplantats in Bezug auf die Stabilität des rekonstruktiven Ergebnisses nach SPAL in Frage stellen. In diesem Zusammenhang deutete ein anekdotischer Bericht darauf hin, dass die Verwendung eines DBBM-Blocks (bDBBM) eine erfolgreiche Alternative in Kombination mit SPAL sein könnte (Trombelli et al. 2022).
Das Ziel der vorliegenden retrospektiven Studie war es, die Wirksamkeit von SPAL, die in Kombination mit entweder pDBBM oder bDBBM durchgeführt wurde, zur Korrektur eines PIBD zu bewerten. Darüber hinaus wurden die Veränderungen im peri-implantären Hartgewebe, die vom Einsetzen des Implantats bis zur Wiederöffnung für die Implantatfreilegung auftraten, analysiert. Eine Kontrollgruppe, bestehend aus Implantaten mit einer dicken (≥ 2 mm) PBBP zum Zeitpunkt des Implantateinsatzes, wurde ebenfalls untersucht.
Materialien und Methoden
2.1 Ethische Aspekte
Die vorliegende retrospektive Studie wurde vom Ethikkomitee des Area Vasta Emilia Centro, Italien (Protokoll-Nr. 523/2024/Oss/UniFe, Datum der Genehmigung 16.10.2024), genehmigt. Jeder Patient gab vor der chirurgischen Behandlung eine schriftliche informierte Einwilligung.
Alle klinischen Verfahren wurden in Übereinstimmung mit der Deklaration von Helsinki und den Richtlinien für gute klinische Praxis (GCPs) durchgeführt.
2.2 Studienpopulation
Die Patientenakten von Patienten, die im Zeitraum von Mai 2020 bis September 2021 eine implantatgestützte prothetische Rehabilitation im Forschungszentrum für die Studie von parodontalen und peri-implantären Erkrankungen der Universität Ferrara und in einer privaten Zahnarztpraxis in Ferrara durchlaufen haben, wurden gesichtet, um die Eignung der Patienten für die Studie zu bestimmen. Die vorliegende retrospektive Studie wurde gemäß den Richtlinien/Checklisten der STROBE-Erklärung für Querschnittsstudien durchgeführt.
Basierend auf den Bedingungen der buccalen Knochenplatte zum Zeitpunkt der Implantation und der chirurgischen Behandlung wurden die Patienten in 2 Gruppen eingeteilt:
- Patienten mit mindestens einem Implantat, das eine PIBD ≥ 1 mm aufwies, behandelt mit SPAL in Kombination mit pDBBM (SPALpartikulär Gruppe);
- Patienten mit mindestens einem Implantat, das eine PIBD ≥ 1 mm aufwies, behandelt mit SPAL in Kombination mit bDBBM (SPALBlock Gruppe).
Die SPAL-Gruppen bestanden aus nacheinander behandelten Patienten, bei denen relevante klinische und radiografische Messungen für die Datenanalyse abgerufen werden konnten. Wenn zwei oder mehr Implantate im selben Patienten für die Studie in Frage kamen, wurde nur das Implantat mit der PIBD mit der höchsten Knochendehiszenz für die Analyse ausgewählt. Darüber hinaus wurden Patienten mit mindestens einem Implantat, das eine verbleibende PBBP-Dicke ≥ 2 mm nach der Implantation aufwies, als Kontrollgruppe (KONTROLLgruppe) betrachtet.
Alle ausgewählten Implantate mussten in einem geheilten Knochenkamm platziert werden (Typ 4C Implantate, Gallucci et al. 2018) und mussten eine primäre Stabilität aufweisen, wie durch den Einfügedrehmoment bewertet. Schwere Raucher (Zigarettenkonsum > 10 Zigaretten/Tag) und Patienten mit Diabetes mellitus zum Zeitpunkt der Operation wurden von der Studie ausgeschlossen.
2.3 Klinische Verfahren
2.3.1 Präoperative Verfahren
Vor der Implantation hatten alle Patienten eine aktive Therapie zur Behandlung von Kariesläsionen und Parodontalerkrankungen durchlaufen und waren in eine professionelle Nachsorge eingeschrieben, wobei die Häufigkeit der Rückrufe gemäß dem PerioRisk-Bewertungstool (Trombelli et al. 2009, 2017; Farina et al. 2021) geplant wurde.
Alle chirurgischen Eingriffe wurden von zwei geschulten Operateuren (L.T., M.S.) durchgeführt. Den Patienten wurden 2 g Amoxicillin + Clavulansäure (Augmentin, GlaxoSmithKline, Verona, Italien) 1 Stunde vor der Operation verabreicht. Die lokale Anästhesie wurde mit Articain und 1:100.000 Epinephrin durch lokale Infiltration erreicht.
2.3.2 Chirurgische Verfahren
2.3.2.1 SPAL-Gruppen.
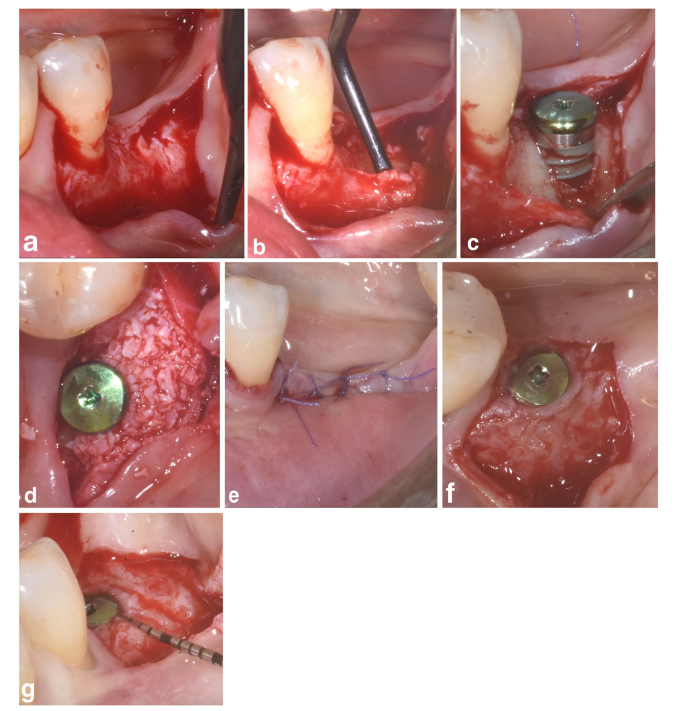
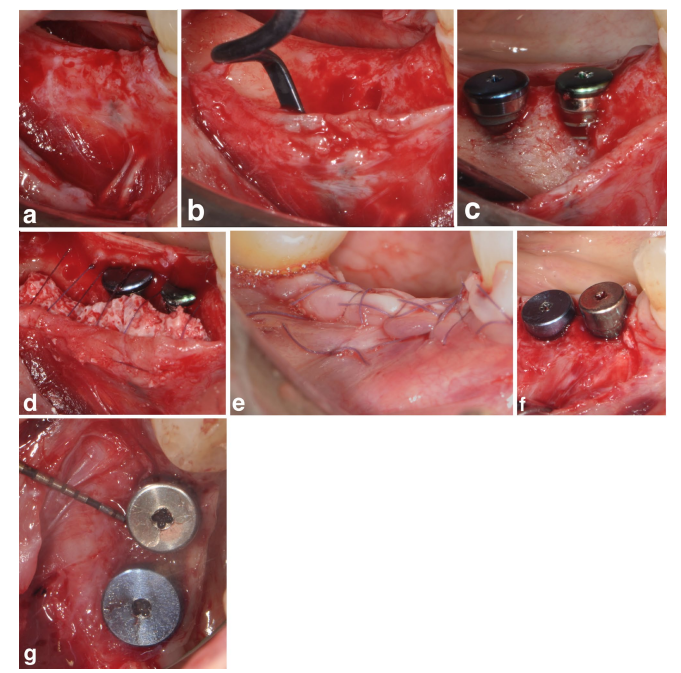
In beiden SPALpartikulär und SPAL-block Gruppen wurde der chirurgische Zugang zur Knochenkante gemäß einem zuvor beschriebenen Verfahren (Trombelli et al. 2018) durchgeführt. Kurz gesagt, wurde eine mukosale Schicht an der bukkalen Seite durch eine Spalthautdissektion mit einer 15C-Klinge angehoben (Abbildungen 1a und 2a). Dann wurde die periostale Schicht mit einem Periostheber (PTROM, Hu-Friedy, Chicago, Illinois) sowie mit Tunnelmessern (KPAX, TKN1X und TKN2X, Hu Friedy, Chicago, Illinois) mit unterschiedlich angulierten scharfen Kanten vom Knochen abgehoben, wodurch eine subperiostale Tasche geschaffen wurde, die ein Transplantat aufnehmen konnte (Abbildungen 1b und 2b). Ein Vollschichtlappen wurde an der oralen (lingualen/palatalen) Seite angehoben. Die Mylohyoid-Muskelfasern wurden mit einem stumpfen Instrument von dem lingualen Lappen abgetrennt, um eine koronale Vorverlagerung zu ermöglichen. Kortexperforationen wurden mit einem kalibrierten zylindrischen Hartmetallbohrer durchgeführt, um die Blutversorgung des chirurgischen Bereichs zu erhöhen (Majzoub et al. 1999; Acar et al. 2016).
Tissue-level Implantate (SPI Element; Thommen Medical, Grenchen, Schweiz) wurden mit dem koronalen Rand des 1-mm polierten Kragens auf Höhe des Knochenkamms platziert (Abbildungen 1c und 2c).
Ein bovines Xenograft, geliefert entweder als Partikel (Bio-Oss Spongiosa-Granulate, Partikelgröße 0,25–1,0 mm; Geistlich Pharma, AG, Wolhusen, Schweiz) (Trombelli et al. 2018) oder Block (Bio-Oss Block; Geistlich Pharma, AG, Wolhusen, Schweiz) (Trombelli et al. 2022), wurde verwendet, um den chirurgisch geschaffenen Raum zwischen der periostalen Schicht und der freiliegenden Implantatoberfläche zu füllen. Der Block wurde mit einem 15C-Messer oder einem Diamantbohrer in kleinere Stücke zerlegt, um sich an das Ausmaß des subperiostalen Raums anzupassen und die gewünschte Rekonturierung der buccalen Platte zu erreichen. Das Transplantat wurde durchgeführt, um die PIBD bis zum Knochenkamm vollständig zu korrigieren. In allen Fällen bot das subperiostale Transplantat mindestens 2 mm Dicke am polierten Kragen des Implantats.
Der koronale Teil der periostalen Schicht wurde dann mit resorbierbaren internen Matratzennähten (Vicryl 6/0, Ethicon, Somerville NJ, USA) an dem oralen Lappen befestigt (Abbildungen 1d und 2d). Anschließend wurde die mukosale Schicht koronale vorverlagert und mit horizontalen internen Matratzen- und unterbrochenen Nähten an dem oralem Lappen genäht, um eine submerse Heilung sowohl für das Transplantat als auch für das Implantat zu gewährleisten (Abbildungen 1e–2e).
Bei der chirurgischen Wiederöffnung nach 6 Monaten zur Freilegung des Implantats wurde ein buccaler Spalthautlappen präpariert, um das Heilungsabutment zu positionieren. Um das Vorhandensein/Nichtvorhandensein eines residualen PIBD zu beurteilen, wurde das Vorhandensein von Hartgewebe um die Implantatoberfläche mit einer UNC-15 Sonde bewertet. Wenn keine Sondendurchdringung über den polierten Implantatkragen hinaus vorhanden war, wurde das Implantat als „vollständig korrigierte Dehiszenz“ kategorisiert.
Um angemessene Dimensionen der keratinisierten peri-implantären Mukosa (KT) bereitzustellen, wurde entweder eine apikale Positionierung des Lappens (APF) oder ein freies Zahnfleischtransplantat (FGG) durchgeführt (Trombelli et al. 2019) (Abbildungen 1f,g und 2f). Die Entscheidung, entweder ein APF oder ein FGG durchzuführen, basierte auf der Notwendigkeit, eine KT-Höhe von mindestens 2 mm sowohl an der bukkalen als auch an der lingualen Seite des Implantats sicherzustellen.
2.3.2.2 Kontrollgruppe.
Ein buccaler und lingualer/palatinaler Volldickenschlitz wurde angehoben, um den Knochenrand freizulegen. Der Implantatstandort wurde gemäß den Anweisungen des Herstellers vorbereitet und Gewebeebenen-Implantate (SPI Element; Thommen Medical, Grenchen, Schweiz) wurden eingesetzt, wobei der koronale Rand des 1-mm polierten Kragens auf Höhe des Knochenrands lag. Es wurde kein Knochenaufbauverfahren durchgeführt. In allen Fällen wurde der Schlitz mit internen Matratzen- und unterbrochenen Nähten (Vicryl 5/0, Ethicon, Somerville NJ, USA) genäht, um eine submerse Heilung zu gewährleisten.
Bei der chirurgischen Nachuntersuchung nach 3 Monaten zur Freilegung des Implantats wurde ein buccaler Volldickenschlitz angehoben, um das Heilungsabutment zu verschrauben. Der Schlitz wurde dann zugeschnitten und an das Heilungsabutment angepasst, um angemessene Dimensionen der peri-implantären keratinisierten Mukosa zu gewährleisten.
2.3.2.3 Postoperative Verfahren.
Ein Rettungs-Entzündungshemmer (d.h. Ibuprofen 600 mg Tabletten) wurde unmittelbar nach der Operation verschrieben, dann nach Bedarf für die folgenden postoperativen Tage. Den Patienten wurde geraten, für mindestens 4 Wochen keine herausnehmbaren Prothesen zu tragen, um Druck auf die Operationsstelle zu vermeiden, und im behandelten Bereich etwa 2 Wochen lang nicht zu kauen oder zu putzen. Die häusliche Anwendung einer 0,12% Chlorhexidinlösung (Dentosan, Recor-dati, Mailand, Italien) wurde zur chemischen Plaque-Kontrolle verschrieben (1-min Spülung b.i.d. für 3 Wochen). Die Nähte wurden 2 Wochen nach der Operation entfernt.
2.4 Studienparameter
2.4.1 Klinische Messungen
Um die Wirkung der Behandlung auf PIBD zu bewerten, wurden die folgenden klinischen Messungen aus den klinischen Unterlagen entnommen:
- Höhe der Knochendefekte (BDH): gemessen an der mittleren bukkalen Seite des Implantats als der Abstand zwischen dem apikalen Rand des polierten Kragens des Implantats und dem ersten Knochen-zu-Implantat-Kontakt;
- Breite der Knochendefekte (BDW): gemessen an der bukkalen Seite des Implantats als der breiteste exponierte Teil der rauen Implantatoberfläche.
In allen Gruppen wurden BDH und BDW unmittelbar nach der Implantation und bei der Wiederöffnung zur Freilegung des Implantats bewertet.
Darüber hinaus wurde die Dicke der bukkalen Gewebe (BTT) als der Abstand zwischen dem bukkalen Kontur des polierten Kragens und der äußeren Seite entweder des transplantierten Bereichs (SPAL-Gruppen) oder des nativen Knochens (KONTROLLGRUPPE) an der mittleren bukkalen Seite des Implantats gemessen. Die Ausgangswerte der BTT wurden aufgezeichnet:
- Unmittelbar nach der Implantation für die Kontrollgruppe;
- Unmittelbar nach der Transplantation für beide SPAL-Gruppen; BTT wurde bei der chirurgischen Wiederaufnahme für alle Gruppen erneut aufgezeichnet.
Alle Messungen wurden mit einer UNC-15-Parodontalsonde durchgeführt und auf den nächsten Millimeter gerundet.
2.4.2 Radiografische Messungen
Periapikale Röntgenaufnahmen, die mit der Langkegel-Paralleltechnik unmittelbar nach der Operation und bei der Wiederaufnahme für alle Gruppen aufgenommen wurden, wurden digitalisiert und mit einer speziell entwickelten Software (NIS elements v4.2; Nikon Instruments, Campi Bisenzio, Firenze, Italien) analysiert. Der marginale Knochenstand (MBL) wurde als der Abstand (auf den nächsten 0,1 mm gerundet) zwischen dem apikalsten Rand des polierten Implantathals und dem Knochenrand an der mesialen (mMBL) und distalen (dMBL) Seite jedes Implantats unter Verwendung einer 10×–15× Vergrößerung gemessen. MBL wurde als negativ oder positiv aufgezeichnet, wenn der apikale Rand des polierten Halses entweder apikal oder koronial zum Knochenrand lag, jeweils.
Ein 1-mm hoher Referenzpunkt, der auf der digitalen Radiographie vorhanden war, wurde zur Kalibrierung verwendet.
Zwei Prüfer (C.F. und M.S.) führten die radiographischen Messungen durch. Die Prüfer waren an einer Kalibrierungssitzung mit einer Stichprobe von Radiographien beteiligt, die von Patienten stammen, die nicht für die vorliegende Studie ausgewählt wurden. Die Kalibrierungssitzung bestand aus zwei Sitzungen von MBL-Messungen, die im Abstand von 7 Tagen durchgeführt wurden, und ermöglichte eine hervorragende Übereinstimmung zwischen den Prüfern sowie innerhalb der Prüfer (k-Wert 0,87).
Statistische Analyse
Die Rate der Patienten, bei denen die raue Implantatoberfläche bis zum apikalen Teil des polierten Kragens (d.h. kein PIBD) bei der Wiederaufnahme abgedeckt war, wurde als primäres Ergebnis betrachtet. Werte und Veränderungen in BDH, BDW, BTT und MBL waren sekundäre Ergebnisvariablen.
Die Stichprobengröße wurde anhand von Daten aus einer früheren Studie (Benic et al. 2019) berechnet, bei der die Rate der Patienten, bei denen die raue Implantatoberfläche bis zur Implantatschulter bei der Wiederaufnahme abgedeckt war, 91,7 % in den DBBM-Blockgruppen und 25,0 % in der DBBM-Partikelgruppe betrug. Der Z-Test schätzte, dass mindestens 11 Patienten für jede der beiden unabhängigen SPAL-Gruppen erforderlich waren, um eine statistische Power von 95 % mit einem Alpha-Fehler von 0,05 zu erreichen.
Der Patient wurde als statistische Einheit betrachtet. Die Daten wurden unter Verwendung von Mittelwert, Standardabweichung, Median, Interquartilsbereich (IR) und Minimal-Maximalwerten für quantitative Variablen sowie Prozentanteilen für kategoriale Variablen beschrieben.
Intra-Gruppen-Vergleiche für kontinuierliche/ordinale Variablen wurden unter Verwendung des Wilcoxon-Vorzeichen-Rang-Tests für gepaarte Daten durchgeführt. Inter-Gruppen-Vergleiche für kontinuierliche/ordinale Variablen wurden unter Verwendung der Kruskal-Wallis-ANOVA durchgeführt. Im Falle von Signifikanz beim Kruskal-Wallis-Test wurden multiple (post hoc) Vergleiche der durchschnittlichen Ränge berechnet; normale z-Werte wurden für jeden Vergleich berechnet, sowie post hoc Wahrscheinlichkeiten (korrigiert für die Anzahl der Vergleiche) für einen zweiseitigen Test auf Signifikanz. Inter-Gruppen-Vergleiche für binäre Variablen wurden unter Verwendung von Maximum-Likelihood-Chi-Quadrat-Tests mit Yate's Korrektur durchgeführt. Die Veränderung der sekundären Ergebnisvariablen wurde statistisch unter Verwendung von generalisierten linearen Modellen (GLZ) bewertet, die für die signifikanten Störfaktoren angepasst wurden, gefolgt von ANOVA für wiederholte Messungen für Inter-Gruppen-Vergleiche und mit dem post hoc ungleichen N HSD-Test.
Ergebnisse
4.1 Studienpopulation
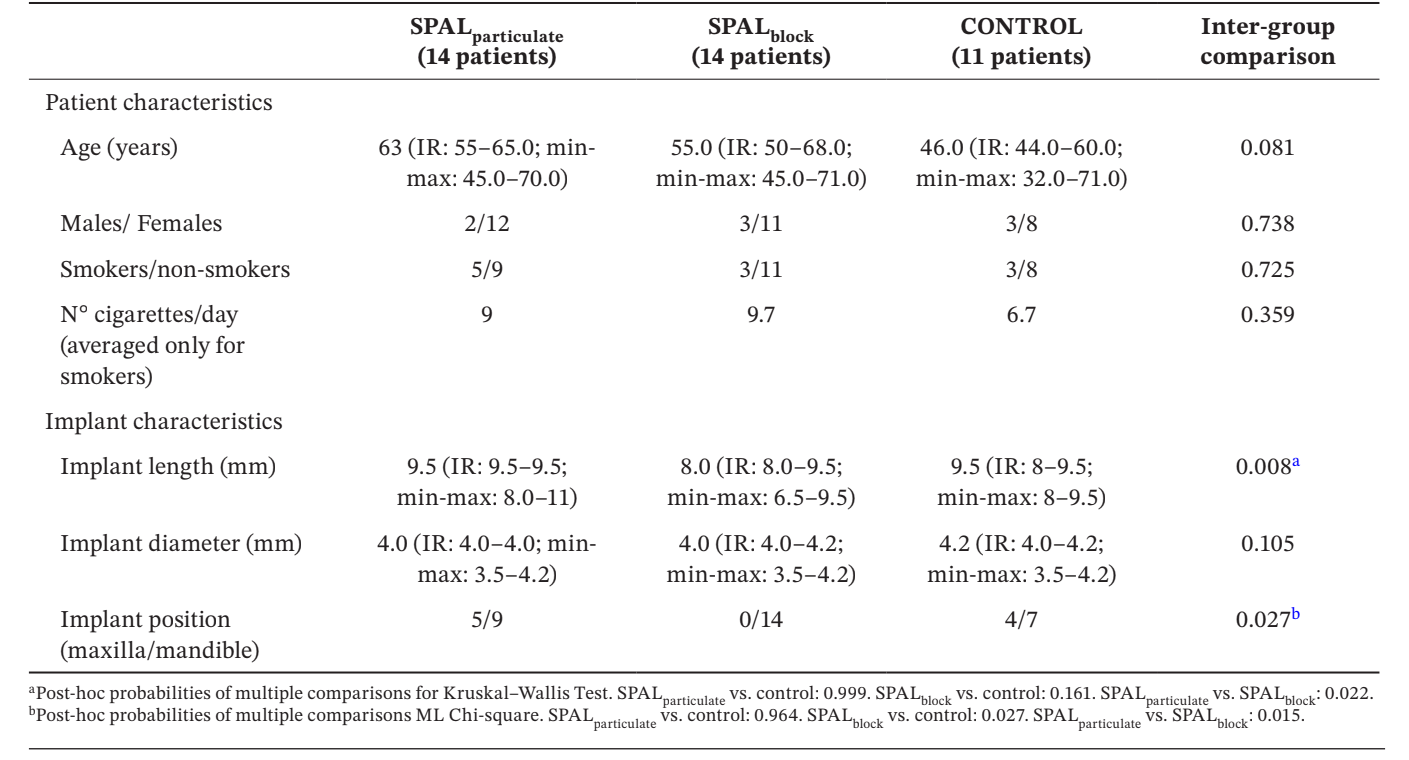
Neununddreißig Implantate bei 39 Patienten (14 in der SPALpartikulären Gruppe, 14 in der SPALblock Gruppe und 11 in der Kontrollgruppe) wurden zur Analyse ausgewählt (Tabelle 1). Es wurden keine Unterschiede im Alter, Geschlecht und Raucherstatus zwischen den Gruppen beobachtet, die überwiegende Mehrheit der Patienten waren Nichtraucher. In den Gruppen SPALpartikulär und Kontrollgruppe befand sich ein Drittel der Implantate im Oberkiefer, während sich alle Implantate in der Gruppe SPALblock im Unterkiefer befanden. Dieser Unterschied war statistisch signifikant (p = 0.027). Die in der Gruppe SPALblock platzierten Implantate waren signifikant kürzer als die in den Gruppen SPALpartikulär und Kontrollgruppe platzierten Implantate (p = 0.008).
4.1.1 Postoperative Heilung
In beiden Gruppen, SPALpartikulär und CONTROL, war die frühe Heilung bei allen Patienten ereignislos.
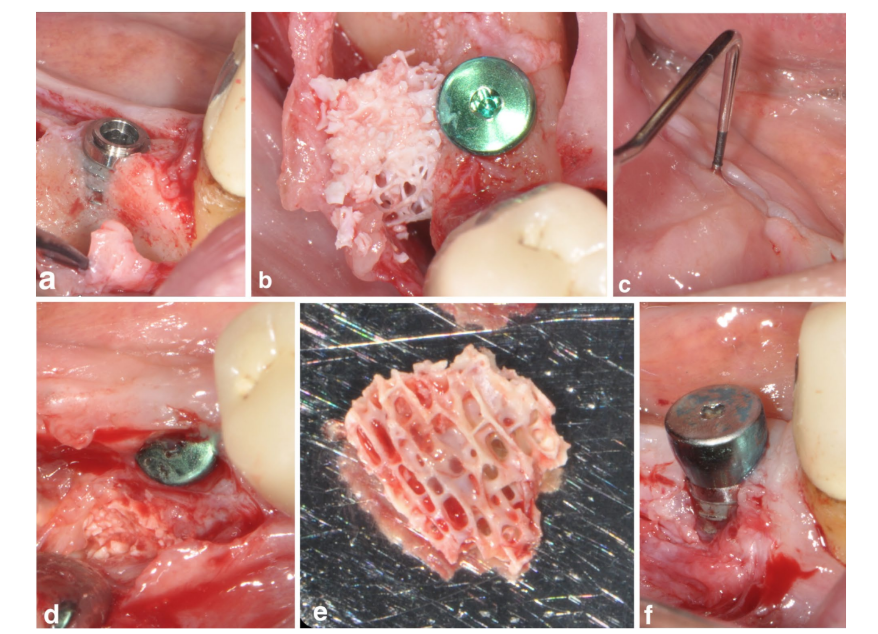
Ein Patient in der SPALblock Gruppe erlitt 4 Wochen nach dem chirurgischen Eingriff eine postoperative Infektion. Der Patient berichtete über Schwellungen und Schmerzen im chirurgisch behandelten Bereich, und eine Fistel, die eitriges Exsudat abließ, war offensichtlich (Abbildung 3a–f). Nach der Elevation des Teilklappen wurde der DBBM Blocktransplantat in Granulationsgewebe eingebettet und daher entfernt.
4.2 Studienergebnisse
4.2.1 Primäres Ergebnis
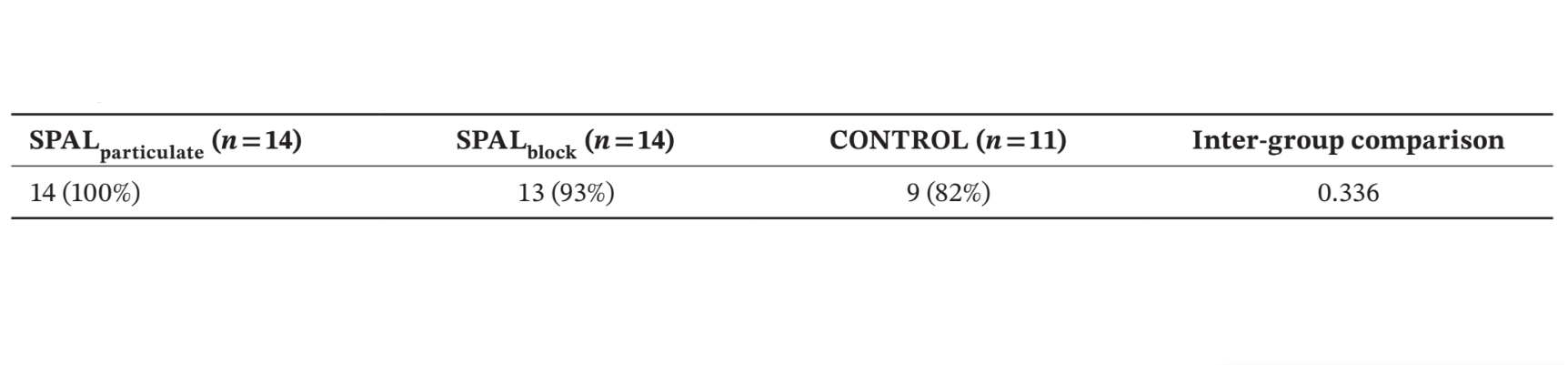
Anzahl und % der Patienten, die die raue Implantatoberfläche bis zum apikalen Teil des polierten Kragens bei der Wiederaufnahme (d.h. kein PIBD) präsentieren, sind in Tabelle 2 dargestellt. In der SPALparticulate Gruppe wurde kein residualer Defekt gefunden, während in der SPALblock Gruppe der Patient, der eine postoperative Transplantatinfektion erlebt hatte, ein residuales PIBD aufwies. Zwei Patienten in der CONTROL Gruppe präsentierten ein Vorfall PIBD bei der Wiederaufnahme (Tabelle 2). Die Unterschiede zwischen den Gruppen waren statistisch nicht signifikant.
4.2.2 Sekundäre Ergebnisse
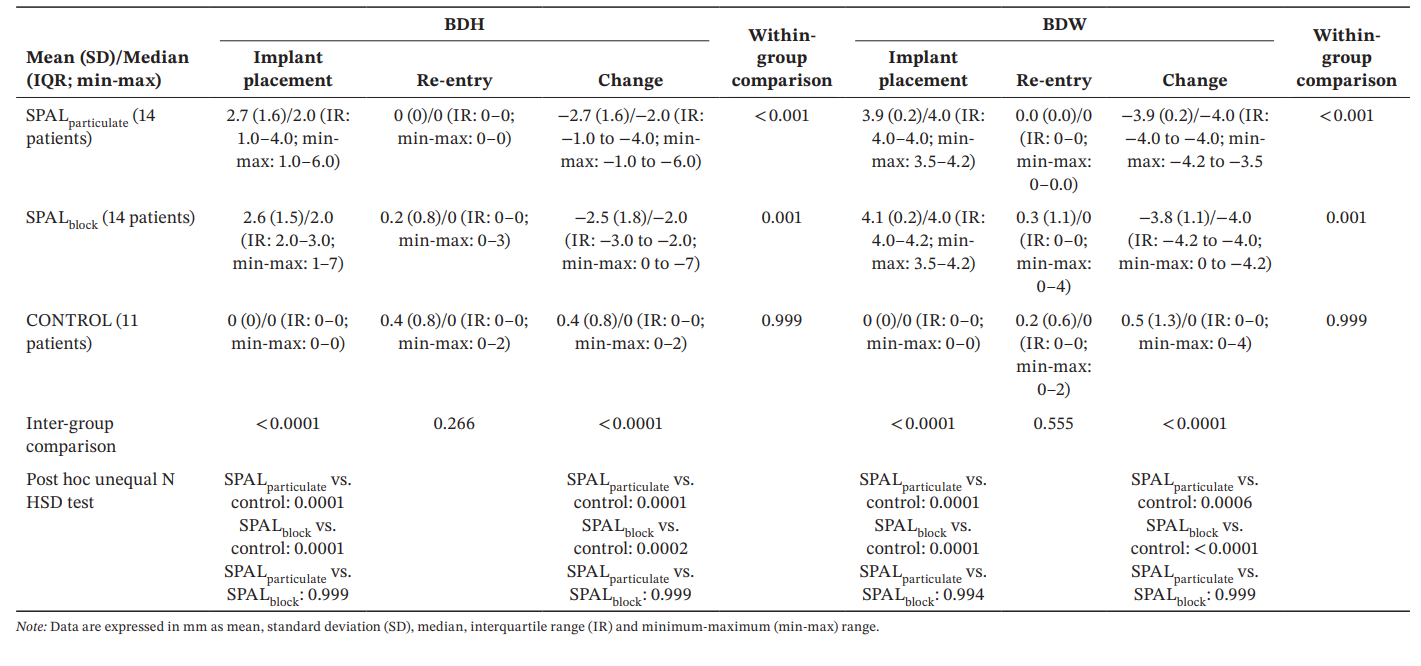
Das GLZ-Modell, das für die identifizierten Störfaktoren (Implantatlänge und -position) angepasst wurde, zeigte, dass sowohl die Behandlung als auch die Zeit signifikante Prädiktoren für sowohl BDH als auch BDW waren (Zeit, p < 0.0001 für beide; Behandlung, p < 0.001 für beide). Die Vergleiche innerhalb und zwischen den Gruppen für BDH und BDW sind in Tabelle 3 aufgeführt. Der Wilcoxon-Test für gepaarte Daten zeigte eine signifikante Reduktion der Zeit für sowohl SPALparticulate (p < 0.001 für sowohl BDH als auch BDW) als auch SPALblock Gruppen (p = 0.001 für sowohl BDH als auch BDW). Bei der Implantation waren die SPAL-Gruppen beide signifikant unterschiedlich von der CONTROL-Gruppe (p = 0.0001 für sowohl BDH als auch BDW). Es wurden jedoch keine signifikanten Unterschiede zwischen den Gruppen bei der Wiederaufnahme für sowohl BDH als auch BDW festgestellt. In der SPALblock Gruppe zeigte der Patient mit dem residualen PIBD einen BDH von 3 mm und einen BDW von 4 mm. In der CONTROL-Gruppe zeigten die beiden Patienten mit einem Vorfall von PIBD bei der Wiederaufnahme einen BDH von 2 mm und einen BDW von 2 mm sowie einen BDH von 2 mm und einen BDW von 4 mm, jeweils.
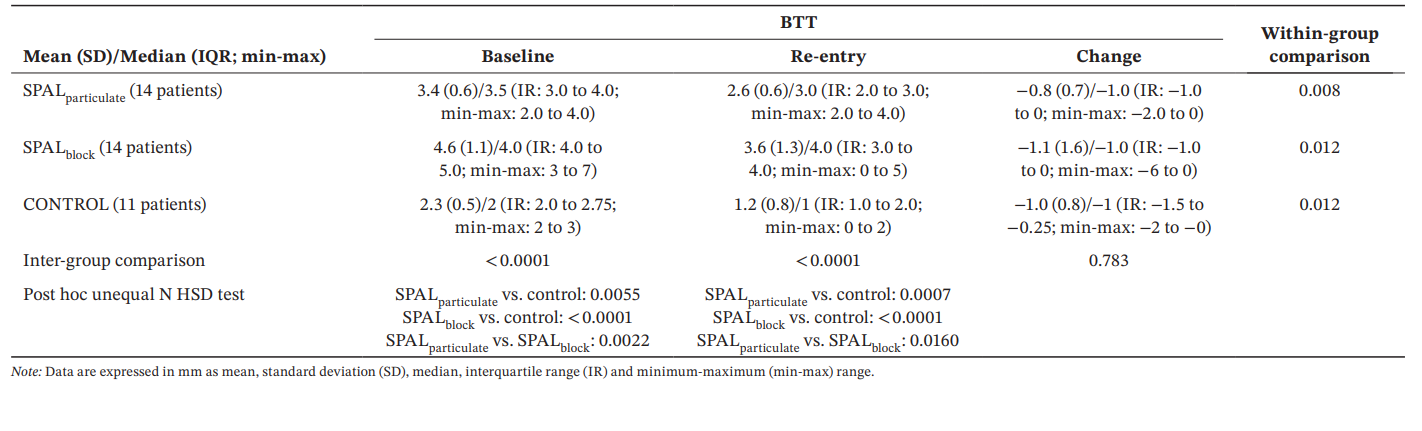
Für BTT zeigte das GLZ-Modell, das für die identifizierten Störfaktoren angepasst wurde, dass sowohl die Behandlung als auch die Zeit signifikante Prädiktoren waren (p < 0.0001 für beide Faktoren). Die Intra- und Intergruppenvergleiche für BDH und BDW sind in Tabelle 4 aufgeführt. Ein signifikanter Unterschied zwischen den Gruppen wurde sowohl zu Beginn als auch beim Wiedereintritt beobachtet (p < 0.0001). Insbesondere zeigte die SPALblock Gruppe signifikant höhere Werte als die SPALparticulate sowohl zu Beginn (p = 0.0022) als auch beim Wiedereintritt (p = 0.0160). Die Intra-Gruppenvergleiche zeigten eine signifikante Reduktion von BTT über die Zeit für alle Gruppen, wobei das Ausmaß dieser Reduktion zwischen den Gruppen ähnlich war.
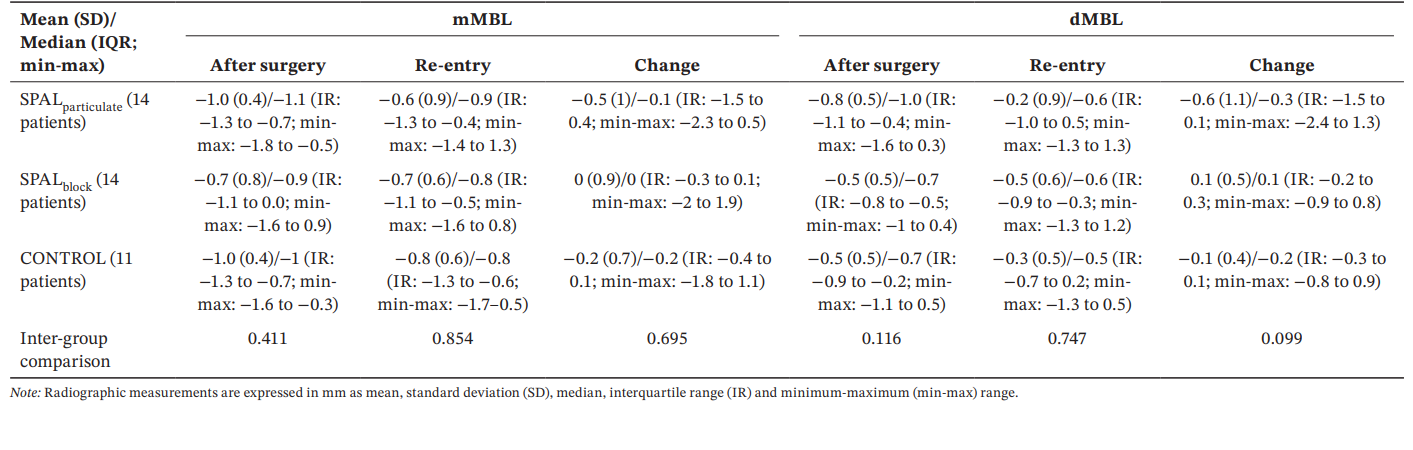
Alle Gruppen zeigten ähnliche mMBL- und dMBL-Werte nach der Operation und bei der Wiederaufnahme sowie Veränderungen über die Zeit (Tabelle 5).
Diskussion
Das Ziel der vorliegenden retrospektiven Studie war es, die Wirksamkeit der SPAL-Technik zu bewerten, die in Kombination mit DBBM in Form von entweder Partikeln oder Blöcken durchgeführt wurde, um ein PIBD bei der Implantation vollständig zu korrigieren. Die SPAL-Gruppen wurden auch mit einer Gruppe von Patienten verglichen, die nach der Implantation eine peri-implantäre buccale Knochenplatte von mindestens 2 mm aufwiesen. Die Ergebnisse zeigten, dass unabhängig von der Form des DBBM die mit der SPAL-Technik behandelten Implantate eine ähnlich hohe Rate von Patienten aufwiesen, die eine vollständige Defektkorrektur nach 6 Monaten Re-Entry zeigten. Die SPALblock Gruppe zeigte sowohl zu Beginn als auch beim Re-Entry eine signifikant höhere BTT. Der Umfang der Transplantat-/Knochenumbau war jedoch zwischen den Gruppen ähnlich.
Die Wahl, die Rate der vollständigen Dehiszenzkorrektur als primäres Ergebnis zu verwenden, beruhte auf der Tatsache, dass ein unbehandeltes oder teilweise korrigiertes PIBD (i) das Auftreten einer biologischen Komplikation begünstigen kann (Monje et al. 2019; Schwarz, Sahm und Becker 2012) und (ii) zu einem erhöhten interproximalen peri-implantären Knochenverlust führen kann (Jung et al. 2017). Die CONTROL-Gruppe wurde einbezogen, um das Ausmaß des Umbaus der beiden Transplantat-Biomaterialien im Vergleich zum nativen Knochen zu bewerten.
Die Wirksamkeit von SPAL, die in Kombination mit einem pDBBM zur Behandlung eines PIBD durchgeführt wurde, entsprach den Ergebnissen früherer klinischer Studien, in denen dasselbe Partikeldmaterial verwendet wurde, und zeigte eine Rate der vollständigen Dehiszenzdeckung von 80 % bis 91 % (Trombelli et al. 2019, 2020). Diese Ergebnisse könnten teilweise biologischen und technischen Aspekten zugeschrieben werden, die spezifisch für das regenerative Verfahren sind. In der SPAL-Technik stellt die Periostschicht eine Quelle für osteogene Zellen dar, die (i) positiv zur Neubildung von Knochen beitragen können (Ceccarelli et al., 2016) und (ii) als neo-angiogenetischer Induktor wirken, wodurch die frühe Vaskularisierung des DBBM-Transplantats gewährleistet wird (Nobuto et al. 2005). Darüber hinaus kann die Schaffung eines abgeschotteten subperiostalen Raums eine angemessene Unterbringung und Stabilisierung des Transplantats im koronalsten Bereich des Implantats ermöglichen (Trombelli et al. 2018, 2019, 2020). Die Stabilität des Transplantats zur Unterstützung der osteokonduktiven Aktivität des Transplantats wird auch durch interne Matratzennähte erhöht, die den koronalsten Teil der periostalen Schicht mit dem oralen Lappen sichern. Konsistent zeigt eine Netzwerk-Metaanalyse, die verschiedene Behandlungsoptionen zum vollständigen Ausgleich eines PIBD vergleicht, dass SPAL mit einem pDBBM die höchste Erfolgswahrscheinlichkeit unter den einbezogenen Verfahren hat (Severi et al. 2022).
In letzter Zeit wurde die Verwendung von bDBBM in Kombination mit SPAL als vielversprechende Alternative zu einem partikulären Transplantat vorgeschlagen (Trombelli et al. 2022). Es wurde vorgeschlagen, dass bDBBM als wirksames osteokonduktives Gerüst wirkt, aufgrund seiner mechanischen Eigenschaften, die eine begrenzte Verschiebung bei der Klappenmanipulation sowie eine höhere dimensionsstabilität umfassen (Benic et al. 2016; Benic et al. 2017; Mir-Mari et al. 2016). Die Wirksamkeit von bDBBM wird durch unsere Ergebnisse unterstützt, die eine 93%ige Rate an vollständiger PIBD-Korrektur zeigten. Darüber hinaus führte die Verwendung von bDBBM zu einem größeren BTT als pDBBM sowohl zu Beginn als auch bei der Wiederaufnahme. Diese Ergebnisse stimmen mit denen aus einer Studie überein, in der die Kombination von bDBBM und einer Kollagenmembran, gleichzeitig mit der Implantation, als überlegen gegenüber der Kombination derselben Membran und pDBBM in der vollständigen Defektauflösung und Wiederherstellung einer dicken buccalen Platte gezeigt wurde (Benic et al. 2019). Es sollte jedoch betont werden, dass ein Patient, der das Blocktransplantat erhielt, eine postoperativen Transplantatinfektion erlebte, die zu einer anhaltenden Dehiszenz nach 6 Monaten führte. Frühere Studien, in denen ein xenogenes Knochenblock für ein Ridge-Augmentationsverfahren verwendet wurde, das vor der Implantation durchgeführt wurde, berichteten von einer Infektionsrate des Transplantats und anschließender Entfernung von 33% (Ortiz-Vigón et al. 2017) bis 40% (Schwarz et al. 2021) der behandelten Fälle. Präklinische (Benic et al. 2016; Benic et al. 2017) und klinische (Laas et al., 2020) Studien zeigten, dass bDBBM im Vergleich zu pDBBM schlecht von neuem Knochen kolonisiert wurde. Die beobachtete begrenzte Knochenbildung war mit einer beeinträchtigten Vaskularisation des Blocks aufgrund seiner Makrostruktur verbunden (Laass et al. 2020). Ob und inwieweit die Verwendung von bDBBM eine sichere und wirksame Alternative zu pDBBM in Kombination mit der SPAL-Technik darstellen könnte, muss weiter evaluiert werden.
Unser Studiendesign könnte erste Einblicke in das Ausmaß der Transplantatumgestaltung nach SPAL-Verfahren mit unterschiedlichen Transplantatformen im Vergleich zur Knochenumgestaltung nach der Implantatplatzierung bieten. Obwohl die SPALblock Gruppe sowohl nach der Operation als auch bei der Wiederaufnahme eine signifikant größere BTT zeigte, war das Ausmaß der Transplantatumgestaltung für die beiden Transplantate und im Vergleich zu native Knochen ähnlich. Die BTT-Änderungen in der SPALblock Gruppe waren konsistent mit früheren Studien, die die Transplantatumgestaltung nach dem GBR-Verfahren bewerteten, das unter Verwendung eines bDBBM in Kombination mit einer Kollagenmembran durchgeführt wurde (Benic et al. 2019). Im Gegensatz dazu zeigte dieselbe Studie, dass die durchschnittliche Reduktion der Dicke für ein pDBBM plus Kollagenmembran doppelt so groß war (2 mm) im Vergleich zu unseren Daten. Unterschiede in den BTT-Änderungen, die in den beiden Studien beobachtet wurden, können durch unterschiedliche Dynamiken der Transplantatumgestaltung sowie das Ausmaß der Transplantatverschiebung infolge des spezifischen regenerativen Verfahrens erklärt werden. Insgesamt deuten diese Beobachtungen darauf hin, dass es notwendig ist, die BTT-Dimension übermäßig zu korrigieren, um die postoperative horizontale Schrumpfung des Transplantats unabhängig von den verwendeten Knochenaugmentationstechniken auszugleichen.
In unserer Material-KONTROLLgruppe bestand die Gruppe aus Patienten, bei denen eine PBBP-Dicke von mindestens 2 mm nach der Implantation vorhanden war. Diese Wahl basierte auf früheren Studien, die zeigten, dass die PBBP-Dicke mit der Inzidenz von vertikalem Knochenverlust an der buccalen Platte nach der Implantation korreliert (Spray et al. 2000) und dem daraus resultierenden Bedarf an Knochenaugmentationverfahren (Roccuzzo, Imber und Jensen 2021). Interessanterweise wurde auch eine durchschnittliche Reduktion der BTT um 1 mm in der KONTROLLgruppe beobachtet, was dazu führte, dass zwei Patienten (18%) bei der Wiederaufnahme ein Ereignis von PIBD erlebten. Die Knochenremodellierung überstieg die in früheren Studien berichteten Werte, bei denen die Reduktion der PBBP-Dicke nach der Implantation zwischen 0,3 (Merheb et al. 2017) und 0,4 mm (Cardaropoli, Lekholm und Wennström 2006) lag. Verschiedene Faktoren, einschließlich der 3D-Implantatpositionierung (Nomiyama et al. 2022), Methoden zur Vorbereitung des Implantatstandorts (Baggi et al. 2008; Peker Tekdal et al. 2016), Implantatdesign/-oberfläche (Linkevicius et al. 2020; Galindo-Moreno et al. 2016; Camarda et al. 2021), anatomische Lage (anterior/posterior, Mandibel/Maxilla) (Ghaly et al. 2023), Dicke der peri-implantären Mukosa (Maia et al. 2015; Suárez-López Del Amo et al. 2016) und prothetische Verbindung (Linkevicius et al. 2015) könnten teilweise für diese abweichende Beobachtung verantwortlich gewesen sein.
Um die primäre Wundheilung zu erleichtern, wurden Gewebeebenen-Implantate platziert, wobei der koronale Rand des polierten Kragens auf Höhe des Knochenkamms lag. In dieser Hinsicht kann der Einfluss der Implantatpositionierung auf die Menge der PIBD-Korrektur sowie das Ausmaß der peri-implantären Knochenumbauvorgänge nach der Implantation nicht ausgeschlossen werden (Saleh et al. 2018). Darüber hinaus wurden die SPAL-Gruppen und die Kontrollgruppe zu unterschiedlichen postoperativen Zeitpunkten (6 Monate vs. 3 Monate) für die Freilegung der Implantate erneut untersucht. Dieser Unterschied könnte sich unterschiedlich auf den Gewebeumbau nach der Implantation ausgewirkt haben.
Der peri-implantäre marginale Knochenverlust nach der Implantation kann auf physiologischen Umbau aufgrund mechanischer und thermischer Traumata während der Vorbereitung des Implantatbereichs zurückzuführen sein. Interessanterweise wurde in unserem Material eine begrenzte Menge an Transplantat-/Knochenumbau ähnlich in den Gruppen beobachtet und war konsistent mit früheren Studien, in denen Gewebeebenen-Implantate entweder equikrestal platziert (Saleh et al. 2018) oder mit SPAL plus pDBBM behandelt wurden (Trombelli et al. 2020).
Einige Einschränkungen der vorliegenden Studie sollten bei der Interpretation der Ergebnisse berücksichtigt werden. Die Wahl einer Pilotstudie mit einem retrospektiven Design basierte auf dem Fehlen spezifischer klinischer Indikationen (d.h. patienten-/defektbezogene Faktoren), um die SPAL-Technik mit entweder DBBM-Partikeln oder DBBM-Blöcken zu kombinieren, aufgrund der begrenzten, anekdotischen Evidenz (Trombelli et al. 2022), die die Verwendung von DBBM-Blöcken in Kombination mit der SPAL-Technik unterstützt. Eine spezifische DBBM-Formulierung wurde entsprechend der Präferenz des Operateurs verwendet. Diese unvoreingenommene Auswahl des verwendeten Transplantats hat zu keinen signifikanten Unterschieden hinsichtlich der Patienten- und Defektmerkmale geführt. Einige Faktoren, wie anatomische Lage und Länge der Implantate, waren jedoch ungleichmäßig zwischen den Gruppen verteilt und könnten, obwohl sie durch die statistische Analyse kontrolliert wurden, die beobachteten Ergebnisse beeinflusst haben. Da die eingeschlossenen Patienten während der routinemäßigen klinischen Tätigkeit nacheinander behandelt wurden, war eine UNC 15 Sonde das reguläre/standardisierte Werkzeug, das für alle klinischen Messungen, einschließlich der PIBD-Dimensionen, verwendet wurde. Andere Messmethoden, wie ein Messschieber (Roccuzzo, Imber und Jensen 2021) oder ein speziell entwickeltes Gerät (Merheb et al. 2017), hätten zu angemesseneren Aufzeichnungen der Dehiszenzgröße und BBT führen können.
Zusammenfassend scheinen unsere Ergebnisse darauf hinzudeuten, dass SPAL in Kombination mit entweder einem partikulären oder blockförmigen DBBM-Transplantat ähnlich effektiv ist, um ein PIBD zu korrigieren und das BTT nach 6 Monaten zu erhöhen.
Mattia Severi, Franzini Chiara, Anna Simonelli, Chiara Scapoli, Leonardo Trombelli
Literaturverzeichnis
- Baggi, L., I. Cappelloni, M. Di Girolamo, F. Maceri und G. Vairo. 2008. „Der Einfluss des Implantatdurchmessers und der Länge auf die Spannungsverteilung von osseointegrierten Implantaten in Bezug auf die Geometrie des Krestalknochens: Eine dreidimensionale Finite-Elemente-Analyse.“ Journal of Prosthetic Dentistry 100, Nr. 6: 422–431. https://doi.org/10.1016/S0022-3913(08)60259-0.
- Benic, G. I., B. M. Eisner, R. E. Jung, T. Basler, D. Schneider und C. H. F. Hämmerle. 2019. „Veränderungen des Hartgewebes nach geführter Knochenregeneration von peri-implantären Defekten im Vergleich von Block- zu partikulären Knochenersatzmaterialien: 6-Monats-Ergebnisse einer randomisierten kontrollierten klinischen Studie.“ Clinical Oral Implants Research 30: 1016–1026. https://doi.org/10.1111/clr.13515.
- Benic, G. I., D. S. Thoma, F. Muñoz, I. S. Martin, R. E. Jung und C. H. F. Hämmerle. 2016. „Geführte Knochenregeneration von peri-implantären Defekten mit partikulären und blockförmigen xenogenen Knochenersatzmaterialien.“ Clinical Oral Implants Research 27, Nr. 5: 567–576. https://doi.org/10.1111/clr.12625.
- Benic, G. I., D. S. Thoma, I. Sanz-Martin, et al. 2017. „Geführte Knochenregeneration an Zirkonium- und Titan-Zahnimplantaten: Eine pilot-histologische Untersuchung.“ Clinical Oral Implants Research 28, Nr. 12: 1592–1599. https://doi.org/10.1111/clr.13030.
- Bressan, E., N. Ferrarese, M. Pramstraller, D. Lops, R. Farina und C. Tomasi. 2017. „Kammabmessungen des zahnlosen Unterkiefers im hinteren Sextanten: Eine Beobachtungsstudie zu Cone-Beam-Computertomographie-Radiographien.“ Implant Dentistry 26, Nr. 1: 66–72. https:// doi.org/10.1097/ID.0000000000000489.
- Camarda, A. J., R. Durand, M. Benkarim, P. H. Rompré, G. Guertin und H. Ciaburro. 2021. „Prospektive randomisierte klinische Studie zur Bewertung der Auswirkungen von zwei verschiedenen Implantatkragen-Designs auf die peri-implantäre Heilung und funktionale Osseointegration nach 25 Jahren.“ Clinical Oral Implants Research 32: 285–296. https://doi.org/10.1111/clr.13699.
- Cardaropoli, G., U. Lekholm und J. L. Wennström. 2006. „Gewebeveränderungen bei implantatgestützten Einzelzahnrekonstruktionen: Eine 1-jährige prospektive klinische Studie.“ Clinical Oral Implants Research 17, Nr. 2: 165–171. https://doi.org/10.1111/j.1600-0501.2005.01210.x.
- Farina, R., A. Simonelli, A. Baraldi, et al. 2021. „Zahnverlust bei konformen und nicht-konformen Parodontitis-Patienten mit unterschiedlichen parodontalen Risikostufen während der unterstützenden parodontalen Pflege.“ Clinical Oral Investigations 25, Nr. 10: 5897–5906. https://doi.org/10.1007/s00784-021-03895-8.
- Galindo-Moreno, P., A. León-Cano, A. Monje, I. Ortega-Oller, F. O'Valle und A. Catena. 2016. „Die Höhe des Abutments beeinflusst die Wirkung des Plattformwechsels auf den peri-implantären marginalen Knochenverlust.“ Clinical Oral Implants Research 27, Nr. 2: 167–173. https://doi.org/10.1111/clr.12554.
- Gallucci, G. O., A. Hamilton, W. Zhou, D. Buser und S. Chen. 2018. „Implantatplatzierungs- und Ladeprotokolle bei teilweise zahnlosen Patienten: Eine systematische Übersicht.“ Clinical Oral Implants Research 29, Nr. Suppl 16: 106–134. https://doi.org/10.1111/clr.13276.
- Ghaly, M., D. Tarrazzi, V. Xia, S. Tharrington und T. R. Schoenbaum. 2023. „Änderungen des peri-implantären marginalen Knochenlevels nach Kieferort: Eine systematische Übersicht und Metaanalyse von 4970 Implantaten.“ Journal of Oral Implantology 49, Nr. 4: 444–455. https://doi.org/10.1563/aaid-joi-D-22-00252.
- Herrera, D., T. Berglundh, F. Schwarz, et al. 2023. „Prävention und Behandlung von peri-implantären Erkrankungen – Die EFP S3 Level klinische Praxisleitlinie.“ Journal of Clinical Periodontology 50, Nr. Suppl 26: 4–76. https://doi.org/10.1111/jcpe.13823.
- Jensen, S. S., T. Aghaloo, R. E. Jung, et al. 2023. „Gruppenbericht 1 ITI Konsens: Die Rolle der Knochendimensionen und der Verfahren zur Weichgewebeaugmentation auf die Stabilität klinischer, radiografischer und patientenberichteter Ergebnisse der Implantatbehandlung.“ Clinical Oral Implants Research 34, Nr. Suppl 26: 43–49. https://doi.org/10.1111/clr.14154.
- Jung, R. E., M. Herzog, K. Wolleb, C. F. Ramel, D. S. Thoma und C. H. F. Hämmerle. 2017. „Eine randomisierte kontrollierte klinische Studie zum Vergleich kleiner buccaler Dehiszenzdefekte um Zahnimplantate, die mit geführter Knochenregeneration behandelt oder zur spontanen Heilung belassen wurden.“ Clinical Oral Implants Research 28, Nr. 3: 348–354. https://doi.org/10.1111/clr.12806.
- Laass, A., B. M. Eisner, C. H. F. Hämmerle, R. E. Jung, D. S. Thoma und G. I. Benic. 2020. „Histologische Ergebnisse nach geführter Knochenregeneration von peri-implantären Defekten im Vergleich von individuell geformten Blöcken zu partikulären Knochenersatzmaterialien.“ International Journal of Periodontics and Restorative Dentistry 40, Nr. 4: 519–527. https://doi.org/10.11607/prd.4575.
- Linkevicius, T., A. Puisys, L. Linkeviciene, V. Peciuliene und M. Schlee. 2015. „Krestale Knochensicherheit um Implantate mit horizontal passender Verbindung nach Weichgewebedickung: Eine prospektive klinische Studie.“ Clinical Implant Dentistry and Related Research 17, Nr. 3: 497–508. https://doi.org/10.1111/cid.12155.
- Linkevicius, T., A. Puisys, R. Linkevicius, J. Alkimavicius, E. Gineviciute und L. Linkeviciene. 2020. „Der Einfluss des submukösen Heilungsabutments oder der subkrestalen Implantatplatzierung auf die Weichgewebedicke und die Stabilität des krestalen Knochens. Eine 2-jährige randomisierte klinische Studie.“ Clinical Implant Dentistry and Related Research 22, Nr. 4: 497–506. https://doi.org/10.1111/cid.12903.
- Maia, L. P., D. M. Reino, V. A. Muglia, et al. 2015. „Einfluss der Dicke des parodontalen Gewebes auf die Remodellierung der buccalen Platte bei sofortigen Implantaten mit Xenograft.“ Journal of Clinical Periodontology 42: 590–598. https:// doi.org/10.1111/jcpe.12405.
- Merheb, J., M. Vercruyssen, W. Coucke, L. Beckers, W. Teughels und M. Quirynen. 2017. „Das Schicksal des buccalen Knochens um Zahnimplantate. Eine 12-monatige Nachbeobachtungsstudie nach der Belastung.“ Clinical Oral Implants Research 28, Nr. 1: 103–108. https://doi.org/10.1111/clr.12767.
- Mir-Mari, J., H. Wui, R. E. Jung, C. H. F. Hämmerle und G. I. Benic. 2016. „Einfluss der blinden Wundverschluss auf die Volumenstabilität verschiedener GBR-Materialien: Eine in-vitro Cone-Beam-Computertomographische Untersuchung.“ Clinical Oral Implants Research 27, Nr. 2: 258–265. https://doi.org/10.1111/clr.12590.
- Monje, A., V. Chappuis, F. Monje, et al. 2019. „Die kritische Dicke der peri-implantären buccalen Knochenwand neu betrachtet: Eine experimentelle Studie am Beagle-Hund.“ International Journal of Oral & Maxillofacial Implants 34, Nr. 6: 1328–1336. https://doi.org/10.11607/jomi.7657.
- Monje, A., A. Roccuzzo, D. Buser und H. L. Wang. 2023. „Einfluss der Dicke der buccalen Knochenwand auf die dimensionalen Veränderungen des peri-implantären harten und weichen Gewebes: Eine systematische Übersicht.“ Clinical Oral Implants Research 34, Nr. 3: 157–176. https://doi.org/10.1111/clr.14029.
- Nobuto, T., F. Suwa, T. Kono, et al. 2005. „Mikrovaskuläre Reaktion im Periost nach mukoperiostalen Lappenoperationen bei Hunden: Angiogenese und Knochenresorption und -bildung.“ Journal of Periodontology 76, Nr. 8: 1346–1353. https://doi.org/10.1902/jop.2005.76.8.1346.
- Nomiyama, L. M., E. K. Matumoto, M. G. Corrêa, et al. 2022. „Vergleich zwischen flapless-geführter und konventioneller Chirurgie zur Implantatplatzierung: Eine 12-monatige randomisierte klinische Studie.“ Clinical Oral Investigations 27: 1665–1679. https://doi.org/10.1007/s00784-022-04793-3.
- Ortiz-Vigón, A., I. Suarez, S. Martínez-Villa, I. Sanz-Martín, J. Bollain und M. Sanz. 2017. „Sicherheit und Leistung eines neuartigen kollagenisierten xenogenen Knochenblocks zur lateralen Alveolarkammaugmentation für gestaffelte Implantatplatzierung.“ Clinical Oral Implants Research 29, Nr. 1: 36–45. https://doi.org/10.1111/clr.13036.
- Peker Tekdal, G., N. Bostanci, G. N. Belibasakis und A. Gürkan. 2016. „Der Einfluss der piezoelektrischen Chirurgie auf radiologische und molekulare Parameter des peri-implantären krestalen Knochenverlusts: Eine randomisierte, kontrollierte, split-mouth Studie.“ Clinical Oral Implants Research 27, Nr. 5: 535–544. https://doi.org/10.1111/clr.12620.
- Pramstraller, M., G. P. Schincaglia, R. Vecchiatini, R. Farina und L. Trombelli. 2018. „Dimensionen des Alveolarkamms in mandibulären hinteren Regionen: Eine retrospektive vergleichende Studie von zahntragenden und zahnlosen Stellen unter Verwendung von computertomographischen Daten.“ Surgical and Radiologic Anatomy 40, Nr. 12: 1419–1428. https://doi.org/10.1007/s00276-018-2095-0.
- Roccuzzo, A., J. C. Imber und S. S. Jensen. 2021. „Bedarf an lateraler Knochenaugmentation bei zwei schmalen Implantaten: Eine prospektive, kontrollierte klinische Studie.“ Clinical Oral Implants Research 32, Nr. 4: 511–520. https://doi.org/10.1111/clr.13721.
- Saleh, M. H. A., A. Ravidà, F. Suárez-López Del Amo, G. H. Lin, F. Asa'ad und H. L. Wang. 2018. „Der Einfluss der Position der Implantat-Abutment-Verbindung auf den krestalen Knochenverlust: Eine systematische Übersicht und Metaanalyse.“ Clinical Implant Dentistry and Related Research 20, Nr. 4: 617–633. https://doi.org/10.1111/cid.12600.
- Schwarz, F., D. Sahin, S. Civale-Schweighöfer und J. Becker. 2021. „Langzeitresultate nach lateraler Alveolarkammaugmentation mit einem kollagenisierten xenogenen Knochenblock: Eine Monozentrische, prospektive einarmige klinische Studie.“ International Journal of Implant Dentistry 7, Nr. 1: 9. https://doi.org/10.1186/s40729-021-00293-3.
- Schwarz, F., N. Sahm und J. Becker. 2012. „Auswirkungen des Ergebnisses der geführten Knochenregeneration bei Dehiszenztyp-Defekten auf die langfristige Stabilität der peri-implantären Gesundheit: Klinische Beobachtungen nach 4 Jahren.“ Clinical Oral Implants Research 23, Nr. 2: 191–196. https://doi.org/10.1111/j.1600-0501.2011.02214.x.