Auswirkungen der gleichzeitigen sofortigen Implantation und geführten Knochenrekonstruktion mit ultrafeinen Titanmesh-Membranen auf radiografische und klinische Parameter nach 18 Monaten Belastung
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Hintergrund: Ziel der vorliegenden prospektiven Fallserie war es, die Überlebensraten von Implantaten und Prothesen, Komplikationen und den marginalen Knochenverlust unter Verwendung einer ultrafeinen Titanmesh-Membran mit gleichzeitiger Implantation zu bewerten, um den für die geführte Knochenrekonstruktion von Alveolarknochendefekten erforderlichen Platz zu schaffen.
Materialien und Methoden: Patienten wurden zwischen März 2016 und Oktober 2017 in einer Privatklinik in Rom, Italien, rekrutiert und behandelt. Selbstschneidende konische Implantate wurden durch einen computergestützten, schablonengeführten Ansatz eingesetzt. Autogenes Knochenmaterial wurde allein über der freiliegenden Implantatoberfläche platziert und dann mit anorganischem bovinem Knochenmaterial vermischt. Schließlich wurde die Membran verbunden und geformt, um den Transplantationsbereich sicher einzuschließen, und die Heilungskappe wurde verbunden und auf den Höhenverbinder geschraubt. Die Ergebnisparameter waren: Implantat- und Prothesenversagen, biologische und mechanische Komplikationen, marginale und volumetrische Knochenstandänderungen, ästhetische Bewertung gemäß dem pink aesthetic score (PES).
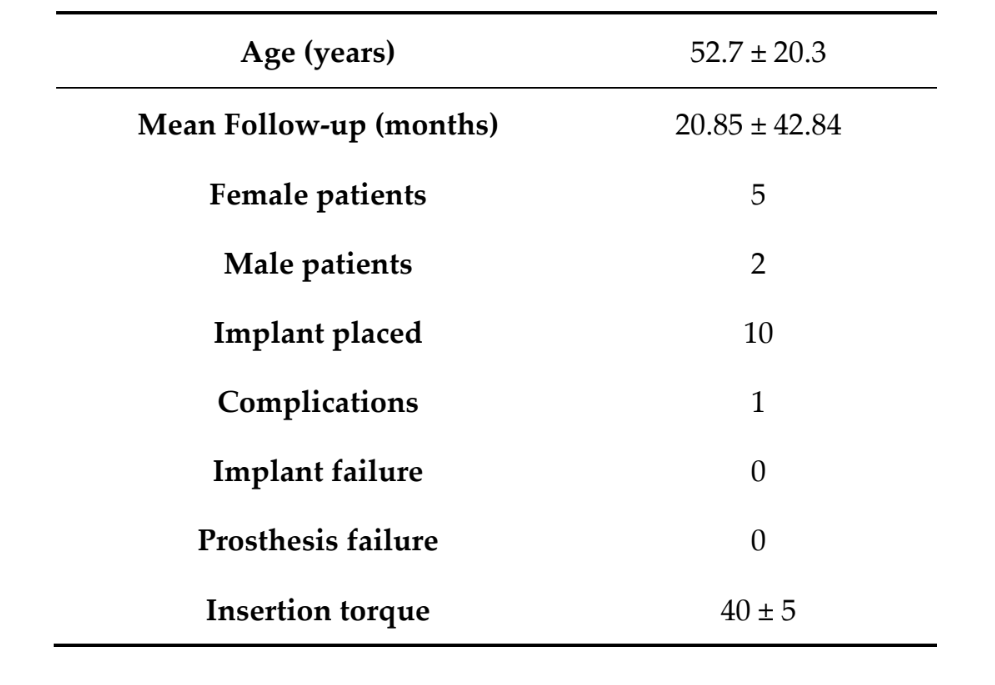
Ergebnisse: Insgesamt erhielten sieben Patienten (fünf Frauen, zwei Männer) mit einem Durchschnittsalter von 52,7 ± 20,3 Jahren (Bereich: 27–71) 10 selbstschneidende konische Implantate und eine gleichzeitige geführte Knochenregeneration mit ultrafeinen Titanmesh-Membranen. Während des gesamten Nachbeobachtungszeitraums gab es keine Implantat- und keine Prothesenversagen. Eine leichte Membranexposition wurde einen Monat nach der Implantation bei einem Patienten beobachtet. Der durchschnittliche marginale Knochenverlust (MBL) bei der Implantatbelastung betrug 0,13 ± 0,09 mm (95 % CI 0,08–0,19). Bei der Nachuntersuchung nach 18 Monaten betrug der durchschnittliche MBL 0,28 ± 0,33 mm (95 % CI 0,07–0,50). Der Unterschied war statistisch nicht signifikant (0,15 ± 0,31; 95 % CI 0,05–0,35; P = 0,1888). Die durchschnittliche horizontale Breite des Alveolarkamms betrug 3,72 ± 1,08 mm (95 % CI 3,22–4,22 mm). Bei der II-Phase-Chirurgie betrug die durchschnittliche Knochenbreite 8,79 ± 0,98 mm (95 % CI 8,51–9,07 mm). Der durchschnittliche Knochenzuwachs betrug 5,06 ± 1,13 mm (95 % CI 4,68–5,44 mm; P = 0,000). Das durchschnittliche Volumen des transplantierten Knochens, berechnet mit der Überlagerungstechnik, betrug 0,99 ± 0,38 CC (95 % CI 0,75–1,23 CC). Der durchschnittliche PES bei der Implantatbelastung betrug 8,2 ± 0,8 mm (95 % CI 7,7–8,7). Bei der Nachuntersuchung nach 18 Monaten betrug der durchschnittliche PES 12,0 ± 0,7 mm (95 % CI 11,5–12,5). Der Unterschied war statistisch signifikant (3,8 ± 0,4; 95 % CI 3,5–4,1; P = 0,0000).
Fazit: Mit der Einschränkung der vorliegenden prospektiven Studie scheint die geführte Knochenrekonstruktion unter Verwendung einer ultrafeinen Titanmesh-Membran mit gleichzeitiger Implantation gute und stabile Ergebnisse im Hinblick auf den Erfolg von Implantaten/Prothesen zu bieten. Weitere Forschungen mit längerer Nachbeobachtung und einer größeren Stichprobengröße sind erforderlich, um die Ergebnisse dieses vorläufigen Berichts zu bestätigen.
Einleitung
Die Atrophie des Alveolarknochens ist eine chronische und progressive klinische Situation, die durch einen moderaten bis schweren Verlust des Knochenvolumens aufgrund von Zahnverlust oder -extraktion gekennzeichnet ist. Darüber hinaus könnten lokale Bedingungen oder Krankheiten, wie traumatische Extraktionen, Parodontalerkrankungen und Traumata, diesen pathologischen Zustand verstärken, was die Platzierung von Zahnimplantaten sowohl aus funktioneller als auch aus ästhetischer Sicht schwierig oder ungünstig macht. Um diese möglichen Nachteile zu überwinden, wurden Techniken zur Knochenrekonstruktion eingeführt. Unter diesen ist die geführte Knochenregeneration (GBR) ein chirurgisches Verfahren, das ein Transplantatmaterial als Gerüst verwendet, das mit einer Membran isoliert und geschützt wird, um die nicht-osteogenen Zellen aus dem angrenzenden Bindegewebe fernzuhalten. Dadurch sollte der Barriereeffekt der Membran nur den osteogenen Zellen, die aus dem umgebenden Knochen und den Gefäßen stammen, erlauben, in den Knochendefekt einzudringen, was die Knochenbildung durch das Vorhandensein von stimulierenden Signalen ermöglicht.
Sowohl resorbierbare als auch nicht-resorbierbare Membranen wurden verwendet, um ein korrektes und geplantes biologisches Gerüst zu isolieren und aufrechtzuerhalten, das für die Bildung von neuem Knochengewebe erforderlich ist. Angesichts der Natur ihrer Funktion sollte die nicht-resorbierbare Membran vorhersehbarer und sicherer in der Anwendung sein. Das Hauptproblem besteht jedoch darin, dass eine zusätzliche Operation erforderlich ist, um die Membran zu entfernen. Dennoch wird die geführte Knochenrekonstruktion normalerweise in zwei Phasen oder mit einem submersen Implantatprotokoll durchgeführt, wenn sie in einer Phase durchgeführt wird. Daher könnte die Membran bei der Implantation oder in der zweiten Phase entfernt werden, wenn GBR zur gleichen Zeit wie das Implantat durchgeführt wurde.
In der täglichen Praxis könnten nicht-resorbierbare Membranen aus expandiertem Polytetrafluorethylen (e-PTFE) als erste Wahl bei der Rekonstruktion von horizontalen und vertikalen Knochendefekten betrachtet werden. Dennoch haben verschiedene Forscher seit den 1990er Jahren die klinische Anwendung von ultrafeinem Titan-Gitter (Ti-Gitter) zur Rekonstruktion des atrophen Unterkiefers und Oberkiefers untersucht. Titan ist widerstandsfähiger gegen Kollaps als e-PTFE und resorbierbare Membranen. Daher kann die Steifigkeit des Titans wie ein Gerüst wirken und den Raum für die Knochenregeneration aufrechterhalten, selbst in Fällen eines großen Knochendefekts, wie bei der vertikalen Knochenrekonstruktion.
Die Porosität der Ti-Maschen kann modifiziert werden, um eine bessere Gewebeintegration und -bildung zu erreichen. Die Variation der Porosität der Ti-Maschen ermöglicht es, Flüssigkeiten und Nährstoffe durch die Membran passieren zu lassen, während infiltrierende Zellen vermieden werden.
Heutzutage wurden verschiedene Formen von Ti-Maschenmembranen vorgeschlagen, um die Bildung neuen Knochens zu maximieren, die Transplantatmaterialien unter der Membran zu stabilisieren und das Risiko einer Membranexposition zu reduzieren, die zu einem Kollaps und/oder einem Einwachsen des benachbarten Weichgewebes führen kann.
Das Ziel der vorliegenden prospektiven Fallserie war es, die Überlebensraten von Implantaten und Prothesen, Komplikationen und den marginalen Knochenverlust zu bewerten, unter Verwendung einer ultrafeinen Titan-Maschenmembran und gleichzeitiger Implantation, um den notwendigen Platz für die Knochenaugmentation bei Alveolarknochendefekten zu gewährleisten. Diese Studie folgte den Bestimmungen der Stärkung der Berichterstattung über Beobachtungsstudien in der Epidemiologie (STROBE) Erklärung.
Materialien und Methoden
Diese Forschung wurde als Fallserie-Studie konzipiert, um die klinischen und radiografischen Ergebnisse der gleichzeitigen geführten Knochenrekonstruktion und Implantation mit ultrafeiner Titan-Maschenmembran zu bewerten. Patienten wurden zwischen März 2016 und Oktober 2017 in einer Privatklinik in Rom, Italien, rekrutiert und behandelt. Die chirurgischen Verfahren wurden von einem erfahrenen Kliniker (MT) durchgeführt, der 2013 in der implantatbasierten Therapie von der Europäischen Vereinigung für Osseointegration zertifiziert wurde. Alle Patienten wurden über die Natur der Studie informiert und gaben ihr schriftliches Einverständnis für chirurgische und prothetische Verfahren sowie für die Verwendung von radiologischen und klinischen Daten zur Veröffentlichung. Die Prinzipien der Helsinki-Deklaration von 2013 wurden strikt eingehalten. Darüber hinaus wurde das radiologische Protokoll vom Wissenschaftlichen Technischen und Ethikkomitee der Universität Sassari genehmigt (2069/CE).
Alle aufeinanderfolgenden Patienten im Alter von 18 Jahren oder älter, die mit partieller Edentulie des Ober- oder Unterkiefers vorstellig wurden, die in der Lage waren, ein informierte Einverständnis zu verstehen und zu unterschreiben, und die eine implantatgestützte Restauration benötigten, wurden als für diese Studie geeignet erachtet. Patienten wurden schließlich aufgenommen, wenn sie bei der Untersuchung mit der Cone-Beam-Computertomographie eine Atrophie des verbleibenden Alveolarkamms der Klassen IV bis VI nach Cawood und Howell aufwiesen. Patienten wurden ausgeschlossen, wenn sie allgemeine Kontraindikationen für die Implantatchirurgie aufwiesen (wie Bestrahlung des Kopf- und Halsbereichs innerhalb der fünf Jahre vor der Implantation oder unkontrollierter Diabetes); Schwangerschaft oder Stillzeit; Substanzmissbrauch; psychiatrische Therapie oder unrealistische Erwartungen; frühere oder laufende Behandlungen mit intravenösen Bisphosphonaten; unbehandelte Parodontitis oder schlechte Mundhygiene (Bluten bei der Sondierung und/oder Plaqueindex ≥ 25%); starke Raucher (≥11 Zigaretten/Tag); post-extraktive Stellen.
Vor der Implantatchirurgie wurde ein CBCT-Scan (CBCT, CRANEX 3D; Soredex, Tuusula, Finnland) und ein intraoraler digitaler Abdruck (CS 3600 intraoraler Scanner, Carestream Dental, Atlanta, GA, USA) angefertigt. Der CBCT-Scan wurde mit einem Sichtfeld von 80 mm × 150 mm; Voxelgröße von 0,3 µm; 90 KV; 6,3–10 mA für 4,5 s eingestellt, was zu einem Dosis-Flächen-Produkt von 579,7–920,2 (mGycm2) führte. Die STL- und DICOM-Daten (Digital Imaging and COmmunications in Medicine) wurden in eine spezielle Software für Diagnose und Implantatplanung (3Diagnosys Version 4.2, 3DIEMME srl, Cantù, Italien) importiert. Anschließend wurden prothetisch gesteuerte Implantate virtuell geplant.
Eine Stunde vor der Operation wurde prophylaktisch eine Einzeldosis Antibiotika (2 g Amoxicillin und Clavulansäure oder 600 mg Clindamycin bei Penicillinallergie) verabreicht. Eine 0,2%ige Chlorhexidin-Diglukonat-Mundspülung wurde zwei Minuten vor der Operation angewendet.
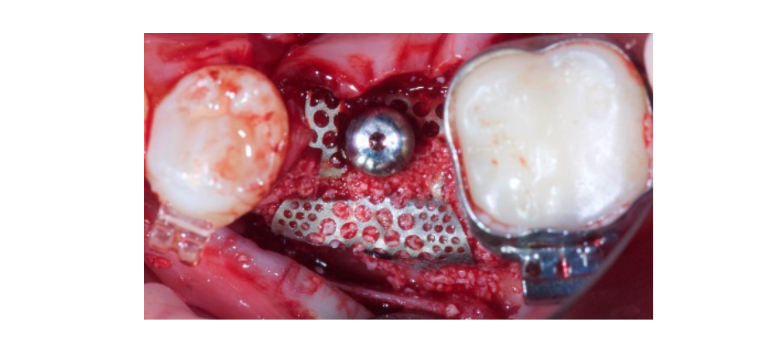
Alle Patienten wurden unter oraler Sedierung mit Diazepam 10 mg (Valium, Roche S.p.A., Monza, Italien) behandelt. Eine lokale Anästhesie mit Articain und Adrenalin 1:100.000 wurde verabreicht. Ein mittlerer Schnitt wurde in das keratinisierte Gewebe mit einem chirurgischen Skalpellblatt Nr. 15C gemacht. Ein Volldickenschlappen wurde über die mukogingivale Grenze angehoben. Dann wurden zwei vertikale Schnitte einen Zahn vom Knochendefekt entfernt oder mindestens 5 mm entfernt im Falle eines zahnlosen Bereichs. Anschließend wurde die Empfängerstelle gereinigt, indem alle Weichgewebereste entfernt wurden. Ein selbstschneidendes, konisches TSIII-Implantat (Osstem Implant, Seoul, Korea) wurde durch einen computergestützten, schablonengeführten Ansatz auf Knochenhöhe oder 1 mm tiefer gemäß dem vom Hersteller vorgeschlagenen Bohrprotokoll eingesetzt. Alle chirurgischen Schablonen waren zahngetragen und wurden ohne metallische Hülsen hergestellt. Das Hauptmerkmal der OssBuilder-Membran ist, dass sie in einem einstufigen Ansatz direkt am Implantat fixiert wird. Um die Membran am Implantat zu sichern, muss ein spezielles Werkzeug namens Höhenverbinder (Osstem Implant) verwendet werden. Dieses Werkzeug ist in verschiedenen Höhen erhältlich, um die Membran auf dem Implantat auf unterschiedlichen Ebenen je nach verbleibendem Knochen und Implantat-Tiefe zu verbinden. Mit einem 1,2 Hex-Antrieb wurde der Höhenverbinder mit einem Drehmoment von 5 bis 8 N·cm an das Implantat geschraubt. Anschließend wurde autogenes Knochenmaterial aus dem angrenzenden Bereich entnommen, unter Verwendung eines minimalinvasiven kortikalen Knochenkollektors (Micross, Meta, Italien). Der Knochen wurde im mesialen oder distalen Bereich in der Nähe des Defekts entnommen. Danach wurde der Knochendefekt gemessen, um die geeignete Form und Größe der Titan-Mesh-Membran (OssBuilder, Osstem Implant) zu bestimmen. Alle verwendeten Membranen bestanden aus reinem Titan der Klasse 2 und waren mit Poren von 0,6 bis 1 mm Durchmesser gestaltet.
Autogenes Knochenmaterial wurde allein über die freiliegende Implantatoberfläche platziert. Dann wurde eine zweite Schicht aus autogenem Knochen, gemischt mit anorganischem bovinem Knochenmaterial (Bio-OSS, Geistlich Biomaterials Italia S.r.l.) im Verhältnis 1:1, verwendet, um den verbleibenden Defekt zu decken. Der Knochenblock wurde überkonturiert, um die endgültige Resorption des Transplantats auszugleichen. Schließlich wurde die Membran mit dem Höhenverbinder verbunden und so geformt, dass sie den Transplantatsbereich sicher umschließt, und der Heilungskappen wurde angeschlossen und mit dem Cover Cap Driver bei 5 bis 8 N·cm auf den Höhenverbinder geschraubt. Ein periostaler Schnitt wurde gemacht, um eine passive, spannungsfreie Anpassung und Schließung des Lappens zu ermöglichen. Die Wunde wurde in zwei Schichten mit einer 4-0 Polyglactin 910 Naht (Vicryl V271; Ethicon, West Somerville, NJ, USA) genäht (Abbildungen 1–3). Eine antibiotische Behandlung wurde für sieben Tage (1 g Amoxicillin und Clavulansäure oder 300 mg Clindamycin zweimal täglich) nach der Operation verordnet. Eine 0,2% Chlorhexidin-Digluconat Mundspülung wurde für eine Minute, zweimal täglich, für drei Wochen verschrieben, und eine weiche Diät wurde für vier Wochen empfohlen. Ibuprofen 400 mg (oder Paracetamol 1 g) sollte im Falle von Schmerzen eingenommen werden.
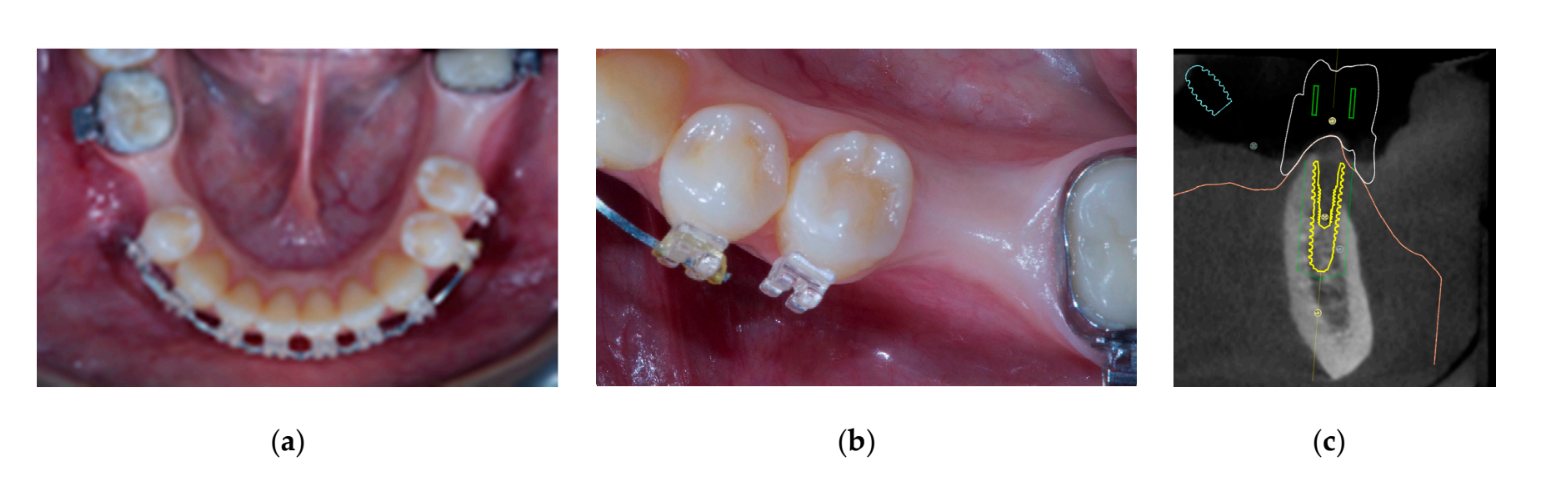
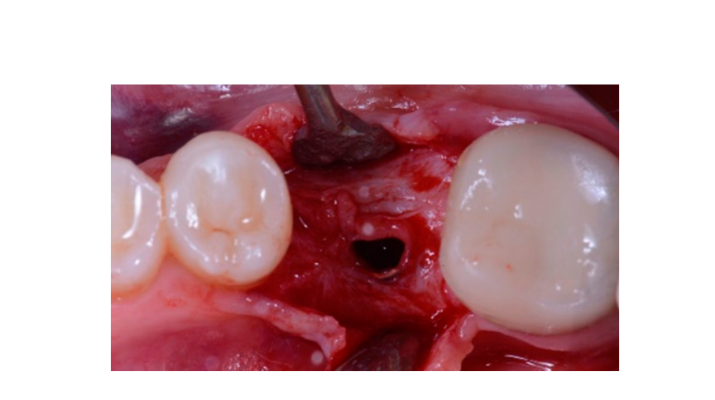
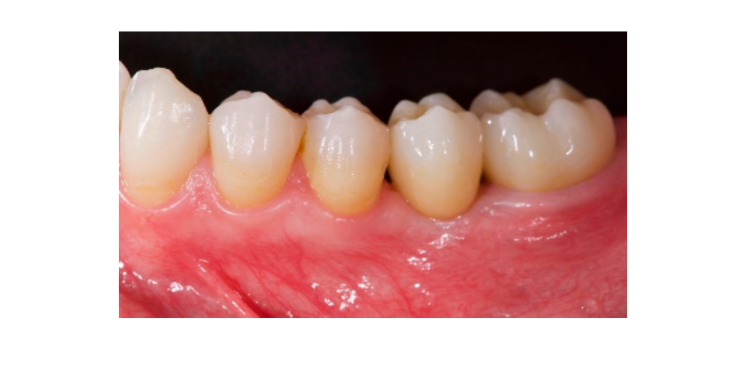
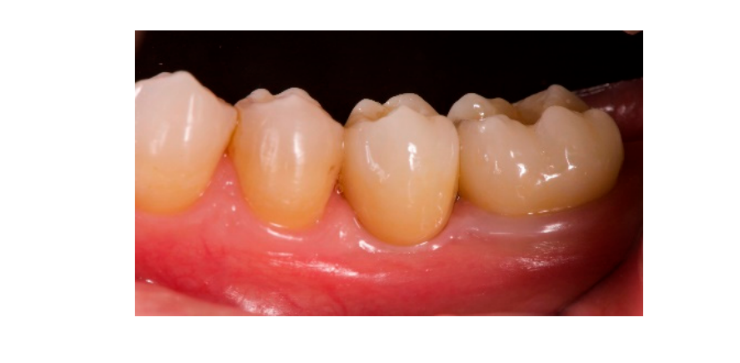
Sieben bis acht Monate nach der Implantation wurde beim Patienten ein zweiter CBCT-Scan durchgeführt, um die Knochenrekonstruktion zu bewerten. Der CBCT-Scan wurde mit einem Sichtfeld von 60 mm × 80 mm, einer Voxelgröße von 0,3 µm, 90 kV und 4–6,3 mA für 2,3 s eingestellt, was zu einem Dosis-Flächen-Produkt von 192,4–307,8 (mGycm2) führte. Anschließend wurde ein chirurgischer Eingriff in der zweiten Phase durchgeführt, wobei darauf geachtet wurde, das verhorntes Gewebe um das Zahnimplantat zu erhalten. Das ultrafeine Titannetz wurde sorgfältig entfernt und ein Heilungsabutment wurde auf das Implantat geschraubt (Abbildung 4). Eine plättchenreiche Fibrinmembran (PRF) wurde dann über dem rekonstruierten Knochen angepasst und der Lappen wurde koronale gezogen und genäht. Zwei Wochen später wurde eine provisorische Restauration bereitgestellt. Drei bis vier Monate später wurde eine CAD/CAM schraubengehaltene Zirkonrestauration geliefert (Abbildungen 5 und 6). Der Biss wurde angepasst, um vorzeitige Kontakte zu vermeiden. Periapikale Röntgenaufnahmen und klinische Fotografien wurden gemacht. Nachsorgeuntersuchungen wurden alle drei Monate nach der Implantation geplant (Abbildungen 7 und 8).
Ergebnisse Maßnahmen umfassten:
- Implantatüberlebensrate: Ein Implantat wurde als gescheitert angesehen, wenn es eine Mobilität, Implantatfraktur oder eine Infektion aufwies, die eine Entfernung des Implantats erforderte.
- Eine Restauration wurde als gescheitert angesehen, wenn sie durch eine alternative Restauration ersetzt werden musste.
- Vorhandensein von biologischen (Schmerzen, Schwellungen, Eiterbildung usw.) oder mechanischen (Schraubenlockerung oder Bruch des Gerüsts und/oder des Verblendmaterials usw.) Komplikationen.
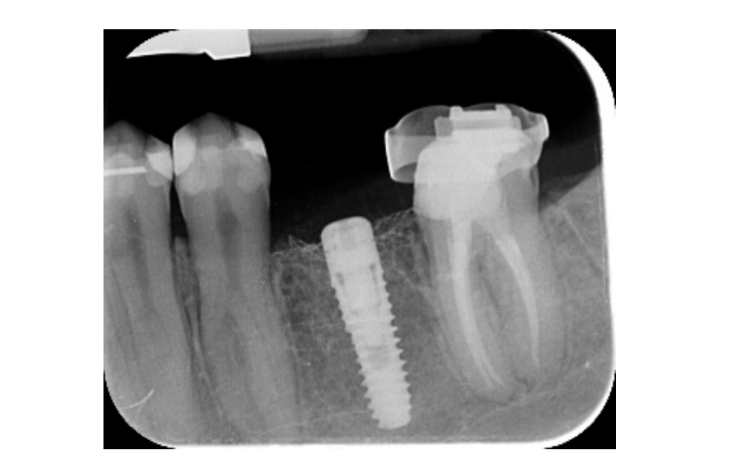
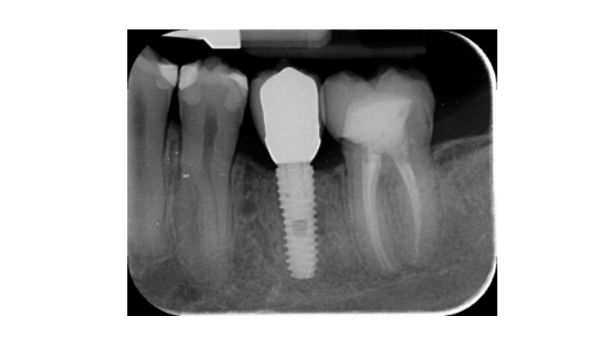
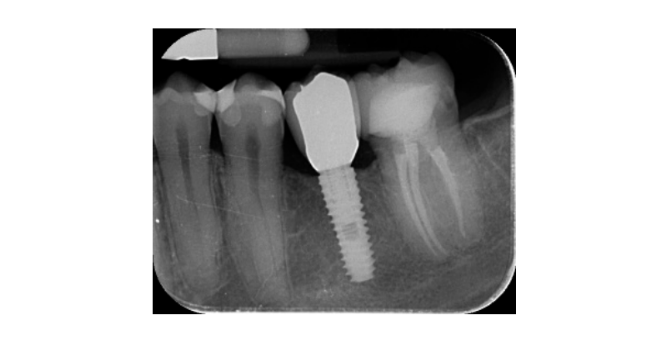
- Änderungen des marginalen Knochenlevels wurden durch digitale periapikale Röntgenaufnahmen (Digora Optime; Soredex, Tuusula, Finnland) unter Verwendung der parallelen Technik und handelsüblichen Filmhaltern bewertet. Es wurden drei Zeitpunkte bewertet: bei der Implantation (Basislinie), unmittelbar nach dem Einsetzen der Restauration und ein Jahr nach der Belastung. Die durchschnittlichen mesialen und distalen Abstände vom koronalsten Rand des Implantats bis zum ersten Knochen-zu-Implantat-Kontakt wurden auf die nächste 0,01 mm gemessen und als marginales Knochenlevel genommen. Der Unterschied in den Levels zwischen den Zeitpunkten wurde als marginaler Knochenverlust (MBL) betrachtet.
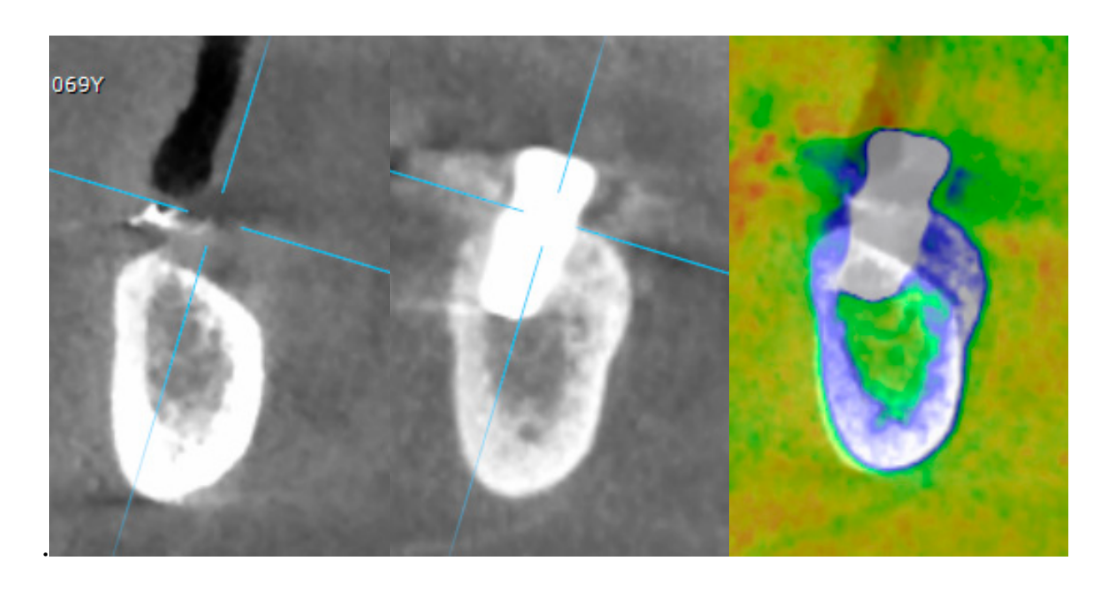
- Die horizontale Knochenaugmentation wurde anhand der CBCT-Scans 1 mm unter dem ursprünglichen Knochenkamm bewertet. Die volumetrischen Daten wurden unter Verwendung der benachbarten Zähne als Referenzpunkte übereinandergelegt, und ein neu generierter Satz von DICOM-Daten wurde als separate Dateien gespeichert. Messungen wurden vor und nach der Behandlung vorgenommen, und der Unterschied dieser beiden Messungen wurde als horizontale Knochenaugmentation betrachtet (Abbildung 9).
- Volumetrische Messungen des rekonstruierten Knochens wurden automatisch auf dem zusammengeführten CBCT-Satz volumetrischer Daten durchgeführt, unter Verwendung des Fusion-Moduls der OnDemand 3D-Software (Cybermed Inc., Seoul, Korea), gemäß einem zuvor veröffentlichten Protokoll [8].
- Die ästhetische Bewertung wurde gemäß dem pink aesthetic score (PES) auf den vestibulären und okklusalen Bildern durchgeführt, die mindestens einen benachbarten Zahn pro Seite enthielten. Die Werte wurden 6 und 12 Monate nach der Belastung bei Nachuntersuchungen (18 Monate Nachverfolgung) bewertet. Sieben Variablen (mesiale Papille, distale Papille, Weichgewebsniveau, Weichgewebskontur, Defizienz des alveolären Prozesses, Weichgewebsfarbe und -textur) wurden mit einer 2-1-0-Bewertung (2 ist am besten und 0 ist am schlechtesten) vom selben blinden Zahnarzt bewertet.
Die Implantat- und prothetischen chirurgischen Raten sowie Komplikationen wurden von denselben Klinikern bewertet, die alle Fälle durchgeführt haben (MT). Der marginale Knochenverlust und der pinke ästhetische Score wurden von einem unabhängigen Gutachter bewertet, der zuvor nicht an der Studie beteiligt war (MM). Eine deskriptive Analyse wurde für den Mittelwert ± Standardabweichung (SD), Median und 95%-Konfidenzintervall (CI) unter Verwendung von Numbers (Version 5.2) für Mac OS High Sierra 10.X durchgeführt. Vergleiche zwischen den Nachuntersuchungen wurden mit einem gepaarten Student-t-Test unter Verwendung von SPSS (Version 22.0; IBM Corporation, Armonk, NY, USA) für Mac OS High Sierra 10.X angestellt. Alle statistischen Vergleiche wurden auf einem Signifikanzniveau von 0,05 durchgeführt. Die statistische Einheit war das Implantat.
Ergebnisse
Insgesamt erhielten sieben Patienten (fünf Frauen, zwei Männer) mit einem Durchschnittsalter von 52,7 ± 20,3 Jahren (Spanne: 27–71) 10 selbstschneidende konische TSIII-Implantate (Osstem Implant) und gleichzeitig eine geführte Knochenregeneration mit ultrafeinen Titanmesh-Membranen (OssBuilder; Osstem Implant). 18 Monate nach der Belastung gab es keine Patienten, die ausfielen, und es trat keine Abweichung vom ursprünglichen Protokoll auf. Die durchschnittliche Nachbeobachtungszeit betrug 20,85 ± 42,84 Monate nach der Implantation (Spanne: 18–24 Monate). Alle Implantate wurden mit Drehmomenten zwischen 35 und 45 N·cm unter Verwendung eines computerbasierten, schablonengeführten Ansatzes eingesetzt (Tabelle 1).
Während des Nachbeobachtungszeitraums sind keine Implantate und keine Prothesen ausgefallen. Ein leichtes Membranexposition wurde einen Monat nach der Implantation bei einem Patienten beobachtet. Die Patienten wurden angewiesen, die Membran vorsichtig mit einer weichen Zahnbürste zu putzen und zweimal täglich Chlorhexidin-Spray anzuwenden. Vier Wochen später wurde eine vollständige Heilung des Weichgewebes beobachtet.
Alle Implantate wurden auf Knochenhöhe oder 1 mm tiefer gesetzt. Der durchschnittliche marginale Knochenverlust bei der Implantatbelastung betrug 0,13 ± 0,09 mm (95% CI 0,08–0,19). Bei der Nachuntersuchung nach 18 Monaten betrug der durchschnittliche marginale Knochenverlust 0,28 ± 0,33 mm (95% CI 0,07–0,50). Der Unterschied war statistisch nicht signifikant (0,15 ± 0,31; 95% CI 0,05–0,35; P = 0,1888) (Tabelle 2).

Die durchschnittliche horizontale Alveolarkammweite betrug 3,72 ± 1,08 mm (95% CI 3,22–4,22 mm). Bei der II. Stufe der Operation betrug die durchschnittliche Knochenbreite 8,79 ± 0,98 mm (95% CI 8,51–9,07 mm). Der durchschnittliche Knochenzuwachs betrug 5,06 ± 1,13 mm (95% CI 4,68–5,44 mm; P = 0,000). Das durchschnittliche Volumen des transplantierten Knochens, berechnet mit der Überlagerungstechnik, betrug 0,99 ± 0,38 CC (95% CI 0,75–1,23 CC).
Der durchschnittliche PES bei Implantatbelastung betrug 8,2 ± 0,8 mm (95% CI 7,7–8,7). Bei der 18-monatigen Nachuntersuchung betrug der durchschnittliche PES 12,0 ± 0,7 mm (95% CI 11,5–12,5). Der Unterschied war statistisch signifikant (3,8 ± 0,4; 95% CI 3,5–4,1; P = 0,0000) (Tabelle 2).
Diskussion
Die vorliegende Forschung wurde durchgeführt, um klinische und radiologische Daten ein Jahr nach der Belastung einer geführten Knochenregeneration unter Verwendung einer ultrafeinen Titanmaschenmembran mit gleichzeitiger Implantation zu bewerten, um einen Gerüsteffekt (Raumhaltung) zu bieten, der notwendig ist, um die Knochenrekonstruktion von crestalen Knochendefekten zu ermöglichen. Da diese Forschung als prospektive Fallserienstudie konzipiert wurde, besteht ihre Hauptbeschränkung im Fehlen einer Kontrollgruppe. Die Hauptbeschränkung der vorliegenden Studie war die kleine Stichprobengröße. Dennoch wurde diese Forschung als prospektive Fallserienstudie konzipiert. Diese Einschränkung könnte durch die Durchführung weiterer Studien mit größeren Stichprobengrößen behoben werden, die auf den vorläufigen Ergebnissen der vorliegenden Studie basieren könnten. Eine weitere Einschränkung dieser Studie, die einen Störfaktor darstellen könnte, war, dass der gingivale Biotyp nicht berücksichtigt wurde. Dennoch stimmten die Ergebnisse der vorliegenden Studie mit zuvor veröffentlichten Berichten überein. Tatsächlich unterstützten mehrere Forscher die idealen mechanischen Eigenschaften des Ti-Mesh in Bezug auf Steifigkeit, Plastizität und Elastizität. Darüber hinaus scheint Ti-Mesh weniger anfällig für bakterielle Kontamination zu sein, im Vergleich zu resorbierbaren Materialien. Um dieses Konzept zu unterstreichen, beobachteten die Autoren nur eine leichte Membranexposition einen Monat nach der Implantation. Die Patienten wurden angewiesen, die Membran vorsichtig mit einer weichen Zahnbürste zu putzen und zweimal täglich Chlorhexidinspray anzuwenden. Eine vollständige Heilung des Weichgewebes wurde vier Wochen später beobachtet. Diese geringfügige Komplikation deutet auf die Wirksamkeit dieses Titanmischs hin. Darüber hinaus gab es in dieser prospektiven Studie während des Nachbeobachtungszeitraums keine fehlgeschlagenen Implantate und keine Prothesen. Dank dieser Daten ist es vernünftig, dieses Verfahren als sicher und einfach für den Kliniker zu betrachten. Mehrere Eigenschaften von Barriere-Membranen sind für eine erfolgreiche geführte Knochenrekonstruktion notwendig, wie klinische Handhabbarkeit, Biokompatibilität, Fähigkeit zur Raumgestaltung, Zellexklusion und Gewebeintegration. Ti-Maschen sind nicht-resorbierbare Membranen, und ihre Porosität kann variiert werden, um Gewebeverträglichkeit zu erreichen. In der vorliegenden Studie wurde eine ultrafeine Membran aus reinem Titan der Klasse 2 verwendet. Die Dicke des Titanmischs betrug 100 µm, während die Porosität 0,6 bis 1 mm Durchmesser betrug. Die Poren mit einem Durchmesser von 1 mm können eine optimale Blutversorgung und Diffusion von Wachstumsfaktoren bieten, die notwendig sind, um die Heilung und Knochenregeneration zu fördern. Poren mit einem Durchmesser von 0,6 mm können jedoch das Verschieben oder die Migration des Knochenmaterialtransplantats verhindern, während sie die Diffusion der Blutversorgung ermöglichen. Darüber hinaus wiesen diese Membranen einige seitliche Perforationen auf, die in der Lage sein sollten, eine hohe mechanische Festigkeit aufrechtzuerhalten, während sie gleichzeitig Flexibilität für Formung und Modifikation ermöglichen.
Dennoch sind Membranexposition und Infektionen relativ häufig. Im Gegensatz zur PTFE-Membran, die relativ dick ist, etwa 200 µm, und aufgrund ihrer porösen Struktur anfällig für bakterielle Einschluss ist, kann Titan in einer dünneren Form hergestellt werden.
In letzter Zeit ist bekannt, dass ultrafeine Oberflächenmuster, die mit Poren, Kanälen und anderen Merkmalen in Bioscaffolds verbunden sind, die Zellmigration, Proliferation und Differenzierung beeinflussen. Daher ist die Laserverarbeitungstechnologie vorteilhaft, um eine Vielzahl von ultrafeinen Oberflächenmustern zu erstellen.
Um eine gute und vorhersehbare Knochenregeneration zu erreichen, sollte der Knochenersatz drei Eigenschaften aufweisen:
(1) Osteoblasten oder mesenchymale Stammzellen; (2) Wachstumsfaktoren, um den Regenerationsprozess sicherzustellen; und (3) Ein „Skelett“, das mechanische Unterstützung für die Zelladhäsion und -proliferation bieten kann.
Die Autoren vermuteten, dass diese ultrafeine Struktur, die in dieser prospektiven Studie verwendet wurde, die Minimierung des Weichgewebeeinwuchses in die Mikroperforation ermöglicht und die Durchlässigkeit von Nährstoffen oder Gewebeflüssigkeit über die Membran aufrechterhält, was die Anheftung, Migration und Proliferation von aus dem Knochenmark stammenden Zellen fördern würde, was zu einer besseren Knochenregeneration führt.
Im letzten Jahrzehnt haben Langzeitstudien bewertet und unterstrichen, dass GBR eine erfolgreiche und vorhersehbare Technik für den Kliniker ist, um eine vertikale und horizontale Kammaugmentation zu erreichen. GBR kann mit zwei verschiedenen Ansätzen erreicht werden: der Anwendung entweder einer polytetrafluorethylen (PTFE) titangestützten Membran (d.h. einer nicht resorbierbaren Membran) und einem ultrafeinen Titannetz oder einer Kollagenmembran (d.h. einer resorbierbaren Membran). Implantate wurden unter Verwendung eines computergestützten, schablonengeführten Ansatzes auf Knochenhöhe oder 1 mm tiefer gemäß dem vom Hersteller vorgeschlagenen Bohrprotokoll platziert. Unserer Meinung nach ermöglicht dieser geführte Ansatz eine bessere prothetisch gesteuerte Implantatinsertion und erlaubt die Knochenregeneration gemäß der benötigten Prothese.
Die Ergebnisse der vorliegenden Studie stimmen mit der aktuellen Literatur überein, die über Implantate berichtet, die nach oder während des GBR-Verfahrens platziert wurden.
Schlussfolgerungen
Mit der Einschränkung der vorliegenden prospektiven Studie scheint die geführte Knochenrekonstruktion unter Verwendung einer ultrafeinen Titannetzmembran mit gleichzeitiger Implantatplatzierung, um den notwendigen Platz für die Knochenaugmentation von alveolären Knochendefekten zu erhalten, den Erfolg von Implantat/Prothese zu gewährleisten. Weitere Forschungen mit einer größeren Stichprobengröße und längeren Nachbeobachtungszeiten sind erforderlich, um diese vorläufigen Ergebnisse zu bestätigen.
Marco Tallarico, Francesco Mattia Ceruso, Leonardo Muzzi, Silvio Mario Meloni, Yong-Jin Kim, Marco Gargari und Matteo Martinolli
Referenzen
- Atwood, D.A. Reduktion der Residualränder: eine bedeutende orale Krankheitsentität. J. Prosthet. Dent. 1971, 26, 266–279.
- Chiapasco, M.; Casentini, P.; Zaniboni, M. Knochenaufbauverfahren in der Implantatdentistry. Int. J. Oral Implant. 2009, 24, 237–259.
- Rakhmatia, Y.D.; Jinno, Y.; Furuhashi, A.; Koyano, K.; Ayukawa, Y. Mikro-Computertomographie-Analyse der frühen Knochenheilung unter Verwendung von mikroporösem Titan-Gitter für die geführte Knochenregeneration: Vorläufiges Experiment in einem Hundemodell. Odontology 2017, 8, 25–417.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Einphasige horizontale geführte Knochenregeneration mit autologem Knochen, anorganischem Rinderknochen und Kollagenmembranen: Nachverfolgung einer prospektiven Studie 30 Monate nach der Belastung. Eur. J. Oral Implantol. 2018, 11, 89–95.
- Becker, W.; Becker, B.; Mellonig, J. Eine prospektive multizentrische Studie zur Bewertung der parodontalen Regeneration bei Klasse II Furkationsinvasionen und infrabony Defekten nach Behandlung mit einer bioabsorbierbaren Barrieremembran: 1-Jahres-Ergebnisse. J. Periodontol. 1996, 67, 641–649.
- Zitzmann, N.U.; Naef, R.; Scharer, P. Resorbierbare versus nicht-resorbierbare Membranen in Kombination mit Bio-Oss für die geführte Knochenregeneration. Int. J. Oral Maxillofac. Implants 1997, 12, 844–852.
- Merli, M.; Moscatelli, M.; Mariotti, G.; Rotundo, R.; Bernardelli, F.; Nieri, M. Variation des Knochenlevels nach vertikaler Kammaugmentation: resorbierbare Barrieren versus titanverstärkte Barrieren. Eine 6-jährige doppelblinde randomisierte klinische Studie. Int. J. Oral Maxillofac. Implants 2014, 29, 905–913.
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Canullo, L.; Pisano, M.; Tallarico, M. Horizontale Kammaugmentation unter Verwendung von GBR mit einer nativen Kollagenmembran und einem Verhältnis von 1:1 von partikuliertem Xenograft und autologem Knochen: Eine 1-jährige prospektive klinische Studie. Clin. Implant Dent. Relat. Res. 2017, 19, 38–45.
- Sottosanti, J.S. Calciumsulfat: eine wertvolle Ergänzung zum Implantat-/Knochenregenerationskomplex. Dent. Implant. Updat. 1997, 8, 25–29.
- Roccuzzo, M.; Ramieri, G.; Spada, M.C.; Bianchi, S.D.; Berrone, S. Vertikale alveoläre Kammaugmentation mittels eines Titan-Gitters und autogenen Knochenimplantaten. Clin. Oral Implant. 2004, 15, 73–81.
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Aktuelle Barrieremembranen: Titan-Gitter und andere Membranen für die geführte Knochenregeneration in zahnmedizinischen Anwendungen. J. Prosthodont. 2013, 57, 3–14.
- Tallarico, M.; Martinolli, M.; Kim, Y.; Cocchi, F.; Meloni, S.M.; Alushi, A.; Xhanari, E. Genauigkeit der computerassistierten implantatgestützten Platzierung unter Verwendung von zwei verschiedenen chirurgischen Schablonen, die mit oder ohne metallische Hülsen entworfen wurden: Eine randomisierte kontrollierte Studie. Dent. J. 2019, 7, 41.
- Tallarico, M.; Kim, Y.J.; Cocchi, F.; Martinolli, M.; Meloni, S.M. Genauigkeit neu entwickelter schablonengestützter Vorlagen für die Einsetzung von Zahnimplantaten: Eine prospektive multizentrische klinische Studie. Clin. Implant Dent. Relat. Res. 2019, 21, 108–113.
- Fürhauser, R.; Florescu, D.; Benesch, T.; Haas, R.; Mailath, G.; Watzek, G. Bewertung des Weichgewebes um Einzelzahnimplantatkronen: der pink ästhetische Score. Clin. Oral Implant. 2005, 16, 639–644.
- Ciocca, L.; Lizio, G.; Baldissara, P.; Sambuco, A.; Scotti, R.; Corinadesi, G. Prothetisch CAD-CAM– geführte Knochenaugmentation atrophischer Kiefer unter Verwendung von maßgeschneidertem Titan-Gitter: Vorläufige Ergebnisse einer offenen prospektiven Studie. J. Oral Implant. 2018, 44, 131–137.
- Schopper, C.H.; Goriwoda, W.; Moser, D. Langzeitresultate nach geführter Knochenregeneration mit resorbierbaren und mikroporösen Titanmembranen. J. Oral Maxillofac. Surg. Clin. North Am. 2001, 13, 449–458.
- Scantlebury, T.V. 1982-1992: ein Jahrzehnt der Technologieentwicklung für die geführte Geweberegeneration. J. Periodontol. 1993, 64, 1129–1137.
- A Fugazzotto, P. Erfolgs- und Misserfolgsraten von osseointegrierten Implantaten in regeneriertem Knochen für 72 bis 133 Monate. Int. J. Oral Implant. 2005, 20, 77–83.
- Kim, Y.-K.; Yun, P.-Y.; Kim, S.-G.; Oh, D.S. In-vitro-Scanning-Elektronenmikroskopischer Vergleich der inneren Oberfläche von exponierten und nicht exponierten nicht-resorbierbaren Membranen. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2009, 107, e5–e11.
- Watzinger, F.; Luksch, J.; Millesi, W.; Schopper, C.; Neugebauer, J.; Moser, D.; Ewers, R. Geführte Knochenregeneration mit Titanmembranen: eine klinische Studie. Br. J. Oral Surg. 2000, 38, 312–315.
- Selvig, K.A.; Kersten, B.G.; Chamberlain, A.D.H.; Wikesjö, U.M.E.; Nilvúus, R.E. Regenerative Chirurgie intrabony parodontaler Defekte unter Verwendung von ePTFE-Barrièremembranen: Scanning-Elektronenmikroskopische Bewertung von entnommenen Membranen versus klinische Heilung. J. Periodontol. 1992, 63, 974–978.
- Hasegawa, H.; Masui, S.; Ishihata, H.; Kaneko, T.; Ishida, D.; Endo, M.; Kanno, C.; Yamazaki, M.; Kitabatake, T.; Utsunomiya, S.; et al. Bewertung einer neu gestalteten mikroperforierten reinen Titanmembran für die geführte Knochenregeneration. Int. J. Oral Maxillofac. Implants 2019, 34, 411–422.
- Roberts, E.W.; E Simmons, K.; Garetto, L.P.; A DeCastro, R. Knochenphysiologie und -stoffwechsel in der Zahnimplantologie: Risikofaktoren für Osteoporose und andere metabolische Knochenerkrankungen. Implant. Dent. 1992, 1, 11–21.
- Wessing, B.; Urban, I.; Montero, E.; Zechner, W.; Hof, M.; Chamorro, J.A.; Martin N.A.; Polizzi, G.; Meloni, S.; Sanz, M. Eine multizentrische randomisierte kontrollierte klinische Studie mit einer neuen resorbierbaren nicht quervernetzten Kollagenmembran für die geführte Knochenregeneration an dehiszierten Einzelimplantatstandorten: Zwischenresultate eines Knochenaugmentationsverfahrens. Clin. Oral Implants Res. 2017, 28, e218–e226, doi: 10.1111/clr.12995.
- Urban, I.; Wessing, B.; Alández, N.; Meloni, S.; González-Martin, O.; Polizzi, G.; Sanz-Sanchez, I.; Montero, E.; Zechner, W. Eine multizentrische randomisierte kontrollierte Studie mit einer neuartigen Kollagenmembran für die geführte Knochenregeneration an dehiszierten Einzelimplantatstandorten: Ergebnis bei prothetischer Lieferung und bei 1-Jahres-Nachverfolgung. Clin. Oral Implants Res. 2019, doi: 10.1111/clr.13426.