Beschichtung einer sandgestrahlten und säuregeätzten Implantatoberfläche mit einem pH-puffernden Mittel nach Vakuum-UV-Photofunktionalisierung
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ultraviolette (UV) Photofunktionalisierung kann die biologische Alterung von Titan nach der Vorbereitung und Lagerung von Zahnimplantaten zurücksetzen, indem hydrophobe Titanoberflächen in superhydrophile Oberflächen umgewandelt werden. Die Bildung von Blutgerinnseln um das Implantat kann den Heilungsprozess an der Knochen-Implantat-Grenze initialisieren und fördern. Ziel dieser Studie ist es, die Fähigkeiten der Oberflächenbenetzbarkeit und der Blutgerinnung von Implantaten mit einer konventionell sandgestrahlten und säuregeätzten Oberfläche (SA), einer sandgestrahlten und säuregeätzten Oberfläche mit Vakuum-UV-Behandlung (SA + VUV) und einer sandgestrahlten und säuregeätzten Oberfläche, die nach der Vakuum-UV-Behandlung mit einem pH-puffernden Mittel beschichtet wurde (SA + VUV + BS), zu bewerten und zu vergleichen. Statische und dynamische Tests zur Oberflächenbenetzbarkeit und Blutgerinnung wurden in vitro für SA + VUV und SA + VUV + BS (n = 5) durchgeführt, während die Hämostase, die aus der Blutgerinnung resultiert, in vivo für SA, SA + VUV und SA + VUV + BS (n = 4) bewertet wurde. Ein Kruskal-Wallis-Test zeigte statistisch signifikante Unterschiede (p < 0.05) in allen Tests, mit Ausnahme des in vitro-Tests der statischen Blutgerinnung. Die VUV-Behandlung ist daher effektiv, um eine SA-Oberfläche superhydrophil zu machen, als Alternative zur routinemäßigen UV-C-Bestrahlung. Die Zugabe eines pH-puffernden Mittels zu SA + VUV verbesserte ebenfalls die Oberflächenbenetzbarkeit und die Blutgerinnung, die entscheidend für eine erfolgreiche Osseointegration sind.
Einführung
Titan wird aufgrund seiner Biokompatibilität, Korrosionsbeständigkeit und mechanischen Eigenschaften häufig für zahnärztliche und orthopädische Restaurierungen und Rekonstruktionen verwendet. Titan oxidiert leicht und bildet eine dünne (1–5 nm), stabile und passive Schicht, die selbstlimitierend ist und die Oberfläche des Metalls vor weiterer Oxidation schützt. Diese Titandioxid (TiO2) Oberflächenschicht wird als verantwortlich für die effektive biologische Leistung angesehen, da sie den Transfer von Calcium- und Phosphorionen aus der Knochenmatrix innerhalb der TiO2 Schicht ermöglicht. Allerdings treten im Laufe der Zeit signifikante Reduktionen in der Osseointegration und anderen biologischen Fähigkeiten von Titan auf, da der Oberflächenkohlenstoff aufgrund einer unvermeidlichen Ablagerung von Kohlenstoff aus der Atmosphäre in Form von Kohlenwasserstoffen auf der TiO2 Schicht zunimmt. Dieses Phänomen wird als biologische Alterung von Titan definiert, und die Fähigkeit von Titanoberflächen, Proteine und osteogene Zellen anzuziehen, nimmt zeitabhängig ab. Eine weitere bemerkenswerte Veränderung der Titanoberflächen im Laufe der Zeit ist das Verschwinden der Hydrophilie. Unmittelbar nach der Verarbeitung weisen Titanoberflächen einen Kontaktwinkel von Wasser von 0 oder weniger als 5 Grad auf, und solche Oberflächen werden als superhydrophil bezeichnet. Dieses Merkmal nimmt allmählich ab und wird in 2 und 4 Wochen hydrophob, mit einem Kontaktwinkel von mehr als 40 bzw. 60 Grad.
Die Oberflächenbehandlung wird verwendet, um die Oberflächentopographie und -energie von Zahnimplantaten zu modifizieren, was zu einer verbesserten Benetzbarkeit, einer erhöhten Zellproliferation und -wachstum sowie einer beschleunigten Osseointegration führt. Die Oberflächenbehandlung kann durch eine additive oder subtraktive Technik erreicht werden. Die subtraktive Technik entfernt oder rauht eine Schicht des Kernmaterials auf, wie sie durch eine sandgestrahlte und säuregeätzte (SA) Oberfläche typifiziert ist. Bei der additiven Technik werden andere Materialien oder chemische Agenzien oberflächlich auf die Oberfläche des Titans durch Beschichtung aufgebracht, wie z.B. Titanplasma-Spritzbeschichtung, Hydroxylapatit-Beschichtung, Calciumphosphat-Beschichtung und andere biomimetische Beschichtungen. Das Bohren vor der Implantation verursacht, dass das Knochengewebe ein Trauma erleidet, das einem Bruch ähnelt. Der Bereich wird relativ hypoxisch, und der extrazelluläre pH-Wert wird sauer. Unter solchen Bedingungen zeigen mesenchymale Stammzellen des Knochenmarks eine reduzierte alkalische Phosphatase (ALP)-Aktivität und Kollagensynthese, die beide wichtig für die Knochenbildung und Osseointegration sind. Auch die Glykolyse und die DNA-Synthese von Osteoblasten sind unter sauren Bedingungen betroffen. Die Thrombozytenaggregation, die ein kritischer Schritt bei der Blutgerinnung oder Thrombogenese ist, wird ebenfalls durch extrazelluläre Azidose reduziert, vermittelt durch den Kalziumioneneintrittsweg. Die Bildung eines ausreichenden Blutgerinnsels bietet eine direkte und stabile Verbindung an der Knochen-zu-Implantat-Schnittstelle und spielt eine wichtige Rolle bei thrombogenen Reaktionen und Osseointegration. Darüber hinaus wurde eine Beziehung zwischen verschiedenen Implantatoberflächen und dem Ausmaß des Fibringerinnsels festgestellt.
In unserer vorherigen Studie wurde eine neuartige SA-Oberfläche vorgestellt, die nach der Vakuum-UV (VUV)-Behandlung mit einem pH-puffernden Mittel beschichtet wurde. Diese Oberfläche war eng mit einer höheren Affinität für Proteine, Zellen und Thrombozyten verbunden, was eine schnelle und stabile Blutgerinnung, Thrombogenese und Osseointegration förderte. Ziel der vorliegenden Studie war es, die Oberflächenbenetzbarkeit und die Blutgerinnungsfähigkeiten verschiedener Implantatoberflächen zu bewerten und zu vergleichen, einschließlich einer konventionellen SA-Oberfläche (SA), einer SA-Oberfläche mit VUV-Behandlung (SA + VUV) und einer SA-Oberfläche, die nach der VUV-Behandlung mit einem pH-puffernden Mittel beschichtet wurde (SA + VUV + BS), durch in vitro und in vivo Analysen.
Materialien und Methoden
2.1. Vorbereitung der Implantatbefestigungen
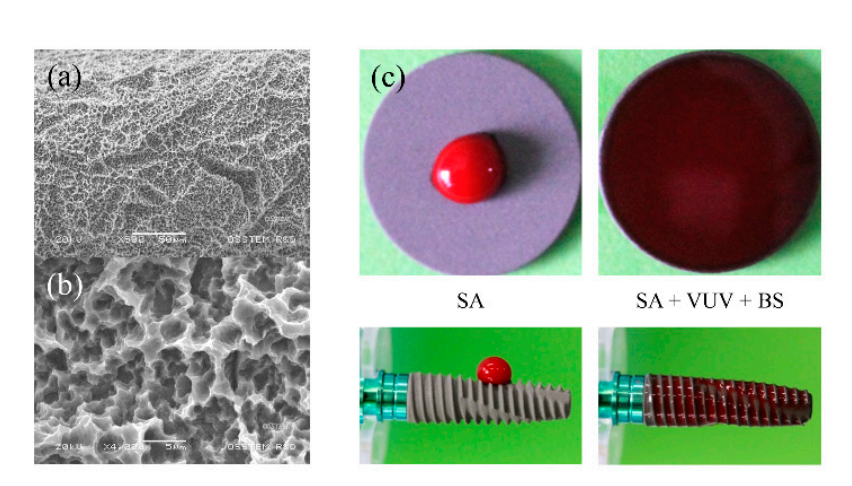
Die Implantatbefestigungen aus kommerziell reinem Titan (Grad IV) wurden als SA, SA + VUV (TS III SA, Osstem, Seoul, Korea) und SA + VUV + BS (TS III SOI, Osstem) für diese Studie vorbereitet. Wie in Abbildung 1a,b gezeigt, wurde die Oberflächenrauhigkeit der Implantatbefestigungen mit 2,5 ± 0,5 µm des Ra-Wertes gemessen, und die VUV-Behandlung zur Photofunktionalisierung wurde erreicht, indem eine Implantatbefestigung 1 Stunde lang UV-C und VUV in einem UV-Ozonreiniger ausgesetzt wurde, der von Niederdruckquecksilberdampflampen emittiert wurde. Die Beschichtung der Implantatoberfläche mit einem pH-puffernden Mittel, das sowohl positiv als auch negativ geladene ionische Gruppen umfasst und einen pKa-Wert von 7,31 bei 37°C aufweist, wurde zur Verbesserung der Superhydrophilität ergänzt (Abbildung 1c).
2.2. In Vitro Tests
2.2.1. Statische Oberflächenbenetzbarkeit
Heparinisiertes Schafblut wurde in eine 3,5 cm große Schale bis zu einer Tiefe von 2 bis 3 cm gefüllt. Implantatbefestigungen von SA + VUV und SA + VUV + BS (n = 5, jeweils) wurden bis zur obersten Unterbrechung der apikalen Gewinde in das Blut eingetaucht, und die Zeit bis zum Erreichen der Oberseite der Implantatbefestigung wurde aufgezeichnet, um die Benetzungsrate zu berechnen. Die Zeit wurde nicht von der Spitze der Implantatbefestigung gezählt, da die Anwesenheit der Unterbrechung der apikalen Gewinde dazu führte, dass die Blutaufnahme abrupt stoppte.
2.2.2. Dynamische Oberflächenbenetzbarkeit
Um die klinischen Situationen der Installation von Implantatbefestigungen zu simulieren, wurden Löcher in eine transparente Acrylplatte gebohrt, um die Sichtbarkeit zu sichern, gemäß dem Bohrprotokoll des Herstellers für harte Knochendichte unter Verwendung eines 122 Taper Kits (Osstem). Eine 130 µM Probe von defibriniertem Schafblut wurde in jedes Loch der Acrylplatte gegeben, und die Implantatbefestigungen von SA + VUV und SA + VUV + BS (n = 5, jeweils) wurden mit einem Druck-Zug-Messgerät (MX-500N, Imada Co., Tokio, Japan) mit einer Geschwindigkeit von 50 mm/min in das Loch eingetaucht, und die Zeiten, zu denen das Blut die 2 mm und 4 mm Punkte der zentralen Achse der Befestigung über der horizontalen Platte erreichte, wurden aufgezeichnet (Abbildung 2).

2.2.3. Statische Blutgerinnung
Die Implantatbefestigungen von SA + VUV und SA + VUV + BS, 11,5 mm lang mit 4,5 mm Durchmesser (n = 5, jeweils), wurden bis zu ihren Enden in eine 3,5 cm im Durchmesser große Schale mit 3 mL nicht-heparinisiertem Schafblut eingetaucht. Das Gewicht (g) des Blutgerinnsels um die Implantatbefestigung wurde nach 5 min, 7,5 min, 10 min und 12,5 min gemessen.
2.2.4. Dynamische Blutgerinnung
Dieses Modell für die aktive Blutgerinnung wurde entwickelt, um die kontinuierliche Blutversorgung durch Kapillaren zu simulieren. Die SA + VUV und SA + VUV + BS Implantatbefestigungen, die 10 mm lang und 4,0 mm im Durchmesser waren (n = 5), wurden mit einem voreingestellten Einfügedrehmoment von 5 N cm in ein modifiziertes Eppendorf-Röhrchen eingesetzt, das mit einer Spritzenpumpe verbunden war, die Schafblut, gemischt mit 1 IU/mL Heparin, bei 37°C von unten zuführte. Nach 30 Minuten Blutversorgung bei einer Infusionsrate von 0,05 mL/min wurden die Zeit (min), bis das Blut aufgrund der Blutgerinnung um die Implantatbefestigung aufhörte zu tropfen, und das Volumen (mL) des Blutes, das im darunterliegenden 15 mL Röhrchen unter dem Eppendorf-Röhrchen gesammelt wurde, gemessen.
2.3. In Vivo Test
Ein Beagle-Hund-Unterkiefermodell wurde verwendet. Alle Verfahren wurden mit der Genehmigung des Ethikkomitees für Tierversuche des Institutional Animal Care and Use Committee (CRONEX-IACUC 20191002; Cronex, Hwasung, Korea) gemäß den Richtlinien für die Tierversuchsforschung: Berichterstattung über In Vivo-Experimente (ARRIVE) durchgeführt.
Vier weibliche Beagles im Alter von 18 Monaten wurden unter allgemeiner Anästhesie einer bilateralen Extraktion ihrer mandibulären Prämolaren und des ersten Molaren unterzogen. Das Anästhesieprotokoll für alle chirurgischen Eingriffe umfasste eine intramuskuläre Injektion von 1 ml mit einer Dosis von 15 mg/kg Tiletamin/Zolazepam (Zoletil 50, Virbac, Seoul, Korea) und 5 mg/kg Xylazin (Rompun, Bayer Korea, Seoul, Korea). Nach der lokalen Anästhesie wurde ein vollschichtiges mukoperiostales Lappenpräparat neben den mandibulären Prämolaren und Molaren angelegt (Abbildung 3). Die Zähne wurden unter reichlicher Spülung mit einem kleinen Fissurbur hemisiziert. Die Extraktionen wurden mit Hebeln und Zangen durchgeführt. Die Lappen wurden mit einzelnen unterbrochenen Nähten verschlossen. Das postoperative Pflegeprotokoll umfasste Antibiotika und Schmerzmanagement. Während dieses Zeitraums wurden alle Hunde mit einer weichen Diät und Wasser ad libitum versorgt.
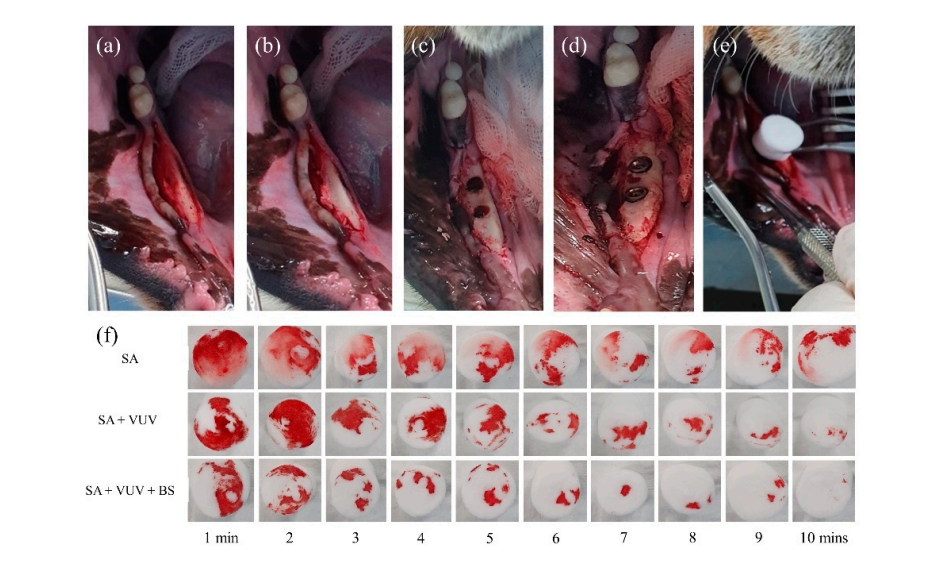
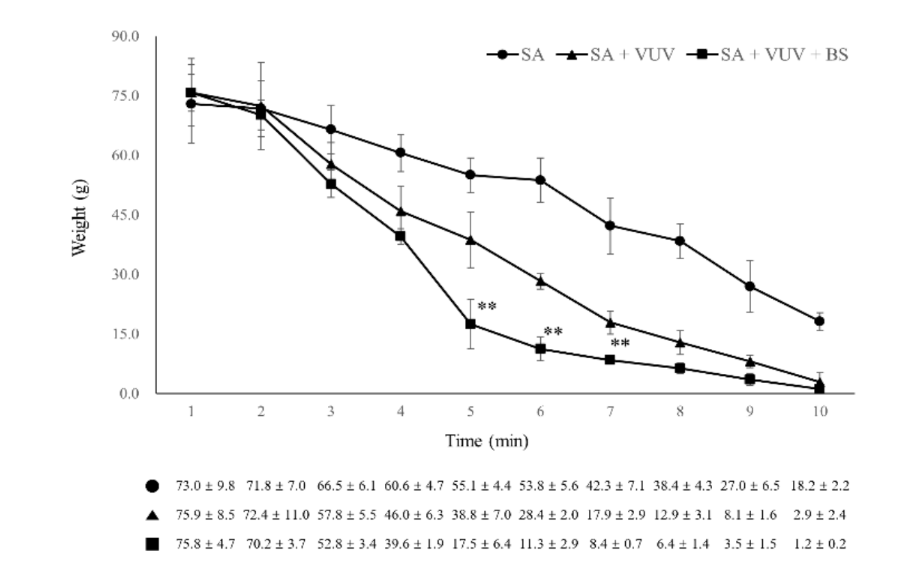
Drei Monate nach den Extraktionen wurde die chirurgische Platzierung von Zahnimplantaten in den geheilten Extraktionsstellen unter sterilen Bedingungen durchgeführt. Nach der lokalen Anästhesie wurde ein Volldickenschlappen angehoben, um den Alveolarkamm freizulegen, und der unregelmäßige alveoläre Crest wurde geglättet. Es wurden aufeinanderfolgende Bohrungen für die aufeinanderfolgenden Implantatstellen durchgeführt, die größer als das Implantat waren, unter Verwendung eines Führungsbohrers, einem 2,2 mm Twistbohrer, einem 3,0 mm Kegelbohrer, einem 4,0 mm Kegelbohrer und einem 6,0 mm Ultra-Kegelbohrer. Insgesamt wurden 12 Implantatbefestigungen von SA, SA + VUV und SA + VUV + BS, 8,5 mm lang mit einem Durchmesser von 3,5 mm, bilateral mit einem vorgegebenen Einsatztorque von 35 N cm platziert. Das gesamte Blut aus dem Spalt zwischen dem Loch und der Implantatbefestigung wurde in einem Baumwollpellet bis 10 Minuten nach der Implantatplatzierung aufgesogen, und das Gewicht (g) des Baumwollpellets wurde jede Minute gemessen, um das Potenzial der Blutgerinnung der Implantatbefestigungen zu bewerten. Alle Versuchstiere wurden nach der Operation durch eine intravenöse Überdosis von Kaliumchlorid getötet.
2.4. Statistische Analyse
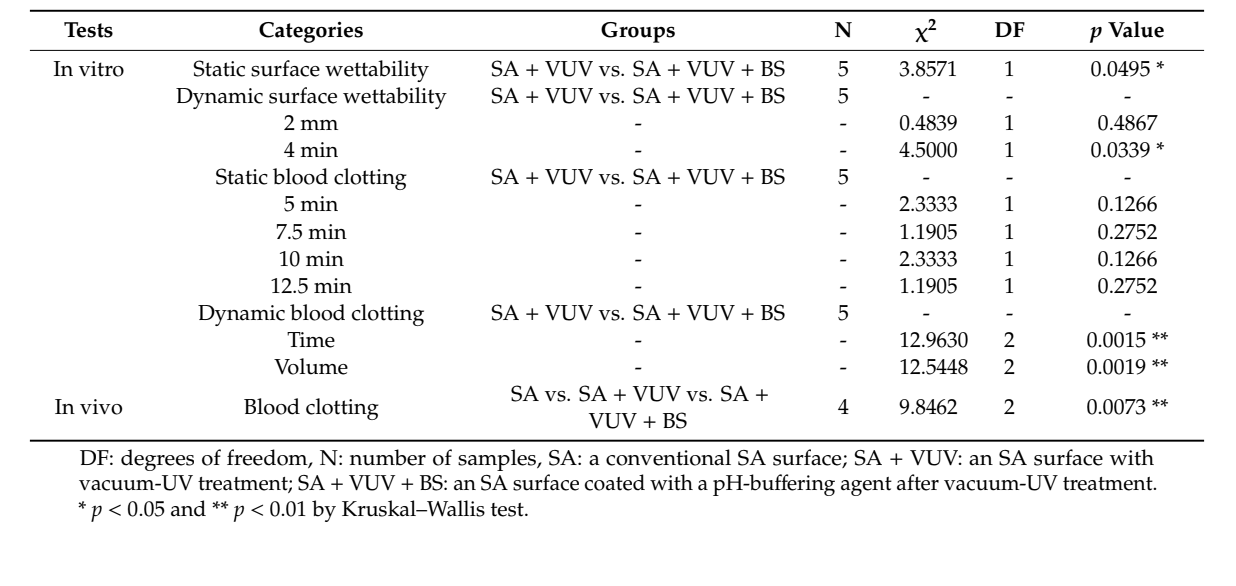
Aufgrund der kleinen Stichprobengröße führten wir einen Kruskal-Wallis-Test durch, der einen nichtparametrischen Vergleich der Mittelwertunterschiede ohne Normalitätsannahme darstellt, um die Unterschiede zwischen SA + VUV und S + VUV + BS in vitro sowie zwischen SA, SA + VUV und SA + VUV + BS in vivo zu untersuchen, mit einer statistischen Signifikanz von p < 0,05 bei α = 0,05. Alle statistischen Analysen wurden mit SAS, Version 9.4 (SAS Inc., Cary, NC, USA) durchgeführt.
Ergebnisse
3.1. In Vitro-Tests
3.1.1. Statische Oberflächenbenetzbarkeit
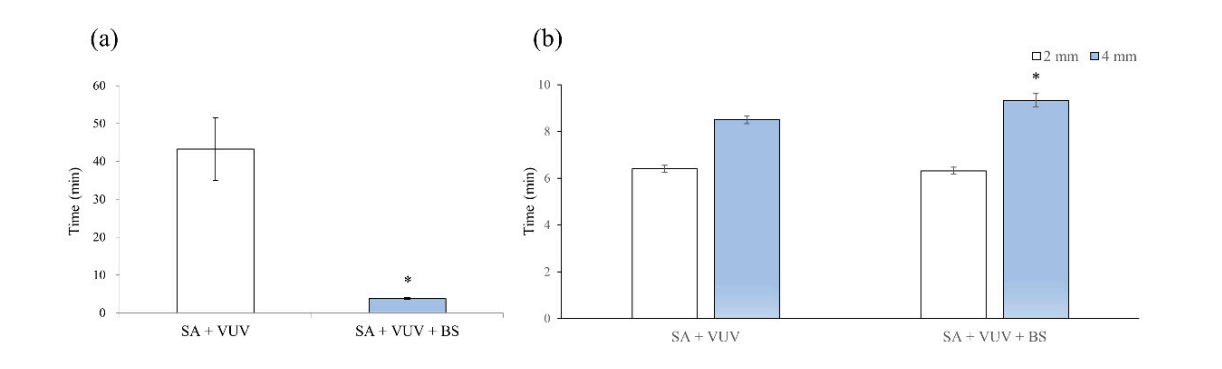
Die Zeiten, bevor das Blut die Oberkante des Implantatgewindes erreichte, betrugen 43,3 ± 8,3 min und 3,8 ± 0,3 min in SA + VUV und SA + VUV + BS, jeweils, und ein statistisch signifikanter Unterschied (p < 0,05) zwischen den beiden war offensichtlich (Abbildung 4a).
3.1.2. Dynamische Oberflächenbenetzbarkeit
Die Zeiten, bevor das Blut 2 mm über der horizontalen Platte erreichte, betrugen 6,4 ± 0,1 min und 6,3 ± 0,2 min, und für 4 mm über der horizontalen Platte waren es 8,5 ± 0,2 min und 9,3 ± 0,3 min in SA + VUV und SA + VUV + BS, jeweils. Ein statistisch signifikanter Unterschied (p < 0,05) zwischen SA + VUV und SA + VUV + BS wurde nur für die Zeit gefunden, bevor das Blut 4 mm über der horizontalen Platte erreichte (Abbildung 4b).
3.1.3. Statische Blutgerinnung
In SA + VUV betrugen die Gewichte des um das Implantat befestigten Blutgerinnsels, die 5 min, 7,5 min, 10 min und 12,5 min nach dem Eintauchen des Implantatbefestigers in das Blut gemessen wurden, 0,04 ± 0,01 g, 0,09 ± 0,03 g, 0,23 ± 0,06 g und 0,39 ± 0,16 g. In SA + VUV + BS betrugen die Gewichte 0,07 ± 0,03 g, 0,12 ± 0,02 g, 0,39 ± 0,20 g und 0,61 ± 0,18 g, wobei zu keinem Zeitpunkt statistisch signifikante Unterschiede zwischen SA + VUV und SA + VUV + BS gemessen wurden (p > 0,05).
3.1.4. Dynamische Blutgerinnung
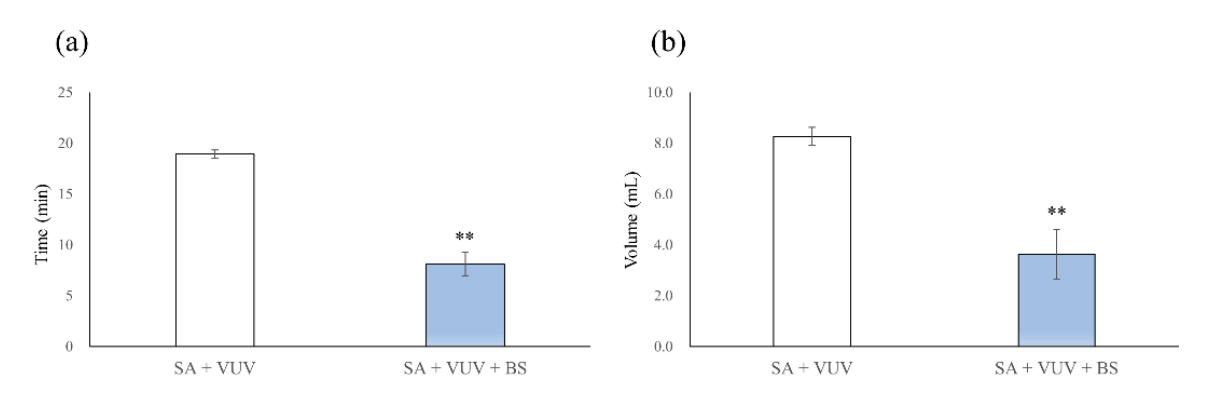
Die Zeiten für die vollständige Hämostase betrugen 19,0 ± 0,4 min und 8,1 ± 1,2 min in SA + VUV und SA + VUV + BS, wobei ein statistisch signifikanter Unterschied zwischen SA + VUV und SA + VUV + BS bestand (p < 0,01, Abbildung 5a). Darüber hinaus betrugen die Volumina des im darunterliegenden Rohr gesammelten Blutes 8,27 ± 0,36 mL und 3,64 ± 0,99 mL in SA + VUV und SA + VUV + BS, wobei ein statistisch signifikanter Unterschied (p < 0,01, Abbildung 5b) zwischen SA + VUV und SA + VUV + BS evident war.
3.2. In Vivo Test
Unter SA, SA + VUV und SA + VUV + BS gab es statistisch signifikante Unterschiede im Gewicht des gesamten Blutes, das in das Baumwollpellet absorbiert wurde, gemessen nach 5 min, 6 min und 7 min (p < 0.01, Abbildung 6). Zusammenfassende Statistiken dieser Studie sind in Tabelle 1 dargestellt.
Diskussion
UV-Photofunktionalisierung, eine Methode zur Modifizierung von Titanoberflächen nach UV-Behandlung, die die physikochemischen Eigenschaften verändert und die Biokompatibilität verbessert, wurde vorgeschlagen, um die biologische Alterung von Titan zurückzusetzen. Nach der Behandlung mit UV-Strahlung wurde die TiO2-Schicht einer mit Kohlenwasserstoffen angereicherten Titanoberfläche bemerkenswert hydrophil oder superhydrophil. Der Anteil an Oberflächenkohlenstoff variiert bekanntermaßen je nach Alter der Oberfläche und kann Berichten zufolge auf etwa 60 % bis 70 % der Oberflächenatomkomponenten ansteigen. Die UV-Behandlung reinigt solche kohlenstoffkontaminierten Titanoberflächen, reduziert den Kohlenstoffanteil auf weniger als 20 % und erhöht gleichzeitig das Niveau der Osseointegration. Im UV-Spektrum wandeln sowohl UV-A als auch UV-C biologisch gealterte Titanoberflächen von hydrophob zu superhydrophil um, aber nur UV-C (200–280 nm) ist bekannt dafür, dass es den Oberflächenkohlenstoff auf ein Niveau reduziert, das einem neuen Oberflächen entspricht, und die Bioaktivität verbessert. UV-C ist in der Lage, Kohlenwasserstoffe aus einer TiO2-Schicht von Titan durch direkte Photodekomposition zu entfernen, was effektiver ist als die Photokatalyse durch UV-A. In unserer Studie wurden alle Implantatbefestigungen durch UV-C und VUV (100–200 nm) photofunktionalisiert, und die radikale Entfernung von Kohlenwasserstoffen aus der TiO2-Schicht von Titan könnte mehr Superhydrophilität bieten. VUV wird schnell von Wasser in der Atmosphäre absorbiert und ist daher in der Lage, verschiedene reaktive Sauerstoffspezies zu erzeugen, indem es Wasserstoffbrücken in Wassermolekülen durch Hydrolyse bricht. Die durch VUV eingeleitete Hydrolyse ist eine effiziente Methode zur Gewinnung von Hydroxid- oder Hydroxylgruppen auf einer TiO2-Schicht, die eine anhaltende Superhydrophilität bietet. Da die VUV-Behandlung dazu neigt, mehr Ozon in der Atmosphäre und Hydroxylradikale im Wasser zu erzeugen, sollte sie streng auf Labor- oder Fabrikeinstellungen und nicht auf klinische Umgebungen beschränkt werden.
Um die Knochenheilung zu beschleunigen und die Knochenverankerung an einem Implantat zu verbessern, kann die Knochen/Implantat-Schnittstelle topographisch und biochemisch verbessert werden, indem anorganische Phasen wie Calciumphosphat und organische Moleküle wie Proteine, Enzyme oder Peptide auf oder in eine TiO2-Schicht integriert werden. Nanostrukturierte Implantatoberflächen, die eine große Oberfläche, hohe Oberflächenenergie und Benetzbarkeit aufweisen, scheinen in der Lage zu sein, die Reaktion des Wirtsgewebes zu modifizieren. SA-Implantatoberflächen haben vorhersehbare klinische Ergebnisse gezeigt und gelten als Standard-Implantatoberfläche. Die Superhydrophilie von SA + VUV + BS, die zuvor auf der flachen Oberfläche von Scheiben festgestellt wurde, wurde in unserem Test der statischen Oberflächenbenetzbarkeit bestätigt. Da die Fähigkeit, Blut in die Nähe der Oberseite des Implantatbefestigungselements (ungefähr 4 mm über der horizontalen Platte in unserer Studie) zu ziehen, das ist, was die meisten Kliniker letztendlich in einer klinischen Umgebung überprüfen möchten, haben wir einen neuen dynamischen Test der Oberflächenbenetzbarkeit hinzugefügt, um die Benetzungsraten von SA + VUV und SA + VUV + BS detaillierter zu vergleichen. Da SA eine trockene Oberfläche ist, die nicht mit einer Flüssigkeit in Kontakt gekommen ist, könnte die Oberflächenbenetzbarkeit von SA + VUV + BS erheblich überlegen sein im Vergleich zu SA allein durch den Effekt des pH-puffernden Mittels von SA + VUV + BS selbst. Da Implantatbefestigungselemente jedoch in realen klinischen Situationen mit trockenen Oberflächen oder ohne zusätzliche Hydratation platziert werden, wählten wir ein naïves SA, anstatt ein in Lösung hydratisiertes SA, als Kontrolle. Eine hydrophilere Oberfläche wurde zuvor als eng verbunden mit überlegenerer und schnellerer Osseointegration festgestellt. Darüber hinaus ist bekannt, dass die Oberflächenbenetzbarkeit die biologischen Reaktionen von Implantatoberflächen in Bezug auf die Adhäsion von Proteinen und anderen Molekülen sowie Zellinteraktionen verändert.
Da die Bildung von Blutgerinnseln den Beginn des Heilungsprozesses signalisiert, wird die Interaktion zwischen einem Implantat und Blut als wichtig für die erfolgreiche Osseointegration von Titanimplantaten nach der Implantation angesehen. Die Bildung von Blutgerinnseln auf rauen Titanoberflächen kann die Rekrutierung von Zellen induzieren und die Wundheilung stimulieren, und es wurde gezeigt, dass sowohl Präosteoblasten als auch Osteoblasten an einer Implantatoberfläche, die mit Thrombozyten und Fibrin bedeckt ist, haften können, wo sie sich unter dem Einfluss von osteogenen Faktoren und Zytokinen, die aus dem peri-implantären Blutgerinnsel freigesetzt werden, differenzieren. Die Bildung von Blutgerinnseln auf dem Implantat mit verschiedenen Implantatoberflächen wird als entscheidender Faktor für die effektive Fibrinretention angesehen und kann die Knochenheilung und Osseointegration erheblich beeinflussen, indem sie den Transport von Makromolekülen, das Zellverhalten und die Kontakt-/Distanzosteogenese beeinflusst. In einem Test der statischen Blutgerinnung zeigte SA + VUV + BS eine überlegene Blutabsorption um die Implantatbefestigungen im Vergleich zu SA + VUV, jedoch nicht in statistisch signifikantem Maße. Dies deutet darauf hin, dass eine SA-Oberfläche, die mit VUV photofunktionalisiert wurde, zumindest die gleiche Fähigkeit zur Blutgerinnung hat. Wir entwarfen neue Experimente, um die Blutgerinnung durch Hämostase bei kontinuierlichen Kapillarblutungen zu bestätigen, um reale klinische Situationen so genau wie möglich zu simulieren. In einem Test der in vitro dynamischen Blutgerinnung bildeten sich die Gerinnsel signifikant schneller, und das Gesamtvolumen des Blutes, das durch den Spalt zwischen Löchern und Implantatbefestigung zur Hämostase gesammelt wurde, war bei SA + VUV + BS signifikant geringer als bei SA + VUV. Ein in vivo-Test zeigte ebenfalls einen signifikanten Unterschied im Gesamtgewicht der Blutung zwischen dem überpräparierten Loch und einer Implantatbefestigung unter SA, SA + VUV und SA + VUV + BS. Dies deutet darauf hin, dass SA + VUV + BS eine schnellere Blutgerinnselbildung um die Implantatoberfläche induzieren kann, was zu einer effektiveren Interaktion der Knochen-zu-Implantat-Schnittstelle für die Osseointegration führt. Klinisch betrachtet sind diese Eigenschaften von SA + VUV + BS wichtig für die Visualisierung des chirurgischen Bereichs und die gleichzeitige geführte Knochenregeneration, die häufig für die angemessene Menge und Qualität des peri-implantären Gewebes für ästhetischere und funktionellere Ergebnisse angezeigt wird, da eine schnelle Blutgerinnung eng mit der Stabilisierung von Transplantatmaterial und der Barrieremembran verbunden ist. Schließlich könnte SA + VUV eine Alternative zu SA + VUV + BS in Bezug auf das Potenzial zur Blutgerinnselbildung auf Implantatoberflächen sein.
Während des Implantatbohrens im Knochen, das eine schwach saure Bedingung erzeugt, kann ein pH-Puffer helfen, den pH-Wert konstant zu halten. Als Beschichtungsmaterial scheint der pH-puffernde Wirkstoff die Freisetzung der entzündlichen Mediatoren zu kontrollieren und die Bedingungen für die Osteoblastenaktivität zu verbessern, indem er den pH-Wert konstant hält oder zumindest signifikante Veränderungen verhindert. Die Aktivität der Thrombozyten bei der Blutgerinnung sowie sowohl die Aktivität der Osteoblasten als auch der ALP-Spiegel für die Knochenbildung werden ebenfalls durch extrazelluläre Azidose gehemmt. SA + VUV + BS könnte die Aktivität der Thrombozyten, die Thrombogenese, die Aktivität der Osteoblasten und den ALP-Spiegel an einer Knochen-Implantat-Schnittstelle durch einen pH-puffernden Effekt maximieren. Weitere Studien sind erforderlich, um SA + VUV + BS hinsichtlich seiner Sicherheit und Wirksamkeit in klinischen Anwendungen zu untersuchen. Randomisierte kontrollierte Studien sollten ebenfalls durchgeführt werden, um die Durchführbarkeit unter verschiedenen klinischen Bedingungen, wie der Implantation unmittelbar nach der Zahnextraktion oder mit gleichzeitiger Knochenaugmentation, zu bestätigen.
Chang-Joo Park, Jae Hyung Lim, Marco Tallarico, Kyung-Gyun Hwang, Hyook Choi, Gyu-Jang Cho, Chang Kim, Il-Seok Jang, Ju-Dong Song, Amy M. Kwon, Sang Ho Jeon und Hyun-Kyung Park
Referenzen
- Özcan, M.; Hämmerle, C. Titan als Rekonstruktions- und Implantatmaterial in der Zahnheilkunde: Vorteile und Fallstricke. Materialien 2012, 5, 1528–1545. [CrossRef]
- Ehrenfest, D.M.D.; Coelho, P.G.; Kang, B.S.; Sul, Y.T.; Albrektsson, T. Klassifikation von osseointegrierten Implantatoberflächen: Materialien, Chemie und Topographie. Trends Biotechnol. 2010, 28, 198–206. [CrossRef]
- Milošev, I.; Metikoš-Hukovic´, M.; Strehblow, H.H. Passive Schicht auf der orthopädischen TiAlV-Legierung, die in physiologischer Lösung gebildet wurde, untersucht mit der Röntgen-Photoelektronenspektroskopie. Biomaterialien 2000, 21, 2103–2113. [CrossRef]
- Lee, J.H.; Ogawa, T. Das biologische Altern von Titanimplantaten. Implantat Zahn. 2012, 21, 415–421. [CrossRef]
- Hori, N.; Att, W.; Ueno, T.; Sato, N.; Yamada, M.; Saruwatari, L.; Suzuki, T.; Ogawa, T. Altersabhängiger Abbau der Proteinadsorptionskapazität von Titan. J. Dent. Res. 2009, 88, 663–667. [CrossRef]
- Hori, N.; Ueno, T.; Suzuki, T.; Iwasa, F.; Yamada, M.; Att, W.; Okada, S.; Ohno, A.; Aita, H.; Kimoto, K. Behandlung mit ultraviolettem Licht zur Wiederherstellung des altersbedingten Abbaus der Bioaktivität von Titan. Int. J. Oral Maxillofac. Implant. 2010, 25, 49–62.
- Ogawa, T. Ultraviolette Photofunktionalisierung von Titanimplantaten. Int. J. Oral Maxillofac. Implant. 2014, 29, e95–e102. [CrossRef] [PubMed]
- Rosales-Leal, J.; Rodríguez-Valverde, M.; Mazzaglia, G.; Ramón-Torregrosa, P.; Díaz-Rodríguez, L.; García-Martínez, O.; Vallecillo-Capilla, M.; Ruiz, C.; Cabrerizo-Vílchez, M. Einfluss von Rauheit, Benetzbarkeit und Morphologie von bearbeiteten Titanoberflächen auf die Adhäsion von osteoblastähnlichen Zellen. Kolloide Oberflächen. Physikochem. Ingenieur. Aspekte 2010, 365, 222–229. [CrossRef]
- Cicciù, M.; Fiorillo, L.; Herford, A.S.; Crimi, S.; Bianchi, A.; D’Amico, C.; Laino, L.; Cervino, G. Bioaktive Titanoberflächen: Wechselwirkungen von eukaryotischen und prokaryotischen Zellen von Nano-Geräten, die in der Zahnmedizin angewendet werden. Biomedikamente 2019, 7, 12. [CrossRef]
- Li, D.; Ferguson, S.J.; Beutler, T.; Cochran, D.L.; Sittig, C.; Hirt, H.P.; Buser, D. Biomechanischer Vergleich der sandgestrahlten und säuregeätzten sowie der bearbeiteten und säuregeätzten Titanoberfläche für Zahnimplantate. J. Biomed. Mater. Res. 2002, 60, 325–332. [CrossRef]
- Kaysinger, K.K.; Ramp, W.K. Extrazelluläres pH moduliert die Aktivität kultivierter menschlicher Osteoblasten. J. Cell. Biochem. 1998, 68, 83–89. [CrossRef]
- Marumo, M.; Suehiro, A.; Kakishita, E.; Groschner, K.; Wakabayashi, I. Extrazelluläres pH beeinflusst die Thrombozytenaggregation, die mit der Modulation des speicherbetriebenen Ca2+-Einstroms verbunden ist. Thromb. Res. 2001, 104, 353–360. [CrossRef]
- Hong, J.; Kurt, S.; Thor, A. Eine hydrophile Zahnimplantatoberfläche zeigt thrombogene Eigenschaften in vitro. Klin. Implantat Zahn. Relat. Res. 2013, 15, 105–112. [CrossRef]
- Di Iorio, D.; Traini, T.; Degidi, M.; Caputi, S.; Neugebauer, J.; Piattelli, A. Quantitative Bewertung der Fibrinclot-Ausdehnung auf verschiedenen Implantatoberflächen: Eine In-vitro-Studie. J. Biomed. Mater. Res. 2005, 74, 636–642. [CrossRef]
- Pae, H.C.; Kim, S.K.; Park, J.Y.; Song, Y.W.; Cha, J.K.; Paik, J.W.; Choi, S.H. Bioaktive Eigenschaften einer Implantatoberfläche, die mit einem pH-Puffer beschichtet ist: Eine In-vitro-Studie. J. Periodontal Implant. Sci. 2019, 49, 366–381. [CrossRef]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Radiologische vergleichende Analyse zwischen Kochsalzlösung und plättchenreichem Fibrinfüllung nach hydraulischem transcrestalen Sinuslifting ohne ergänzenden Knochenersatz: Eine randomisierte kontrollierte Studie. Klin. Oral Implant. Res. 2020. [CrossRef] [PubMed]
- Att, W.; Hori, N.; Iwasa, F.; Yamada, M.; Ueno, T.; Ogawa, T. Der Einfluss der UV-Photofunktionalisierung auf die zeitabhängige Bioaktivität von Titan- und Chrom-Kobalt-Legierungen. Biomaterialien 2009, 30, 4268–4276. [CrossRef]
- Shie, J.L.; Lee, C.H.; Chiou, C.S.; Chang, C.T.; Chang, C.C.; Chang, C.Y. Photodegradationskinetik von Formaldehyd unter Verwendung von Lichtquellen von UVA, UVC und UVLED in Anwesenheit eines zusammengesetzten Silber-Titanoxid-Photokatalysators. J. Hazard. Mater. 2008, 155, 164–172. [CrossRef]
- McGivney, E.; Carlsson, M.; Gustafsson, J.P.; Gorokhova, E. Auswirkungen von UV-C und Vakuum-UV TiO2-advanced oxidation processes auf die akute Mortalität von Mikroalgen. Photochem. Photobiol. 2015, 91, 1142–1149. [CrossRef]
- Westall, J.; Hohl, H. Ein Vergleich von elektrostatischen Modellen für die Oxidlösungsschnittstelle. Adv. Kolloid Interface Sci. 1980, 12, 265–294. [CrossRef]
- Tang, L.; Thevenot, P.; Hu, W. Oberflächenchemie beeinflusst die Biokompatibilität von Implantaten. Aktuelle Themen. Med. Chem. 2008, 8, 270–280. [CrossRef]
- Coelho, P.G.; Granjeiro, J.M.; Romanos, G.E.; Suzuki, M.; Silva, N.R.; Cardaropoli, G.; Thompson, V.P.; Lemons, J.E. Grundlagenforschungsmethoden und aktuelle Trends der Zahnimplantatoberflächen. J. Biomed. Mater. Res. 2009, 88, 579–596. [CrossRef]
- Puleo, D.; Nanci, A. Verständnis und Kontrolle der Knochen-Implantat-Schnittstelle. Biomaterialien 1999, 20, 2311–2321. [CrossRef]
- Morra, M.; Cassinelli, C.; Cascardo, G.; Mazzucco, L.; Borzini, P.; Fini, M.; Giavaresi, G.; Giardino, R. Mit Kollagen I beschichtete Titanoberflächen: Adhäsion mesenchymaler Zellen und in vivo Bewertung in trabekulären Knochenimplantaten. J. Biomed. Mater. Res. 2006, 78, 449–458. [CrossRef] [PubMed]
- Morra, M. Biochemische Modifikation von Titanoberflächen: Peptide und ECM-Proteine. Eur. Cell. Mater. 2006, 12, 15. [CrossRef]
- Makowiecki, A.; Hadzik, J.; Błaszczyszyn, A.; Gedrange, T.; Dominiak, M. Eine Bewertung von superhydrophilen Oberflächen von Zahnimplantaten - eine systematische Überprüfung und Meta-Analyse. BMC Oral Health 2019, 19, 79. [CrossRef]
- Khandelwal, N.; Oates, T.W.; Vargas, A.; Alexander, P.P.; Schoolfield, J.D.; Alex McMahan, C. Konventionelle SLA- und chemisch modifizierte SLA-Implantate bei Patienten mit schlecht kontrolliertem Typ-2-Diabetes mellitus - Eine randomisierte kontrollierte Studie. Klin. Oral Implant. Res. 2013, 24, 13–19. [CrossRef]
- Kokovic, V.; Jung, R.; Feloutzis, A.; Todorovic, V.S.; Jurisic, M.; Hämmerle, C.H. Sofortige vs. frühe Belastung von SLA-Implantaten im hinteren Unterkiefer: 5-Jahres-Ergebnisse einer randomisierten kontrollierten klinischen Studie. Klin. Oral Implant. Res. 2014, 25, e114–e119. [CrossRef]
- Cesaretti, G.; Botticelli, D.; Renzi, A.; Rossi, M.; Rossi, R.; Lang, N.P. Radiografische Bewertung von sofort belasteten Implantaten, die 2–3 Einheiten feste Brücken im hinteren Oberkiefer unterstützen: Eine 3-Jahres-Follow-up prospektive randomisierte kontrollierte multizentrische klinische Studie. Klin. Oral Implant. Res. 2016, 27, 399–405. [CrossRef]
- Buser, D.; Broggini, N.; Wieland, M.; Schenk, R.; Denzer, A.; Cochran, D.; Hoffmann, B.; Lussi, A.; Steinemann, S. Verbesserte Knochenanlagerung an einer chemisch modifizierten SLA-Titanoberfläche. J. Dent. Res. 2004, 83, 529–533. [CrossRef]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Frühe Osseointegration an hydrophilen und hydrophoben Implantatoberflächen beim Menschen. Klin. Oral Implant. Res. 2011, 22, 349–356. [CrossRef] [PubMed]
- Gittens, R.A.; Scheideler, L.; Rupp, F.; Hyzy, S.L.; Geis-Gerstorfer, J.; Schwartz, Z.; Boyan, B.D. Eine Übersicht über die Benetzbarkeit von Zahnimplantatoberflächen II: Biologische und klinische Aspekte. Acta Biomater. 2014, 10, 2907–2918. [CrossRef]
- Shiu, H.T.; Goss, B.; Lutton, C.; Crawford, R.; Xiao, Y. Die Bildung von Blutgerinnseln auf Biomaterialimplantaten beeinflusst die Knochenheilung. Gewebe Ingenieur. Teil B Rev. 2014, 20, 697–712. [CrossRef]
- Yang, J.; Zhou, Y.; Wei, F.; Xiao, Y. Blutgerinnsel, das auf rauer Titanoberfläche gebildet wird, induziert frühe Zellrekrutierung. Klin. Oral Implant. Res. 2016, 27, 1031–1038. [CrossRef]
- Gassling, V.; Hedderich, J.; Açil, Y.; Purcz, N.; Wiltfang, J.; Douglas, T. Vergleich von plättchenreichem Fibrin und Kollagen als Osteoblast-besäte Gerüste für Anwendungen in der Knochengewebeingenieurwissenschaft. Klin. Oral Implant. Res. 2013, 24, 320–328. [CrossRef]
