Eine randomisierte kontrollierte Studie zur geführten Knochenregeneration bei peri-implantären Dehiszenzdefekten mit zwei anorganischen bovinen Knochenmaterialien, die mit Titan-Maschen abgedeckt sind.
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Das Ziel dieser Studie ist es, zwei bei niedriger Temperatur gesinterte anorganische bovine Knochenmaterialien (ABBMs), Bio-Oss (Geistlich, Wolhusen, Schweiz) und A-Oss (Osstem, Seoul, Korea), für GBR in Dehiszenzdefekten zu vergleichen. Ein einzelnes Implantat wurde gleichzeitig mit GBR im buccalen oder bucco-proximalen knöchernen Defekt durch doppelschichtige Verwendung von innerem Allograft und äußerem ABBM platziert, abgedeckt mit einem vorgeformten ultrafeinen Titannetz und einer resorbierbaren Kollagenmembran. Die Veränderungen des transplantierten Volumens wurden durch Cone-Beam-Computertomographie bewertet, die präoperativ (T0), unmittelbar nach der Implantatchirurgie (T1), nach der Wiederöffnungschirurgie (T2) und nach der Lieferung der endgültigen Restauration (T3) durchgeführt wurde. Die Dichte des regenerierten Knochens wurde durch Messung der Sondierungstiefe in der buccalen Mitte des Netzes nach Entfernung des Netzes bei T2 bewertet. Postoperative Folgezustände wurden ebenfalls dokumentiert. Eine Schrumpfung des transplantierten Volumens von 46,0% (0,78 ± 0,37 cc) und 40,8% (0,79 ± 0,33 cc) in der Bio-Oss-Gruppe (8 Patienten) und der A-Oss-Gruppe (8 Patienten) wurde bei T3 beobachtet (p < 0,001). Es gab keine signifikanten Unterschiede in den Veränderungen des transplantierten Volumens in Abhängigkeit von den Zeiträumen oder der Knochendichte zwischen den beiden Gruppen. Trotz postoperativer Netzexposition (3 Patienten) war eine vorzeitige Entfernung dieser exponierten Netze und zusätzliche Transplantationen nicht notwendig, und alle Implantate waren über den 1-Jahres-Nachbeobachtungszeitraum funktional. Beide ABBMs mit Titannetzen zeigten keinen signifikanten Unterschied in der Menge und Dichte des regenerierten Knochens nach GBR für peri-implantäre Defekte.
Einführung
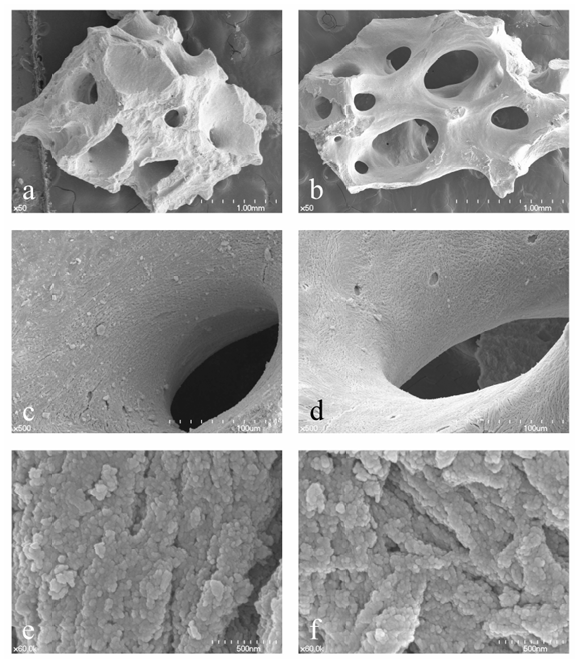
Innovative Geräte und Technologien zur Reduzierung von Morbidität, biologischen und chirurgischen Zeiten sind ein intensives Forschungsthema in der Implantatzahnheilkunde, und die geführte Knochenregeneration (GBR) ist ein chirurgisches Verfahren zur Knochenaugmentation für Zahnimplantate, bei dem verschiedene Knochenersatzmaterialien mit gleichzeitigen Barrieremembranen verwendet werden. Anorganische bovine Knochenmaterialien (ABKM) wurden weit verbreitet als osteokonduktives Material für Sinuslift-Operationen, Ridge Preservation, Implantatchirurgie unmittelbar nach der Zahnextraktion und GBR eingesetzt. Der einzigartige Vorteil von ABKM ist seine eigene Eigenschaft der Volumenhaltung mit langsamer Substitution durch den neuen Knochen im Vergleich zu autogenem und allogenem Knochenersatzmaterial. Es gibt viele andere Arten von ABKM, die bei hohen Temperaturen gesintert oder auf Schweine- und Pferdebasis sind; jedoch scheinen bovine und bei niedriger Temperatur gesinterte ABKM den zahnmedizinischen Markt zu dominieren. Historisch wurde Bio-Oss (Geistlich, Wolhusen, Schweiz) lange Zeit als der Goldstandard angesehen, da es starke wissenschaftliche Beweise gibt; dennoch ist A-Oss (Osstem, Seoul, Korea) ein ABKM, das durch chemische Behandlung mit aromatischen und starken alkalischen Lösungsmitteln und schließlich durch einen Niedertemperatur-Glühprozess unter 400°C mit einer extrem niedrigen Heizrate (<0,3°C pro Minute) hergestellt wird. Die physikochemische Charakterisierung von A-Oss, die im Hinblick auf sowohl höhere Porosität als auch niedrigere Kristallinität erheblich mit der von Bio-Oss vergleichbar sein könnte, ist eng verbunden mit weniger Abbau- und Remodeling-Aktivität im Vergleich zu anderen Xenotransplantaten (Abbildung 1).
Im Bereich der oral- und maxillofazialen Chirurgie wird das Titannetz aufgrund seiner inhärenten Biokompatibilität und Steifigkeit als Leichtmetall häufig für Fälle eingesetzt, die eine große Menge an Knochenrekonstruktion erfordern. Besonders die kürzliche Einführung eines vorgeformten ultrafeinen Titannetzes, das direkt mit dem Implantat verbunden und fixiert ist, hat seine Beliebtheit in der GBR für peri-implantäre knöcherne Defekte erhöht. Dieses ultrafeine Titannetz, das während der gesamten Heilungsphase der GBR resistent gegen Kollaps ist, verfügt über multiple Poren mit unterschiedlichen Größen für optimale GBR-Ergebnisse.
Das Ziel dieser randomisierten kontrollierten klinischen Studie war es, zwei bei niedriger Temperatur gesinterte ABBMs, Bio-Oss und A-Oss, die in der GBR zur Rekonstruktion von peri-implantären Dehiszenzdefekten verwendet werden, in Kombination mit dem ultrafeinen Titannetz zu vergleichen. Soweit uns bekannt ist, ist dies die erste Studie, die dreidimensionale volumetrische Veränderungen von ABBMs zu GBR-Zwecken misst und vergleicht. Die Nullhypothese war, dass es keinen Unterschied in den Veränderungen des transplantierten Volumens (Knochenmenge), der Dichte (Knochenqualität) des regenerierten Knochens und der postoperativen Folgen zwischen den Gruppen gab.
Materialien und Methoden
Diese Studie wurde als randomisierte kontrollierte Studie mit parallelem Gruppen-Design konzipiert und wurde zwischen Juni 2018 und Juli 2019 an der Abteilung für Mund- und Kieferchirurgie, Zahnmedizin, Hanyang University Hospital, durchgeführt. Die Studie wurde vom Ethikkomitee des Hanyang University Hospital genehmigt (IRB-Nr. 2018-03-006) und im internationalen klinischen Studienregister der WHO (KCT0004906) registriert. Sie wurde in Übereinstimmung mit den Deklarationen von Helsinki und international anerkannten Richtlinien für RCTs, einschließlich der CONSORT-Erklärung (abgerufen am 2. März 2018), durchgeführt. Alle chirurgischen und prothetischen Verfahren wurden von einem erfahrenen Implantologen (C.-J.P.) durchgeführt.
Patientenauswahl
Nach präoperativen klinischen und radiologischen Untersuchungen, einschließlich der Cone-Beam-Computertomographie (CBCT), wurde jeder gesunde Patient im Alter von 18 Jahren oder älter, der eine Einzelimplantation im geheilten Alveolarkamm mit GBR für den peri-implantären Dehiszenzdefekt benötigte, als in diese Studie aufgenommen, wenn das Implantat in einer prothetisch geführten Position simuliert wurde (OneGuide, Osstem, Seoul, Korea), nachdem eine informierte Einwilligung eingeholt wurde. Insbesondere sollten die knöchernen Defekte auf die bukkale und/oder proximale Seite beschränkt sein und nicht die benachbarte Zahnoberfläche oder die linguale Seite betreffen. Die Ausschlusskriterien umfassten die Notwendigkeit von mehr als zwei aufeinanderfolgenden Implantaten und das Vorliegen systemischer oder lokaler Kontraindikationen für die Implantation, einschließlich einer Vorgeschichte von unkontrollierten Stoffwechselstörungen, Rauchen, Bruxismus oder unkontrollierter Parodontalerkrankung. Die eingeschlossenen Patienten wurden über die chirurgischen Verfahren, die verwendeten Materialien, die Vorteile sowie die potenziellen Risiken und Komplikationen dieser klinischen Studie informiert, und eine schriftliche informierte Einwilligung wurde eingeholt.
Chirurgisches Verfahren
Alle Eingriffe wurden unter lokaler Anästhesie und moderater intravenöser Sedierung durchgeführt. Ein Vollschichtlappen wurde angehoben, und sämtliches Granulationsgewebe wurde gründlich entfernt. Zu Beginn wurde mit einem Führungsbohrer eine Markierung im kortikalen Knochen vorgenommen. Es wurden sequenzielle konische Bohrer verwendet, um den Implantatstandort vorzubereiten (OneGuide-Kit oder 122 Taper-Kit, Osstem), wobei besonderer Wert auf die korrekte dreidimensionale Position des Implantats gelegt wurde. Ein Zahnimplantat (TS III SOI, Osstem, oder T01 SA, Toplan, Seoul, Korea) wurde 1 mm subkrestal zur lingualen oder palatinalen Alveolarkante eingesetzt, und es trat ein Dehiszenzdefekt um die Implantatspitze auf, der die buccalen und/oder proximalen Implantatgewinde freilegte.
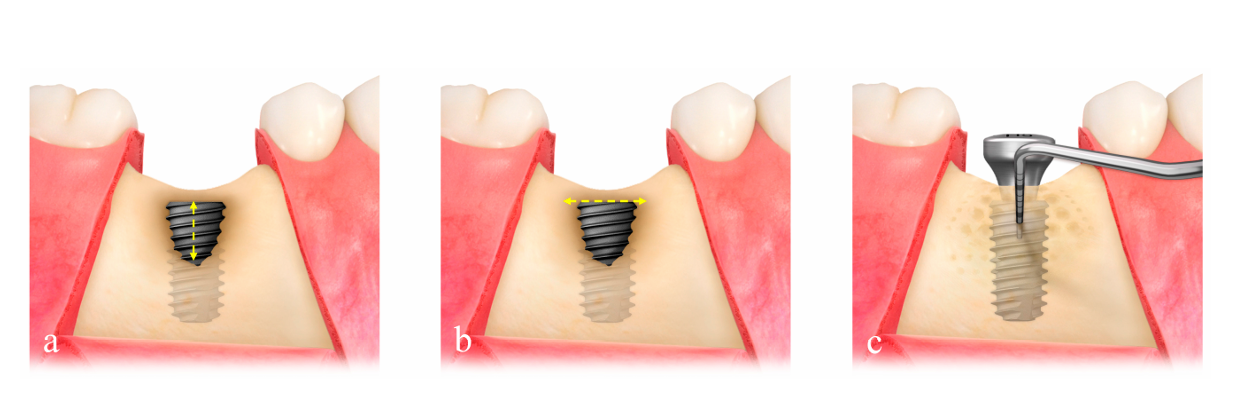
Die Defektgröße (mm) bestand aus der Defekthöhe, die von der Implantatspitze bis zum ersten Knochen-zu-Implantat-Kontakt gemessen wurde, und der Defektbreite, die von der mesialen bis zur distalen Knochenkante auf Höhe der Implantatspitze gemessen wurde (Abbildung 2a,b). Das vorgeformte ultrafeine Titan-Gitter (OssBuilder, Osstem), das am besten zur gemessenen Defektgröße passte, wurde aus verschiedenen Typ I für buccale Dehiszenzdefekte und Typ II für bucco-proximale kombinierte Dehiszenzdefekte ausgewählt (Abbildung 3). Bei Bedarf wurden kleinere Anpassungen und Konturierungen des Titan-Gitters vorgenommen, um eine bessere Eindämmung des Transplantatmaterials zu gewährleisten. Mehrere Knochenmarköffnungen wurden durchgeführt, um die osteogenen Zellen für eine schnellere und bessere Knochenregeneration zu induzieren.
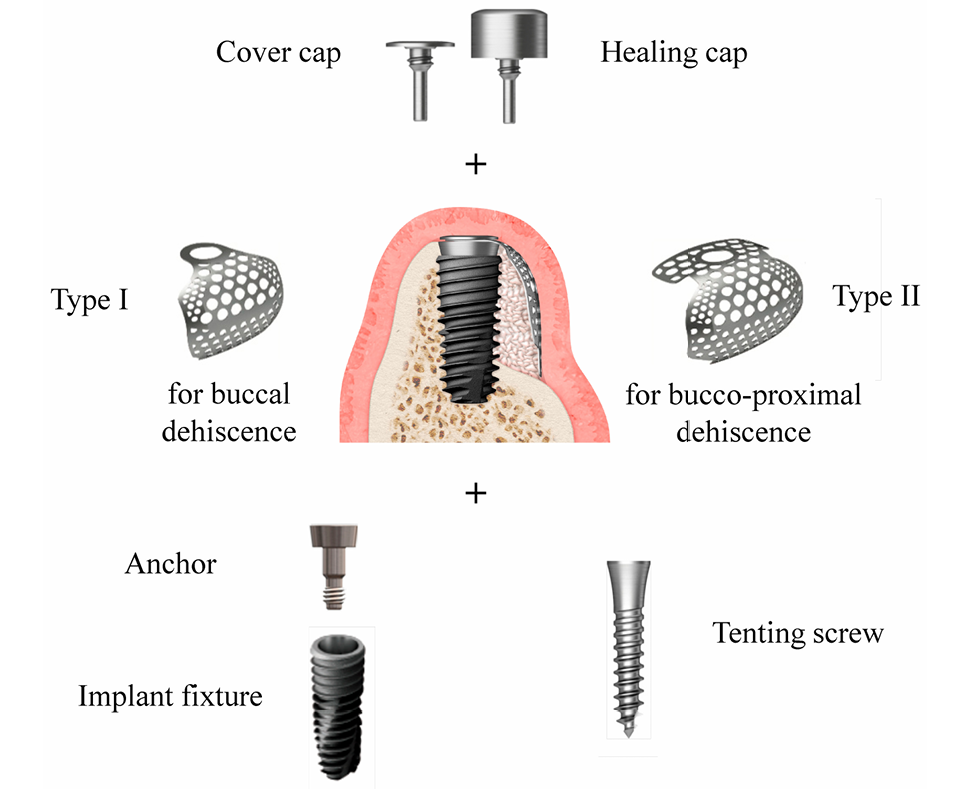
Gemäß dem Randomisierungsumschlag wurden die Patienten in zwei Gruppen eingeteilt: Bio-Oss-Gruppe und A-Oss-Gruppe. Die exponierten Implantatgewinde wurden mit einem gefriergetrockneten Knochenallograft (FDBA; SureOss, HansBiomed, Seoul, Korea) abgedeckt und mit einem ABBM, Bio-Oss oder A-Oss in einem Volumenverhältnis von 1:1 zur Konturerhaltung überlagert. Der Verankerungsteil, der das Implantat und das vorgeformte ultrafine Titannetz verbindet, wurde von Hand am Implantat festgezogen, und das ausgewählte ultrafine Titannetz wurde auf diesen Anker aufgebracht, um das gesamte Transplantatmaterial zu halten (Abbildung 3). Wenn das Implantat mit einem Sitzdrehmoment eingesetzt wurde
≤30 Ncm oder ein Implantat-Stabilitätsquotient-Wert ≤70, wurde die Abdeckkappe gemäß einem submersiellen Ansatz mit dem Titannetz verbunden. Andernfalls wurde die Heilungskappe sofort gemäß einem nicht-submersiellen Ansatz verbunden. Eine resorbierbare Kollagenmembran (OssGuide, SK Bioland, Cheonan, Korea) oder OssMem hard (Osstem) wurde auf das Titannetz angepasst, um das Risiko einer Verdünnung des darüber liegenden Zahnfleisches zu minimieren, was zu einer frühen Exposition des Titannetzes führen könnte. Das Periost des Vollschichtlappens wurde für eine spannungsfreie primäre Wundverschluss freigelegt. Die Patienten erhielten 10 Tage lang Analgetika und Antibiotika, um postoperative Schmerzen und Infektionen zu kontrollieren. Chlorhexidin-Mundspülungen wurden ebenfalls zweimal täglich verschrieben. Die Nähte wurden 10 Tage nach der Operation entfernt.
Acht Monate nach der Operation wurde eine Wiedereröffnungschirurgie unter Verwendung eines ähnlichen Lappendesigns unter lokaler Anästhesie durchgeführt. Nachdem das Titannetz entfernt wurde, wurde die Knochendichte durch die Sondierungstiefe bewertet, die im regenerierten Knochen unter der Mitte des Titannetzes mit kontrollierter Kraft von 0,25 N gemessen wurde (Abbildung 2c). Die Abdeckkappe oder Heilungskappe wurde durch einen Heilungsabutment ersetzt, und die Lappen wurden angepasst und genäht. Die Nähte wurden 10 Tage nach der Operation entfernt. Nach der Wiedereröffnungschirurgie durfte das Weichgewebe um den Heilungsabutment heilen, bevor der Abdruck genommen wurde. Eine einzelne temporäre Restauration wurde mit dem maßgefertigten Titanabutment für progressive Belastung integriert, und die endgültige Restauration wurde 12 Monate nach der Operation geliefert. Alle postoperativen Folgen bei GBR-Verfahren wurden gemäß der vorherigen Klassifikation der GBR-Komplikationen dokumentiert und vom selben Chirurgen (C.-J.P.) behandelt.
Bewertung des transplantierten Volumens
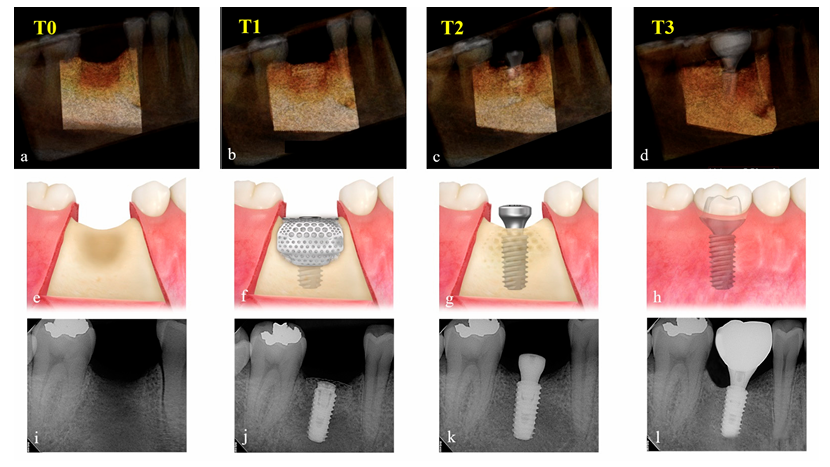
Änderungen im augmentierten Volumen des Transplantationsmaterials wurden bewertet, indem die CBCT-Daten, die präoperativ (T0), unmittelbar nach der Implantatchirurgie und GBR (T1), nach der Wiederöffnungschirurgie (T2) und nach der Lieferung der endgültigen Restauration (T3) aufgenommen wurden, verglichen wurden. Die Expositionsparameter für das CBCT-Scanning (Sichtfeld 35 × 50 mm; Voxelegröße 0,2 mm; Zeit 10,8 s; kV 75; mA 10; Dosisflächenprodukt 240 mGy·cm2) wurden so niedrig wie vernünftigerweise erreichbar (ALARA) eingestellt. Mit der Aquarium iNtuition-Software (TeraRecon, Durham, NC, USA) wurde der Implantatstandort in ein dreidimensionales Bild rekonstruiert und als Region von Interesse (ROI) unter Verwendung benachbarter anatomischer Strukturen, wie benachbarte Zähne, Sinusboden und inferiorer Alveolarkanal, segmentiert. Abteilungen, die radiologisch einheitlich in Dichte und Größe sind, wie Implantatkörper und Heilungsabutment, wurden subtrahiert, und das Volumen (cc) in ROI wurde entsprechend den Zeitperioden (Abbildung 4) von einem unabhängigen, verblindeten Prüfer (K.-G.H.) berechnet. Da diese Software im medizinischen Bereich weit verbreitet ist, um den okkludierten Teil großer Gefäße präzise zu erkennen und das Volumen des Organs für die Transplantation genau zu messen, wurde sie für diese Studie angewendet, um das ROI-Volumen zu messen und die CT-Technologie zu ergänzen.
Statistische Analyse
Die Stichprobengröße wurde so bestimmt, dass sie eine Teststärke von 90 % bei einem Minimum von α = 0,05 gemäß der Annahme gleicher Varianz basierend auf den Mittelwerten innerhalb und zwischen den Probanden aus der vorherigen randomisierten kontrollierten Studie zum Vergleich von Bio-Oss und dem mit Calciumphosphat beschichteten ABBM bei der Sinusaugmentation erfüllt. Basierend auf diesen Ergebnissen wurde die minimale Stichprobengröße auf 9 Probanden in jeder Gruppe geschätzt, wobei eine mögliche Abbrecherquote von 10 % während des Studienzeitraums berücksichtigt wurde.
Das gemischte Effektmodell wurde verwendet, um die Unterschiede in den Veränderungen des transplantierten Volumens zwischen den Bio-Oss- und A-Oss-Gruppen unter Berücksichtigung von Kovariaten zu untersuchen, wobei die Veränderungen des transplantierten Volumens in drei aufeinanderfolgenden Zeitperioden sowie zu Beginn (T0) gemessen wurden. Die Signifikanz der Kovariateffekte und die vorhergesagten Veränderungen des transplantierten Volumens
wurden bei α = 0,05 getestet. Darüber hinaus wurden deskriptive Statistiken über die allgemeinen Informationen der Patienten zu Beginn mit der Anzahl der Fälle und dem Prozentsatz für kategoriale Variablen sowie mit dem Mittelwert ± Standardabweichung für kontinuierliche Variablen zusammengefasst.
Alle statistischen Analysen wurden mit SAS, Version 9.4 (SAS Inc., Cary, NC, USA) durchgeführt. Die statistische Signifikanz wurde auf p < 0,05 festgelegt.
Ergebnisse
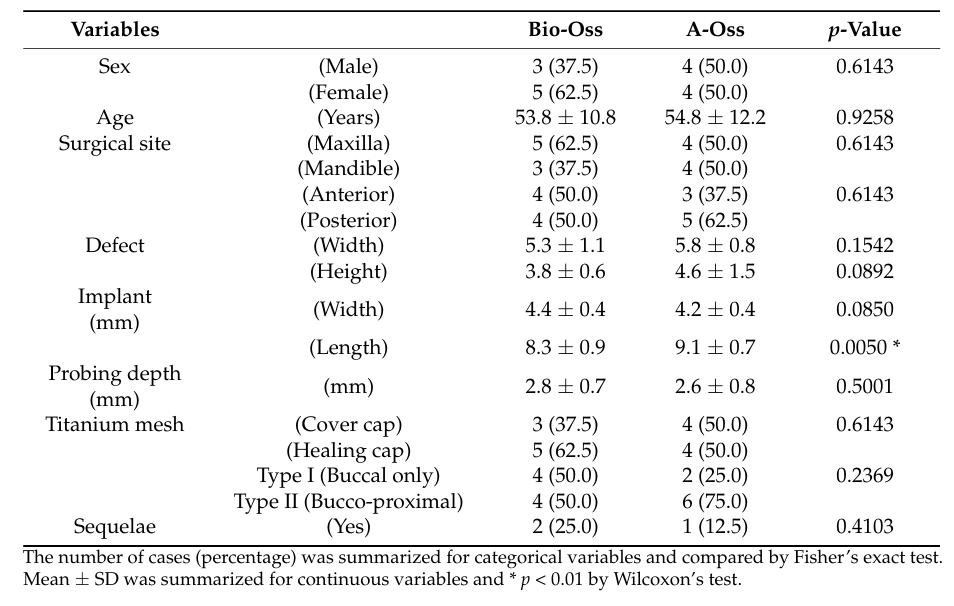
Insgesamt wurden 18 Patienten nacheinander eingeschlossen, und zwei Patienten schieden aus (einer in jeder Gruppe) aufgrund von Verlust der Nachverfolgbarkeit. Schließlich wurden Daten von 16 Patienten (7 Männer und 9 Frauen) mit einem Durchschnittsalter von 54,3 ± 11,7 Jahren (Bereich von 28 bis 72 Jahren) in dieser Studie gesammelt und ausgewertet (Tabelle 1). Der demografische Vergleich zwischen den beiden Gruppen ist in Tabelle 2 dargestellt. Es gab einen signifikanten Unterschied zwischen den Bio-Oss- und A-Oss-Gruppen nur hinsichtlich der Implantatlänge (p < 0,01).
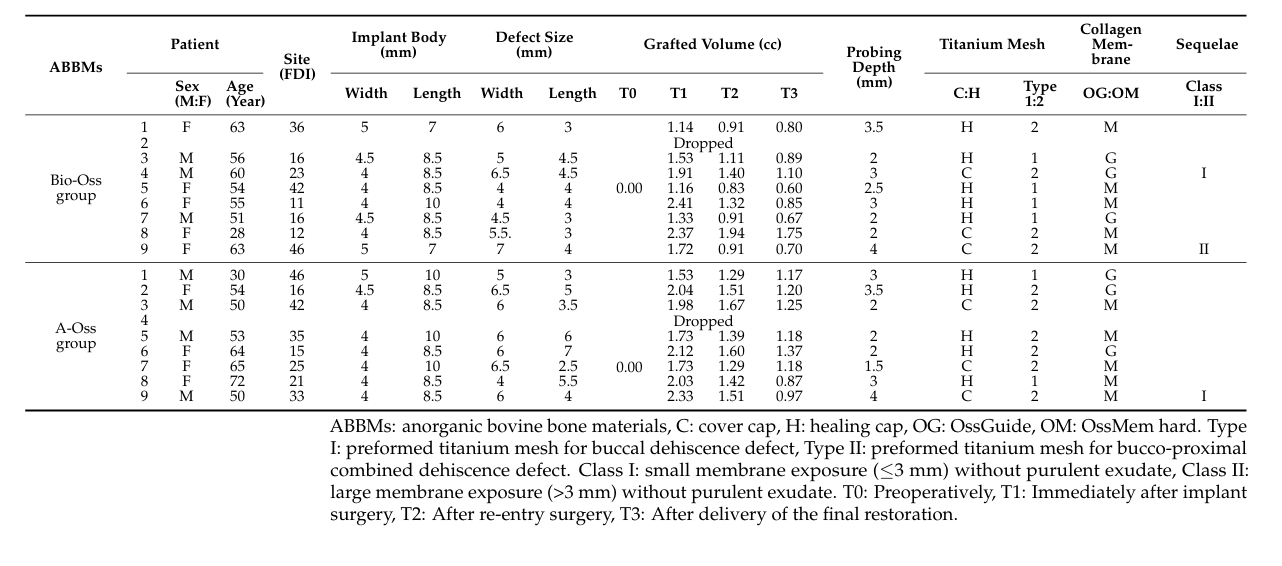
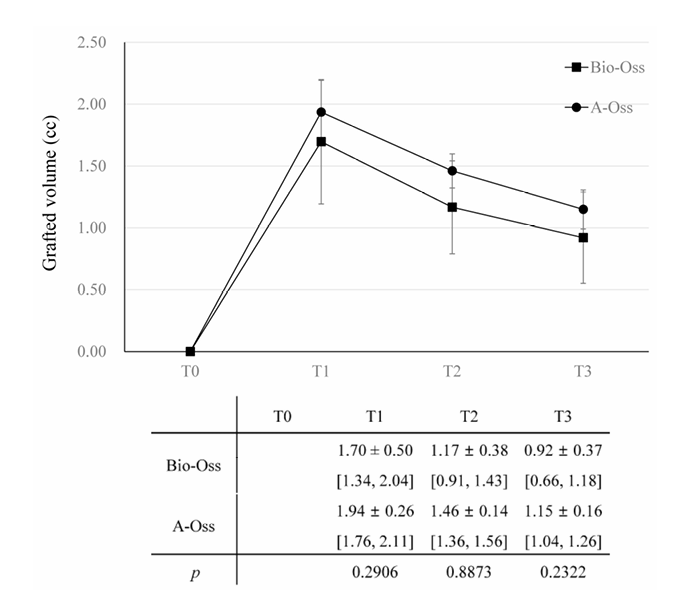
In beiden Gruppen nahm das transplantierte Volumen, das bei 1,70 ± 0,50 cc in der Bio-Oss-Gruppe und 1,94 ± 0,26 cc in der A-Oss-Gruppe zu T1 seinen Höhepunkt erreichte, bis T3 weiter ab. Die transplantierten Volumina reduzierten sich auf 1,17 ± 0,38 cc in der Bio-Oss-Gruppe und 1,46 ± 0,14 cc in der A-Oss-Gruppe bei T2 und 0,92 ± 0,37 cc in der Bio-Oss-Gruppe und 1,15 ± 0,16 cc in der A-Oss-Gruppe bei T3; es gab einen signifikanten Unterschied in den transplantierten Volumina zwischen den Zeiträumen (p < 0,001, Tabelle 3). Es gab jedoch keinen signifikanten Unterschied zwischen den beiden Gruppen zu allen Zeitpunkten (p > 0,05, Abbildung 5). Darüber hinaus gab es keinen signifikanten Unterschied in den Dichten des regenerierten Knochens bei T3 zwischen den Gruppen (p > 0,05).

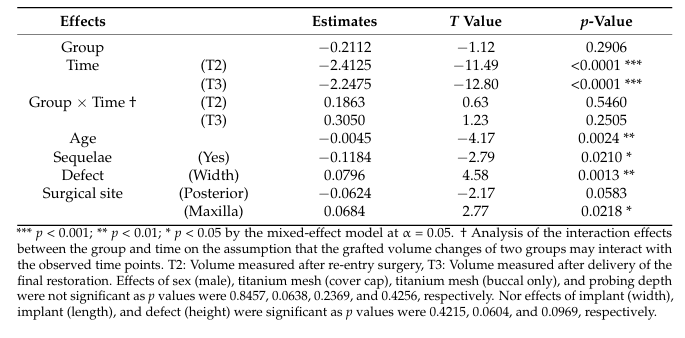
In der Analyse des gemischten Effektmodells wiesen T2 und T3 als Zeiträume (p < 0.001), höheres Alter (p < 0.01) und das Vorhandensein von Sequelae (p < 0.05) auf signifikante Abnahmen des transplantierten Volumens hin; im Gegensatz dazu führten breitere Defekte (p < 0.01) und der Oberkiefer als chirurgischer Standort (p < 0.05) zu geringeren Abnahmen des transplantierten Volumens (Tabelle 4). Postoperative Sequelae wurden bei drei Patienten festgestellt, wobei zwei Patienten (Klasse I und II an den kreisförmigen Nahtstellen) in der Bio-Oss-Gruppe und einer (Klasse I an der bucco-mesialen Kante des Netzes) in der A-Oss-Gruppe waren. Alle postoperativen Sequelae traten in submergierten Fällen mit Abdeckkappen auf, und es gab keinen signifikanten Unterschied zwischen den beiden Gruppen. Die Patienten wurden angewiesen, das Netz vorsichtig und sanft mit einer weichen Zahnbürste, die mit 1% Chlorhexidingel getränkt war, zweimal täglich zu putzen. Trotz fehlender Reepithelisierung, die den exponierten Bereich des Netzes abdeckte, war eine vorzeitige Entfernung dieser exponierten Netze nicht notwendig, und eine erneute Exposition der Implantatgewinde sowie ein erheblicher Verlust des Transplantatmaterials mit Eiterbildung wurden während des gesamten Heilungszeitraums nicht beobachtet; es war kein zusätzliches Transplantat zu T2 erforderlich.
Diskussion
Diese randomisierte kontrollierte Studie wurde entworfen, um das Potenzial von A-Oss zu bewerten, die Knochenmenge und -qualität des regenerierten Knochens durch GBR als niedrigtemperatur-sintertes ABBM im Vergleich zu Bio-Oss aufrechtzuerhalten, und die Nullhypothese von keinen Unterschieden wurde akzeptiert. Trotz der Verwendung von volumenstabilen ABBMs gingen insgesamt 46,0% (0,78 ± 0,37 cc) und 40,8% (0,79 ± 0,33 cc) der transplantierten Volumina während des Prozesses der Substitution durch neuen Knochen in den Bio-Oss- und A-Oss-Gruppen verloren. Eine mögliche Erklärung für die über den Erwartungen liegende Resorption ist, dass das transplantierte Volumen, das zu T1 gemessen wurde, klar durch ein dünnes, röntgendichtes Titannetz auf CBCT-Scans umreißt war, während die undeutliche radiologische Peripherie zwischen den Transplantationsmaterialien und dem Weichgewebe zu einer Unterschätzung des transplantierten Volumens nach der Entfernung des Titannetzes sowohl zu T2 als auch zu T3 führte. Im Vergleich zu 17,3~23,9% Verlust des transplantierten Volumens bis 6 Monate nach der postoperativen Sinuslift-Operation wurde angenommen, dass die Schrumpfung des transplantierten Volumens nach GBR größer war, da der Gesamtdruck des darüberliegenden Weichgewebes höher sein könnte als der intrasinusale pneumatische Druck. Es wurden nur lineare Messungen durchgeführt, um die Dicke des augmentierten Bereichs durch GBR in begrenzten CBCT-Scans zu bewerten, und unsere Ergebnisse sind nicht überraschend, wenn man bedenkt, dass die lineare Reduktion zwischen 20,2% und 42,8% an der Implantatschulter nach der Transplantation von Bio-Oss lag. Wir sollten jedoch zugeben, dass ein konstantes Risiko von Messfehlern aufgrund von Metallartefakten bestand, da verschiedene metallische Komponenten, wie ein Implantatkörper und ein Titannetz, gleichzeitig in CBCT vorhanden waren.
Fokussierung auf die Veränderung des transplantierten Volumens, die Auswirkungen der Existenz von Nachwirkungen und des chirurgischen Standorts zeigten statistisch signifikante Unterschiede (p < 0,05). Mit anderen Worten, wenn die GBR postoperative Komplikationen hatte oder der chirurgische Standort posterior war (vs. anterior, p = 0,0583) und nicht der Oberkiefer (vs. Unterkiefer), war es wahrscheinlicher, dass eine stärkere Resorption des transplantierten Volumens auftrat. Der posterior Bereich des Unterkiefers besteht im Allgemeinen aus hartem Knochen mit einer dickeren Kortikalis, und das Ergebnis der Knochenaugmentation ist weniger vorhersehbar, selbst wenn es mit umfangreichen Knochenmarköffnungen kombiniert wird. Darüber hinaus zeigten die Auswirkungen des Alters und der Defektbreite ebenfalls signifikante Unterschiede (p < 0,01), was bedeutet, dass ältere Patienten und schmalere Dehiszenzdefekte wahrscheinlich eine stärkere Resorption des transplantierten Volumens aufweisen werden. Ältere Patienten neigten dazu, ein höheres Risiko für Implantatversagen mit geringeren Potenzialen zur Knochenregeneration nach GBR zu zeigen, und es gab weniger Resorption an der GBR-Stelle, da mehr Knochenmaterialien in breitere Defekte gepackt und sicher durch ein Titannetz geschützt wurden, was die volumenstabile Eigenschaft von ABBMs maximierte. Vorgeformtes ultrafeines Titannetz war für die ideale Knochenkontur geeignet, insbesondere auf der Höhe des Implantatkopfes, um den Zusammenbruch des Transplantats zu verhindern. Vorausgesetzt, dass der peri-implantäre Defekt innerhalb des ursprünglichen Knochenhauses liegt, haben fenestrationsartige Defekte mehr Knochenfüllung und weniger Komplikationen gezeigt als dehiszenzartige. Daher können wir den signifikanten Einfluss der Defekthöhe auf die Veränderung des transplantierten Volumens nicht feststellen.
Im Gegensatz zu den ABBM zur Volumenbewahrung zeigten allogene Knochentransplantationsmaterialien eine robuste Knochenbildung mit Inseln neuen Knochens, die als Beweis für die Knocheninduktion interpretiert werden könnten, und schienen sich in einem aktiveren Zustand des Umbaus und der Ersetzung zu befinden. Eine Schichtungstechnik unter Verwendung verschiedener Transplantationsmaterialien wird häufig angewendet, um dehiszierte oder unzureichende Alveolarknochen um Zahnimplantate zu augmentieren. Im Allgemeinen wurde autogener Knochen als innere Schicht in engem Kontakt mit dem Implantat verwendet; jedoch wurde auch allogener Knochen verwendet, wenn das Volumen der autogenen Knochenentnahme nicht ausreichte. In dieser Studie wurde eine äußere Schicht von ABBM auf das Allograft gelegt, um den augmentierten Knochen zu erhalten und zu bewahren, und eine dritte Schicht einer resorbierbaren Kollagenmembran wurde platziert, um das Eindringen von Weichgewebe und nicht-osteogenen Zellen in die transplantierte Stelle zu verhindern. Angesichts der Voraussetzung einer Barrieremembran wurde Titanmesh aufgrund seiner Fähigkeit zur Raumgewinnung und Stabilisierung von Blutgerinnseln verwendet, und die darüberliegende resorbierbare Kollagenmembran wurde zur Zellverschlussfähigkeit verwendet, um das vorzeitige Dünnerwerden des darüberliegenden Zahnfleisches zu verhindern, indem die Kompartimente vollständig für die knöcherne und epitheliale Regeneration getrennt wurden. Als nicht-resorbierbare Barrieremembran ist die Entfernung des Titanmesh unvermeidlich; jedoch ist die Nachoperation zur Entfernung eine perfekte Gelegenheit, die Menge und Qualität des regenerierten Knochens zur Bestimmung des Erfolgs der GBR zu bewerten. Allgemein kann die Knochenmenge radiologisch durch 3-dimensionale Rekonstruktion von CBCT-Scans an der GBR-Stelle beurteilt werden, während die Knochenqualität histologisch oder histomorphometrisch bewertet wurde, indem eine Knochenkernbiopsie aus dem regenerierten Kamm entnommen und analysiert wurde. Dennoch wurde in unserer Studie die Knochenqualität grob bewertet, indem die Kortikalisierung der GBR-Stelle während des Nachzugangs unter Verwendung der Sondierungstiefe beurteilt wurde, da es technisch schwierig oder häufig unmöglich war, die Knochenprobe von der rekonstruierten peri-implantären Stelle zu entnehmen. Nach der Entfernung des Titanmesh offenbarte eine genauere Inspektion der geheilten Stelle regeneriertes Hartgewebe, das oberflächlich von einer dünnen Schicht Weichgewebe bedeckt war, die 1–2 mm dick war. Diese Schicht wurde als „Pseudo-Periost“ beschrieben, und die klinische Bedeutung dieser histologisch verbindenden und granulationsgeweblichen Schicht ist unbekannt; jedoch scheint diese dünne Schicht stabil in der Dimension zu sein, und ihre Entfernung war während des Nachzugangs nicht angezeigt. In unserer Studie könnten Sondierungstiefen von 2,8 ± 0,7 mm und 2,6 ± 0,8 mm in den Bio-Oss- und A-Oss-Gruppen jeweils die Dicke des unreifen Knochens, einschließlich des „Pseudo-Periosts“, während des Prozesses der Kortikalisierung unter dem Titanmesh sein. Dieser Ansatz zur Bewertung der Qualität des regenerierten Knochens wird als die Hauptbeschränkung unserer Studie angesehen, und weitere histologische und histomorphometrische Untersuchungen werden erforderlich sein, um den regenerierten Knochen im Detail zu analysieren.
Obwohl während der Heilungsphase keine Re-Epithelialisierung bei kleinen (2 Patienten) und großen (1 Patient) Expositionen von Titanmesh ohne eitrigen Exsudat auftrat, wurde kein Austritt von Transplantatmaterial beobachtet, und es war keine vorzeitige Entfernung des exponierten Titanmesh sowie kein zusätzlicher Transplantatbedarf angezeigt. Allerdings erhöhte sich die Sondierungstiefe auf bis zu 3~4 mm aufgrund der kompensatorischen Anwesenheit eines dickeren „Pseudo-Periosts“, das daran beteiligt war, das Transplantatmaterial sicher in Fällen von exponiertem Titanmesh zu halten. Eine frühere Studie bestätigte ebenfalls, dass die Exposition gegenüber dem Titanmesh keinen negativen Einfluss auf das klinische Ergebnis des Augmentationsverfahrens und den Erfolg des Knochentransplantationsverfahrens hatte. Besonders traten alle postoperativen Folgen in Fällen auf, in denen das Titanmesh mit Abdeckkappen fixiert und stabilisiert wurde, obwohl dies statistisch nicht signifikant war. Da die Abdeckkappen in unserer Studie mit dem Implantat mit geringer primärer Stabilität verbunden waren, könnte mehr Spannung, die aus weniger redundantem Weichgewebe resultiert, einer höheren Inzidenz von postoperativer Wunddehiszenz im submersionierten Ansatz im Vergleich zum nicht-submersionierten Ansatz zugeschrieben werden. Es gab keinen signifikanten Unterschied in den postoperativen Folgen zwischen den Bio-Oss- und A-Oss-Gruppen.
Schlussfolgerungen
Innerhalb der Grenzen dieser Studie kann festgestellt werden, dass
- Ein peri-implantäres Dehiszenzdefekt erfolgreich durch GBR mit Doppelbeschichtung von Allograft und ABBM rekonstruiert wurde, die mit einem vorgeformten ultrafeinen Titannetz und einer resorbierbaren Kollagenmembran abgedeckt wurden;
- Trotz des Volumenstabilisierungseffekts von ABBMs wurde bei T2 eine Resorption des transplantierten Volumens von etwa 27,8 % festgestellt, und es gab keinen signifikanten Unterschied zwischen den Bio-Oss- und A-Oss-Gruppen, selbst in der Qualität des regenerierten Knochens;
- Der Verlust des transplantierten Volumens (etwa 43,2 %) setzte sich bis T3 fort und unterschied sich nicht zwischen den Bio-Oss- und A-Oss-Gruppen.
JaeHyung Lim, SangHo Jun, Marco Tallarico, Jun-Beom Park, Dae-Ho Park, Kyung-Gyun Hwang und Chang-Joo Park
Literaturverzeichnis
- Pjetursson, B.E.; Thoma, D.; Jung, R.; Zwahlen, M.; Zembic, A. Eine systematische Übersicht über die Überlebens- und Komplikationsraten von implantatgetragenen festen Zahnprothesen (FDPs) nach einer durchschnittlichen Beobachtungszeit von mindestens 5 Jahren. Clin. Oral Implant. Res. 2012, 23, 22–38. [CrossRef] [PubMed]
- Urban, I.; Caplanis, N.; Lozada, J.L. Gleichzeitige vertikale geführte Knochenregeneration und geführte Gewebe-Regeneration im posterioren Oberkiefer unter Verwendung von rekombinantem menschlichem plättchenabgeleitetem Wachstumsfaktor: Ein Fallbericht. J. Oral Implantol. 2009, 35, 251–256. [CrossRef]
- Adeyemo, W.; Reuther, T.; Bloch, W.; Korkmaz, Y.; Fischer, J.H.; Zöller, J.E.; Kuebler, A.C. Heilung von Onlay-Unterkieferknochen-Transplantaten, die mit einer Kollagenmembran oder bovinen Knochenersatzstoffen abgedeckt sind: Eine mikroskopische und immunhistochemische Studie bei Schafen. Int. J. Oral Maxillofac. Surg. 2008, 37, 651–659. [CrossRef] [PubMed]
- Block, M.S.; Kaleem, A. Verwendung von gesintertem Xenograft über Allograft zur Erhöhung des Kamms: Techniknotiz. J. Oral Maxillofac. Surg. 2014, 72, 496–502. [CrossRef] [PubMed]
- Buser, D.; Chappuis, V.; Kuchler, U.; Bornstein, M.; Wittneben, J.; Buser, R.; Cavusoglu, Y.; Belser, U.C. Langfristige Stabilität der frühen Implantatplatzierung mit Konturerhöhung. J. Dent. Res. 2013, 92, 176S–182S. [CrossRef] [PubMed]
- Jensen, S.S.; Bosshardt, D.D.; Gruber, R.; Buser, D. Langfristige Stabilität der Konturerhöhung in der ästhetischen Zone: Histologische und histomorphometrische Bewertung von 12 menschlichen Biopsien 14 bis 80 Monate nach der Augmentation. J. Periodontol. 2014, 85, 1549–1556. [CrossRef] [PubMed]
- Cho, Y.S.; Hwang, K.G.; Jun, S.H.; Tallarico, M.; Kwon, A.M.; Park, C.J. Radiologische vergleichende Analyse zwischen Kochsalzlösung und plättchenreichem Fibrinfüllung nach hydraulischem transcrestalen Sinuslifting ohne ergänzendes Knochenimplantat: Eine randomisierte kontrollierte Studie. Clin. Oral Implant. Res. 2020, 31, 1087–1093. [CrossRef]
- Nevins, M.; Nevins, M.L.; Kim, S.-W.; Schupbach, P.; Kim, D.M. Die Verwendung von Mucograft-Kollagenmatrix zur Augmentierung der Zone des keratinisierten Gewebes um Zähne: Eine Pilotstudie. Int. J. Periodontics Restor. Dent. 2011, 31, 367–373.
- Lee, J.S.; Shin, H.K.; Yun, J.H.; Cho, K.S. Randomisierte klinische Studie zur maxillären Sinusverpflanzung unter Verwendung von deproteiniertem Schweine- und Rindknochenmineral. Clin. Implant. Dent. Relat. Res. 2017, 19, 140–150. [CrossRef] [PubMed]
- Susin, C.; Lee, J.; Fiorini, T.; Koo, K.T.; Schüpbach, P.; Angst, P.D.; Finger Stadler, A.; Wikesjö, U.M. Screening von Kandidatenbiomaterialien für die alveoläre Augmentation unter Verwendung eines kritischen Rattenkalvarien-Defektmodells. J. Clin. Periodontol. 2018, 45, 884–893. [CrossRef]
- Amara, H.B.; Lee, J.-W.; Kim, J.-J.; Kang, Y.-M.; Kang, E.-J.; Koo, K.-T. Einfluss von rhBMP-2 auf die geführte Knochenregeneration für die Platzierung und funktionelle Belastung von Zahnimplantaten: Eine radiografische und histologische Studie bei Hunden. Int. J. Oral Maxillofac. Implant. 2017, 32, e265–e276. [CrossRef] [PubMed]
- Cho, J.S.; Kim, H.S.; Um, S.H.; Rhee, S.H. Vorbereitung eines neuartigen anorganischen bovinen Knochen-Xenografts mit verbesserter Bioaktivität und Osteokonduktivität. J. Biomed. Mater. Res. Part B Appl. Biomater. 2013, 101, 855–869. [CrossRef] [PubMed]
- Her, S.; Kang, T.; Fien, M.J. Titanmesh als Alternative zu einer Membran für die Kammaugmentation. J. Oral Maxillofac. Surg. 2012, 70, 803–810. [CrossRef]
- Louis, P.J.; Gutta, R.; Said-Al-Naief, N.; Bartolucci, A.A. Rekonstruktion des Oberkiefers und Unterkiefers mit partikulärem Knochen-Transplantat und Titanmesh für die Implantatplatzierung. J. Oral Maxillofac. Surg. 2008, 66, 235–245. [CrossRef] [PubMed]
- Rakhmatia, Y.D.; Ayukawa, Y.; Furuhashi, A.; Koyano, K. Aktuelle Barrieremembranen: Titanmesh und andere Membranen für die geführte Knochenregeneration in zahnmedizinischen Anwendungen. J. Prosthodont. Res. 2013, 57, 3–14. [CrossRef]
- Jung, G.-U.; Jeon, J.-Y.; Hwang, K.-G.; Park, C.-J. Vorläufige Bewertung eines dreidimensionalen, maßgeschneiderten und vorgeformten Titannetzes in der peri-implantären alveolären Knochenregeneration. J. Korean Assoc. Oral Maxillofac. Surg. 2014, 40, 181. [CrossRef]
- Lee, S.-H.; Moon, J.-H.; Jeong, C.-M.; Bae, E.-B.; Park, C.-E.; Jeon, G.-R.; Lee, J.-J.; Jeon, Y.-C.; Huh, J.-B. Die mechanischen Eigenschaften und der biometrische Effekt einer 3D-vorgeformten Titanmembran für die geführte Knochenregeneration bei alveolären Knochendefekten. BioMed Res. Int. 2017, 2017, 7102123. [CrossRef]
- Tallarico, M.; Ceruso, F.M.; Muzzi, L.; Meloni, S.M.; Kim, Y.-J.; Gargari, M.; Martinolli, M. Einfluss der gleichzeitigen sofortigen Implantatplatzierung und geführten Knochenrekonstruktion mit ultrafeinen Titanmembranen auf radiografische und klinische Parameter nach 18 Monaten Belastung. Materials 2019, 12, 1710. [CrossRef] [PubMed]
- Fontana, F.; Maschera, E.; Rocchietta, I.; Simion, M. Klinische Klassifikation von Komplikationen bei Verfahren zur geführten Knochenregeneration mittels einer nicht resorbierbaren Membran. Int. J. Periodontics Restor. Dent. 2011, 31, 265.
- Liyanage, L.; Lee, N.J.; Cook, T.; Herrmann, H.C.; Jagasia, D.; Litt, H.; Han, Y. Der Einfluss des Geschlechts auf die Verkalkung des Herz-Kreislaufsystems bei sehr alten Patienten mit schwerer Aortenstenose. Int. J. Cardiovasc. Imaging 2016, 32, 173–179. [CrossRef]
- Lodewick, T.M.; Arnoldussen, C.W.; Lahaye, M.J.; van Mierlo, K.M.; Neumann, U.P.; Beets-Tan, R.G.; Dejong, C.H.; van Dam, R.M. Schnelle und genaue Lebervolumenmessung vor der Hepatektomie. HPB 2016, 18, 764–772. [CrossRef] [PubMed]
- Pang, K.-M.; Lee, J.-K.; Choi, S.-H.; Kim, Y.-K.; Kim, B.-J.; Lee, J.-H. Maxilläre Sinusaugmentation mit calciumphosphat-doppelt beschichtetem anorganischen bovinen Knochen: Vergleichende multizentrische randomisierte klinische Studie mit histologischer und radiografischer Bewertung. Implant. Dent. 2019, 28, 39–45. [CrossRef] [PubMed]
- Mir-Mari, J.; Wui, H.; Jung, R.E.; Hämmerle, C.H.; Benic, G.I. Einfluss der blinden Wundverschluss auf die Volumenstabilität verschiedener GBR-Materialien: Eine in vitro Untersuchung mit konischer Strahlung. Clin. Oral Implant. Res. 2016, 27, 258–265. [CrossRef] [PubMed]
- Ohe, J.Y.; Kim, G.T.; Lee, J.W.; Al Nawas, B.; Jung, J.; Kwon, Y.D. Volumenstabilität von Hydroxylapatit und β-Tricalciumphosphat biphasischem Knochenmaterial bei der Elevation des maxillären Sinusbodens: Eine radiografische Studie mit 3D-konischer Strahlentomographie. Clin. Oral Implant. Res. 2016, 27, 348–353. [CrossRef] [PubMed]
- Mir-Mari, J.; Benic, G.I.; Valmaseda-Castellón, E.; Hämmerle, C.H.; Jung, R.E. Einfluss des Wundverschlusses auf die Volumenstabilität von partikulären und nicht-partikulären GBR-Materialien: Eine in vitro Untersuchung mit konischer Strahlentomographie. Teil II. Clin. Oral Implant. Res. 2017, 28, 631–639. [CrossRef] [PubMed]
- Esposito, M.; Maghaireh, H.; Grusovin, M.G.; Ziounas, I.; Worthington, H.V. Weichgewebemanagement für Zahnimplantate: Was sind die effektivsten Techniken? Eine Cochrane-Systematische Übersicht. Eur. J. Oral. Implant. 2012, 5, 221–238.
- Jemt, T. Implantatfehler und Alter zum Zeitpunkt der Operation: Eine retrospektive Studie zur Implantatbehandlung in 2915 teilweise zahnlosen Kiefern. Clin. Implant. Dent. Relat. Res. 2019, 21, 686–692. [CrossRef] [PubMed]
- Jensen, S.S.; Terheyden, H. Knochenaugmentation bei lokalisierten Defekten im Alveolarkamm: Klinische Ergebnisse mit verschiedenen Knochen-Transplantaten und Knochenersatzmaterialien. Int. J. Oral Maxillofac. Implant. 2009, 24, 218–236.
- Scheyer, E.T.; Heard, R.; Janakievski, J.; Mandelaris, G.; Nevins, M.L.; Pickering, S.R.; Richardson, C.R.; Pope, B.; Toback, G.; Velásquez, D.; et al. Eine randomisierte, kontrollierte, multizentrische klinische Studie zur Erhaltung des alveolären Kamms nach der Extraktion. J. Clin. Periodontol. 2016, 43, 1188–1199. [CrossRef]
- Wang, H.-L.; Misch, C.; Neiva, R.F. „Sandwich“-Knochenaugmentationstechnik: Begründung und Bericht über Pilotfälle. Int. J. Periodontics Restor. Dent. 2004, 24, 232–245.
- Sarnachiaro, G.O.; Chu, S.J.; Sarnachiaro, E.; Gotta, S.L.; Tarnow, D.P. Sofortige Implantatplatzierung in Extraktionssocket mit labialen Platten-Dehiszenzdefekten: Eine klinische Fallserie. Clin. Implant. Dent. Relat. Res. 2016, 18, 821–829. [CrossRef]
- Meloni, S.M.; Jovanovic, S.A.; Urban, I.; Baldoni, E.; Pisano, M.; Tallarico, M. Horizontale Kammaugmentation unter Verwendung von GBR mit einer nativen Kollagenmembran und einem Verhältnis von 1:1 von partikulärem Xenograft und autologem Knochen: Eine prospektive klinische Studie 3 Jahre nach der endgültigen Belastung. Clin. Implant. Dent. Relat. Res. 2019, 21, 669–677. [CrossRef] [PubMed]
- Cucchi, A.; Sartori, M.; Parrilli, A.; Aldini, N.N.; Vignudelli, E.; Corinaldesi, G. Histologische und histomorphometrische Analyse von Knochengewebe nach geführter Knochenregeneration mit nicht-resorbierbaren Membranen vs. resorbierbaren Membranen und Titanmesh. Clin. Implant. Dent. Relat. Res. 2019, 21, 693–701. [CrossRef]
- Proussaefs, P.; Lozada, J. Verwendung von Titanmesh für die gestufte lokale alveoläre Kammaugmentation: Klinische und histologische-histomorphometrische Bewertung. J. Oral Implantol. 2006, 32, 237–247. [CrossRef]
- Sagheb, K.; Schiegnitz, E.; Moergel, M.; Walter, C.; Al-Nawas, B.; Wagner, W. Klinisches Ergebnis der alveolären Kammaugmentation mit individualisiertem CAD-CAM-produziertem Titanmesh. Int. J. Implant. Dent. 2017, 3, 1–7. [CrossRef] [PubMed]
