Histomorphometrie des Knochens nach absichtlich exponierter nicht resorbierbarer d-PTFE-Membran oder geführter Knochenregeneration zur Behandlung post-extraktiver alveolärer Knochendefekte mit implantatgestützten Restaurationen: Eine pilotierte rando...
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Zusammenfassung
Ziel: Ziel der vorliegenden Studie war es, die quantitative histologische Untersuchung von Knochen zu untersuchen, der mit einer nicht resorbierbaren hochdichten Polytetrafluorethylen-Membran (d-PTFE) rekonstruiert wurde, die absichtlich in nach der Extraktion graftierten Alveolen mit anorganischem Knochenmaterial exponiert gelassen und nach vier Wochen entfernt wurde, im Vergleich zur Extraktion und geführten Knochenregeneration (GBR), die zwei Monate später durchgeführt wurde.
Materialien und Methoden: Diese Studie wurde als multizentrische, randomisierte kontrollierte Studie mit parallelem Gruppendesign konzipiert. Patienten wurden ausgewählt und nacheinander in drei Zentren in Italien behandelt. Die Patienten erhielten zufällig entweder die absichtlich exponierte nicht resorbierbare d-PTFE-Membran (Gruppe A) oder die geführte Knochenregeneration (Gruppe B), um post-extraktive alveoläre Knochendefekte mit implantatgetragenen Restaurationen zu behandeln. Die Ergebnisse waren: das Implantatversagen, alle mechanischen und biologischen Komplikationen, die Patientenzufriedenheit sowie die qualitative und histomorphometrische Bewertung der gesammelten Knochenproben.
Ergebnisse: Achtzehn Patienten wurden nacheinander in die Studie aufgenommen. Davon waren sechs von 18 Patienten männlich. Alle eingeschlossenen Patienten wurden gemäß den zugewiesenen Interventionen behandelt, und es gab keinen Abbruch. Es traten keine Implantatfehler und keine Komplikationen auf, und alle Patienten waren mit der Funktion und Ästhetik ihrer implantatgestützten Restauration voll zufrieden, ohne Unterschiede zwischen den Gruppen. Die morphologische Analyse zeigte keine Anzeichen einer Gewebereaktion, wie Fibrose oder Nekrose. Der regenerierte Knochen war in beiden Gruppen gut mineralisiert, schien jedoch in Gruppe B reifer als in Gruppe A. Drei Proben zeigten eine minimale Anzahl von Lymphozyten. Mehrere kleine Blutgefäße besetzten die Markräume, wo das Gewebe eine höhere Reife aufwies, was auf die Aktivität des Gewebes hinweist. Die histomorphometrische Bewertung zeigte keine statistisch signifikanten Unterschiede in den Gewebevolumenfraktionen zwischen den beiden Patientengruppen.
Fazit: Mit den Einschränkungen der vorliegenden Studie ist die Rekonstruktion der Wangenplatte mit einer absichtlich exponierten nicht resorbierbaren Membran ein effektives und einfaches Verfahren zur Regeneration einer resorbierten Wangenknochenplatte, wodurch der Bedarf an geführter Knochenregeneration verringert wird.
Einleitung
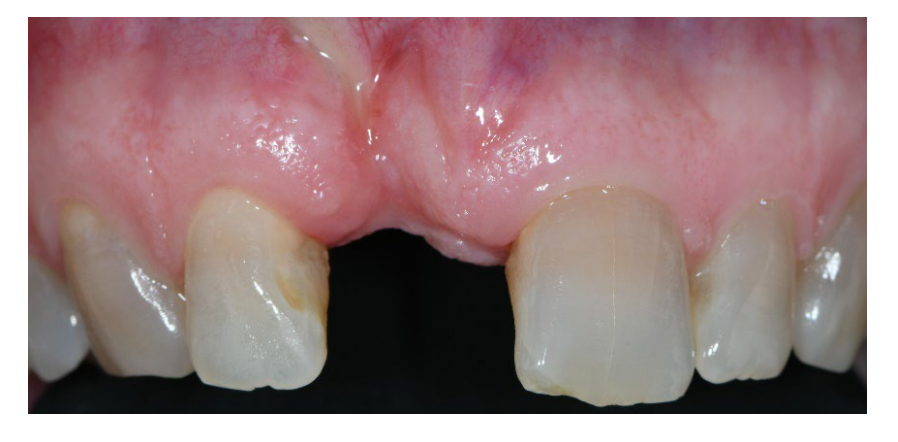
Der Verlust des Alveolarknochens kann auf verschiedene Faktoren zurückgeführt werden, wie endodontische Pathologie, Parodontitis, Gesichtsverletzungen und aggressive Manöver während der Extraktionen. Darüber hinaus tritt nach der Zahnextraktion eine Kaskade biologischer Ereignisse auf, die typischerweise zu erheblichen lokalen anatomischen Veränderungen führt, einschließlich reduzierter Höhe und reduzierter Breite des verbleibenden Kamms. Der horizontale Knochenverlust ist in der Regel am größten und tritt häufiger auf der Wangenseite auf. Günstige Implantaterfolgsraten und peri-implantäre Gewebereaktionen können erzielt werden, indem Implantate unmittelbar nach der Zahnextraktion eingesetzt werden, jedoch wurde eine fortschreitende Rezession des Gesichtsgewebes beobachtet. Um die ästhetische Vorhersagbarkeit von post-extraktiven Implantaten zu verbessern, wurden mehrere Studien und systematische Übersichten durchgeführt, um die Wirksamkeit verschiedener Ansätze zur Füllung von Alveolen mit unterschiedlichen Transplantatmaterialien, mit oder ohne Barrieremembranen, zu bewerten. In diesen Studien wurden eine Vielzahl von Biomaterialien verwendet, darunter autologes Knochenmaterial, Knochenersatzstoffe (Allografts, Xenografts und Alloplasten) sowie autologe blutabgeleitete Produkte und bioaktive Substanzen. Neuere klinische Studien und systematische Übersichten konnten jedoch keine Hinweise darauf finden, dass ein Biomaterial und eine Barrieremembran anderen überlegen waren. Mit den Einschränkungen dieser Studie war die Verwendung von nicht resorbierbaren Membranen aus hochdichtem Polytetrafluorethylen (d-PTFE) sicher und vorhersehbar, insbesondere in Bezug auf die Breite des keratinisierten Gewebes.
Die gleichen Studien empfehlen gut durchgeführte randomisierte kontrollierte Studien.
Elian et al. schlugen eine vereinfachte Klassifikation von Alveolen und einen nicht-invasiven Ansatz für die Transplantation und das Management von Alveolen vor, wenn Weichgewebe vorhanden ist, aber die buccale Platte kompromittiert ist (Typ II). Die Autoren verwendeten Kollagenmembranen und Transplantationsmaterialien zur Behandlung von Alveolen des Typs II. Eine aktuelle systematische Überprüfung kam zu dem Schluss, dass PTFE-Membranen das Transplantationsmaterial und/oder den anfänglichen Heilungsgerinnsel vor bakterieller Kontamination schützen, was zu einer erfolgreichen Regeneration ohne ein signifikantes Risiko einer Infektion führt.
Das Ziel der vorliegenden randomisierten kontrollierten Studie war es, die quantitative histologische Untersuchung von Knochen zu untersuchen, der mit einer d-PTFE-Membran rekonstruiert wurde, die absichtlich in nach der Extraktion mit anorganischem Knochenmaterial transplantierten Alveolen exponiert gelassen und nach vier Wochen entfernt wurde, im Vergleich zur Extraktion und geführten Knochenregeneration (GBR), die zwei Monate später durchgeführt wurde. Die Nullhypothese war, dass es keine statistischen Unterschiede hinsichtlich der qualitativen und histomorphometrischen Bewertung der Proben zwischen den Gruppen gab. Die Nullhypothese wurde gegen die alternative Hypothese eines Unterschieds getestet. Die vorliegende Forschung wurde gemäß den CONSORT-Richtlinien verfasst.
Materialien und Methoden
Diese Studie wurde als Pilotstudie, multizentrische, randomisierte kontrollierte Studie mit parallelem Design konzipiert, um die Histomorphometrie des Knochens und klinische Parameter von Patienten mit hoffnungslosen Zähnen im Unter- und Oberkiefer, die sich zwischen den Prämolaren befinden und eine verzögerte implantatgestützte Einzelkrone benötigen, zu bewerten. Die Patienten wurden ausgewählt und nacheinander in drei Zentren in Italien von November 2018 bis September 2020 behandelt.
Drei Kliniker führten sowohl chirurgische als auch prothetische Verfahren durch. Die Kalibrierung der Chirurgen stellte sicher, dass sie jeweils zwei ergänzende klinische Fälle durchführten, um potenzielle chirurgische Risiken zu schätzen und zu reduzieren. Diese Studie wurde in Übereinstimmung mit den in der Helsinkier Deklaration von 1964 für biomedizinische Forschung mit menschlichen Probanden festgelegten Prinzipien durchgeführt, die in der 64. WMA-Generalversammlung, Fortaleza, Brasilien, Oktober 2013, geändert wurden, und erhielt die ethische Genehmigung des „Ethikkomitees Lazio 1“. Protokollnummer 23/CE Lazio 1, vom 7. Januar 2020. Die Patienten wurden ordnungsgemäß über die Natur der Studie informiert. Ein schriftliches Einwilligungsformular für chirurgische und prothetische Verfahren sowie für die Verwendung der klinischen und radiologischen Daten wurde für jeden Patienten vor Beginn der Behandlungen eingeholt.
Ein- und Ausschlusskriterien
Jedes Subjekt, das mindestens eine implantatgestützte Einzelrestauration zwischen den Prämolaren benötigt, um einen fehlgeschlagenen Zahn mit einer beschädigten bukkalen Knochenplatte, aber erhaltenem Weichgewebe-Architektur (Typ II gemäß Elian et al.), zu ersetzen, mindestens 18 Jahre alt ist und in der Lage ist, ein Einwilligungsformular zu unterschreiben, wurde als für diese Studie geeignet erachtet und nacheinander eingeschlossen. Aussichtslos beurteilte Zähne wurden wie folgt bewertet: Furkationsbeteiligung > II; Mobilität > II; PPD > 6 mm mit dem Prozentsatz des alveolären Knochenverlusts/Wurzel-Länge ≥70%; persistierende radiografische Pathologie und/oder Symptome (z.B. Schmerzen, Fistel, Abszess) endodontischen Ursprungs und eine ungewisse Prognose; Wiederherstellbarkeit.
Jeder Patient trug nur mit einem Verfahren bei. Die ausgewählte Stelle musste benachbarte Zähne/Implantate haben. Ausschlusskriterien waren:
- Allgemeine Kontraindikationen für orale Chirurgie (wie ASA III und IV);
- Starke Raucher (≥ 10 Zigaretten/Tag);
- Abhängigkeit von Alkohol oder Drogen;
- Akute und chronische Infektionen an der Stelle, die für die Implantation vorgesehen ist;
- Schlechte Mundhygiene (vollständiger Mundblutungs- und vollständiger Mundplaqueindex höher als 25%);
- Schwangerschaft oder Stillzeit;
- Psychiatrische Therapie;
- Patienten, die mit intravenösen Aminobisphosphonaten behandelt wurden oder unter Behandlung stehen;
- Vorherige Strahlentherapie der oralen und kraniofazialen Region innerhalb der letzten 5 Jahre;
- Patienten, die nicht in der Lage sind, sich zu den geplanten Nachuntersuchungen zu verpflichten.
Klinische Verfahren
Potenziell geeignete Patienten wurden klinisch bewertet, und ihre medizinischen Vorgeschichten wurden dokumentiert. Während des Besuchs wurden präoperative periapikale Röntgenaufnahmen, Studienmodelle und Bilder angefertigt, und das parodontal Screening wurde aufgezeichnet.
Die Patienten erhielten vor der Operation eine professionelle Mundhygiene und erhielten prophylaktisch ein Antiseptikum (0,2% Chlorhexidin Mundspülung eine Minute vor der Operation) sowie eine Antibiotikatherapie (zwei g Amoxicillin und Clavulansäure oder Clindamycin 600 mg bei Penicillinallergie, eine Stunde vor der Operation). Alle Patienten wurden unter örtlicher Betäubung mit Articainhydrochlorid und Adrenalin 1:100.000 (Orabloc, Pierrel, Mailand, Italien) behandelt. Die Zahnextraktionen wurden flaplos und so atraumatisch wie möglich durchgeführt. Mehrwurzelige Zähne wurden an der Furkation sectioniert, und die Wurzeln wurden einzeln extrahiert. Anschließend wurde die verbleibende Extraktionsstelle mit einer Kochsalzlösung gespült und gründlich von Granulationsgewebe und verbleibenden parodontalen Fasern gereinigt. Schließlich wurde die knöcherne Wand mit Hilfe einer parodontalen Sonde (PCPUNC156, Hu-Friedy) bewertet. Danach wurden die Patienten, die alle Einschlusskriterien erfüllten, endgültig eingeschrieben, und ein nummierter, versiegelter Umschlag, der der Patientenrekrutierungsnummer entsprach, wurde von einem verblindeten unabhängigen Assistenten geöffnet, um die Zuteilungsgruppe zu erfahren.
In Gruppe A wurde die Socket-Erhaltung mit absichtlich exponierter nicht resorbierbarer d-PTFE-Membran (Testgruppe, Abbildungen 1–4) durchgeführt, der verbleibende alveoläre Socket wurde mit porzinen-derived cancellous anorganischem Knochenmaterial (0,25–1 mm Partikel, Zcore, DeOre s.r.l., Negrar [Vr], Italien) augmentiert. Anschließend wurde eine nicht resorbierbare, dichte Polytetrafluorethylen (d-PTFE) Membran (Cytoplast TXT1224, DeOre) entsprechend der Dimension des verbleibenden Sockets geformt und in eine buccale und linguale Tasche eingesetzt. Schließlich wurde eine horizontale Matratzennaht (Cytoplast PTFE Suture 4-0, DeOre) angebracht, um die Membran zu sichern und sie an den Weichgewebsrand zu stabilisieren. Die Anwendung der nicht resorbierbaren d-PTFE-Membran erforderte keinen primären Verschluss durch Vorverlagerung des buccalen Lappens. Die Nähte wurden zwischen 10 und 14 Tagen nach der Operation entfernt, und die nicht resorbierbare d-PTFE-Membran wurde zwischen der vierten und der fünften Woche nach der Operation entfernt. Danach wurde die Wunde etwa fünf Monate lang zur Heilung gelassen, was durch den Prozess der Re-Epithelialisierung ermöglicht wurde.
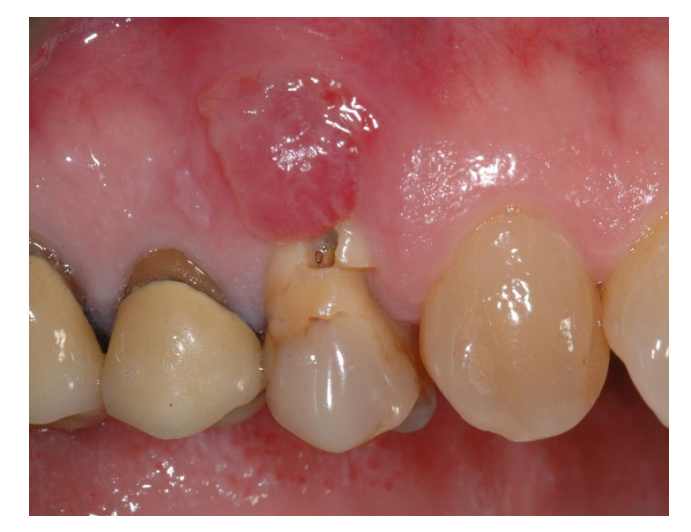
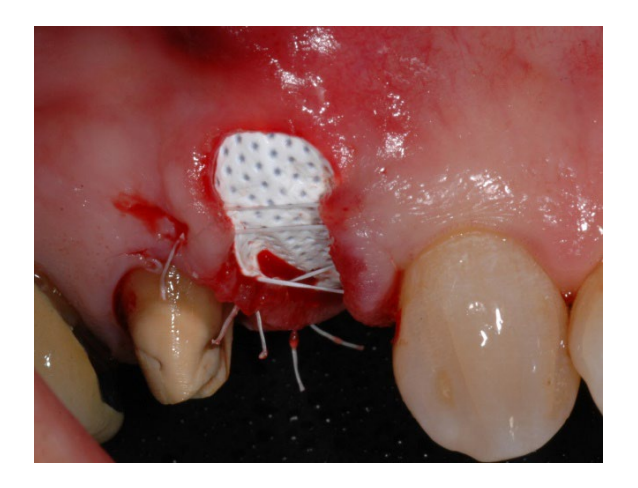
In Gruppe B wurde in der GBR (Kontrollgruppe, Abbildungen 5–8) lediglich ein Fibrin-Schwamm in die Alveole eingesetzt, um das Blutgerinnsel zu stabilisieren.
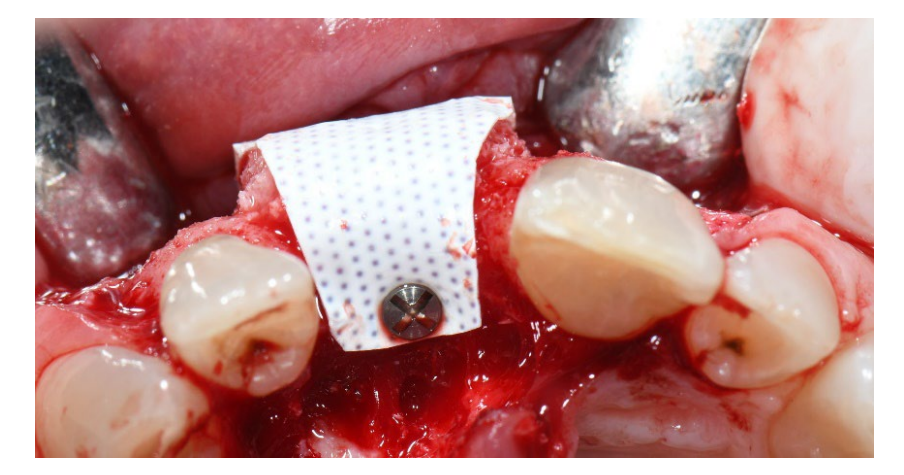
In beiden Gruppen wurde 1 g Amoxicillin (oder 300 mg Clindamycin) alle 12 Stunden für sechs Tage nach der Zahnextraktion und der Knochenrekonstruktion verabreicht. Paracetamol 500 mg plus Codein 30 mg wurden nach Bedarf verschrieben. Den Patienten wurde geraten, diese nicht in Abwesenheit von Schmerzen einzunehmen. Chlorhexidin-Spray 0,2 % wurde in Gruppe A und B jeweils zweimal täglich für zwei und fünf Wochen verschrieben. Eine weiche Diät wurde für zwei Wochen nach den chirurgischen Eingriffen in beiden Gruppen empfohlen.
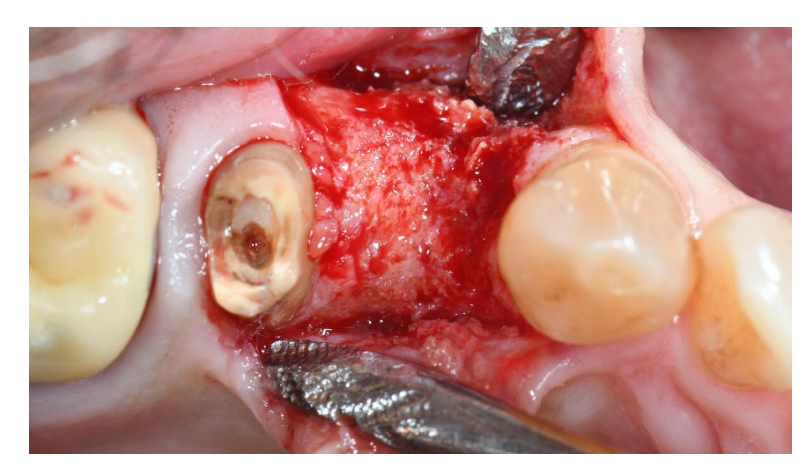
In Gruppe B wurde acht Wochen nach der Zahnextraktion ein intrasulcularer Schnitt mit einer Nr. 15C Bard-Parker-Klinge durchgeführt, und ein Volldicklappen wurde über die mukogingivale Grenze und mindestens 5 mm über den Knochendefekt hinaus angehoben. Zwei vertikale Schnitte wurden mindestens einen Zahn von dem zu augmentierenden Bereich entfernt gesetzt. Mehrere Dekortikationslöcher an der Empfängerstelle wurden mit einem runden Bohrer durchgeführt. Die verbleibende alveoläre Socket wurde mit Partikeln von porzinen-derived spongiösem anorganischem Knochenmaterial (Zcore, DeOre) transplantiert. Dann wurde eine Kollagenmembran (Cytoplast RTM Collagen, DeOre) entsprechend dem regenerierten Knochendefekt geformt und mit drei bis fünf Titanstiften (Supertack, MCbio s.r.l., Lomazzo, Italien) an der buccalen und lingualen/palatalen Seite fixiert. Die Membran wurde auf das gesamte Transplantatvolumen zugeschnitten, ein bis zwei Millimeter vor der Oberfläche der benachbarten Zähne. Ein periostaler Schnitt wurde zwischen den beiden vertikalen Schnitten durchgeführt, um eine vollständig spannungsfreie Schließung des Lappens zu ermöglichen. Die Lappen wurden dann in zwei Schichten genäht, um eine Exposition der Membran (Cytoplast PTFE Suture 4-0) zu verhindern. Zuerst wurden horizontale Matratzennähte 4 mm von der Schnittlinie gesetzt; dann wurden einzelne unterbrochene Nähte gesetzt, um die Ränder des Lappens zu schließen. Vertikale Schnitte wurden mit einzelnen unterbrochenen Nähten genäht. Die einzelnen unterbrochenen Nähte wurden zwischen 10 und 14 Tagen nach der Operation entfernt, und die Matratzennähte wurden zwei bis drei Wochen nach der Operation entfernt. Ein g Amoxicillin (oder 300 mg Clindamycin) wurde alle 12 Stunden für acht Tage nach der Zahnextraktion und der Knochenrekonstruktion verabreicht. Paracetamol 500 mg plus Codein 30 mg wurden nach Bedarf verschrieben. Den Patienten wurde geraten, diese nicht in Abwesenheit von Schmerzen einzunehmen.
Chlorhexidin-Spray 0,2% zweimal täglich für zwei bzw. fünf Wochen wurde in den Gruppen A und B verschrieben. Eine weiche Diät wurde für 2 Wochen nach den chirurgischen Eingriffen in beiden Gruppen empfohlen.
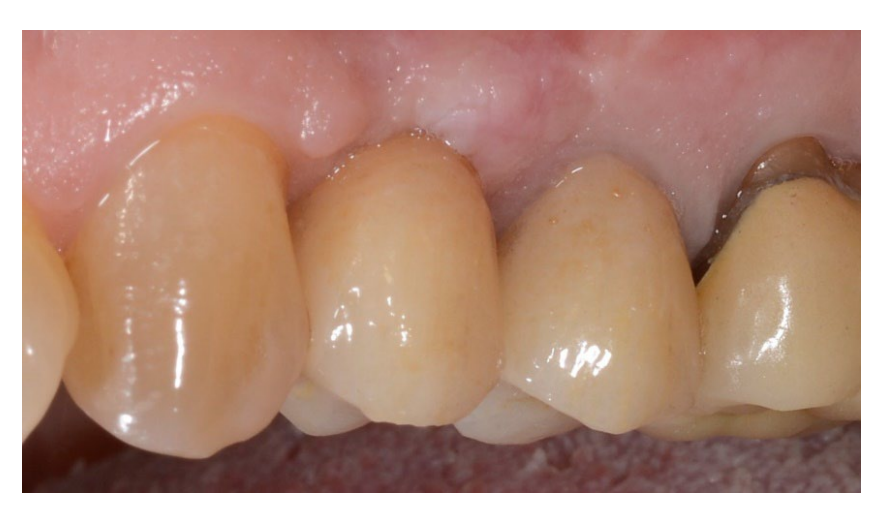
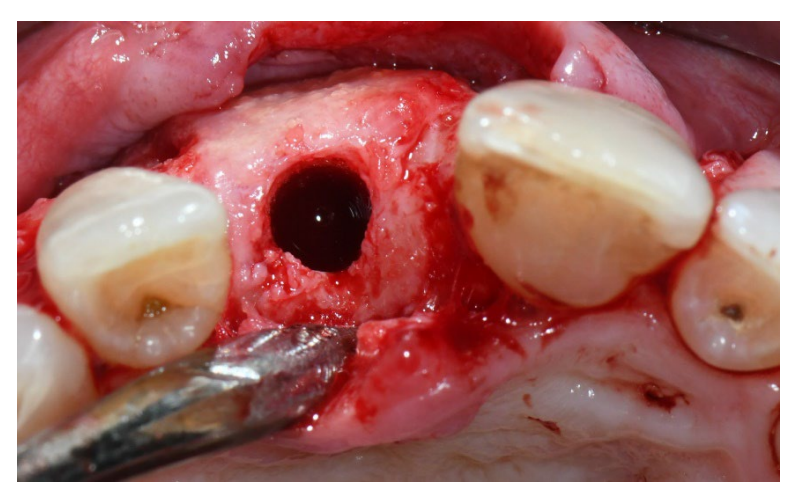
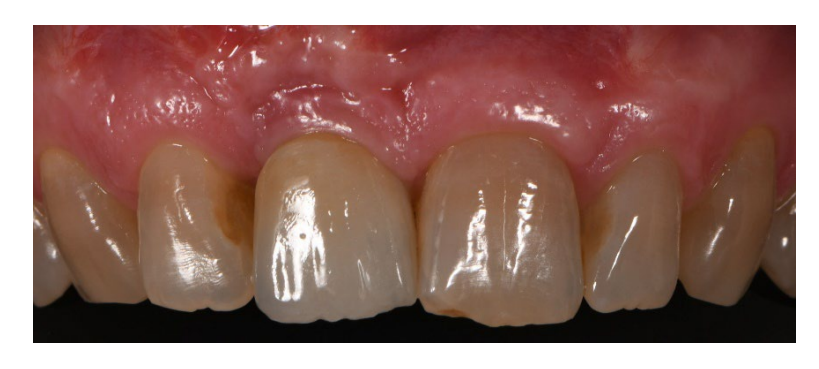
In beiden Gruppen, sechs bis acht Monate nach der Zahnextraktion (Gruppe A und B, jeweils), wurden Zahnimplantate (Premium, Schweden und Martina, Due Carrare, PD, Italien) eingesetzt. In keinem der Fälle war es notwendig, eine zusätzliche GBR durchzuführen. Die Menge an Knochen wurde als ausreichend beurteilt, um ein Implantat mit einem Durchmesser von 3,8 mm und einer Länge von 10 bis 11,5 mm zu platzieren. Das Flappendesign wurde entsprechend dem klinischen Szenario und den Anforderungen des Patienten durchgeführt. Vor der Vorbereitung des Implantatstandorts wurde ein kalibrierter Trephine-Bohrer mit einem äußeren Durchmesser von 3,0 mm verwendet, um eine Kernprobe für die histologische Analyse zu entnehmen. Die Implantate wurden für drei Monate submergiert. Drei Monate nach der Implantation wurde eine schraubengehaltene temporäre Restauration geliefert. Schließlich, zwei bis drei Monate nach der initialen Belastung, wurde eine definitive, schraubengehaltene, CAD/CAM, metallfreie Restauration geliefert. Der Okklusion wurde angepasst, und Nachsorgeuntersuchungen wurden alle vier Monate geplant.
Ergebnismaße
- Implantatversagen wurde definiert als Implantatmobilität und/oder jede Infektion, die die Entfernung des Implantats erforderlich macht, Implantatfraktur oder jede andere mechanische Komplikation, die das Implantat unbrauchbar macht. Darüber hinaus wurde die Stabilität jedes Implantats manuell gemessen, indem die Abutmentschraube bei der Lieferung der definitiven Kronen angezogen wurde oder indem die Stabilität der implantatgetragenen Krone bei jedem Follow-up mit dem Griff von zwei metallischen Instrumenten beurteilt wurde.
- Alle mechanischen und biologischen Komplikationen wurden während des gesamten Follow-ups erfasst. Die gleichen kalibrierten Betreiber, die alle chirurgischen und prothetischen Verfahren durchführten, bewerteten Implantatversagen und Komplikationen.
- Die Patientenzufriedenheit wurde von verblindeten Betreibern in jedem Zentrum bewertet, die zuvor nicht an der Studie beteiligt waren. Bei der Lieferung der definitiven Kronen stellte der unabhängige Ergebnisbewertende dem Patienten die folgenden Fragen (mögliche Antworten: „ja“ oder „nein“):
- Sind Sie mit der Funktion Ihres implantatgetragenen Zahns zufrieden?
- Sind Sie mit dem ästhetischen Ergebnis Ihres implantatgetragenen Zahns zufrieden?
- Würden Sie die gleiche Therapie erneut durchführen lassen?
- Quantitative und qualitative Analysen wurden an anonymisierten Proben von einem verblindeten Pathologen durchgeführt. Qualitative und histomorphometrische Bewertung. Nach der Entnahme wurden die Knochenproben in 10% Formalin fixiert. Die Proben wurden mit einer steigenden Ethanolskala dehydratisiert. Nach der Dehydratisierung wurden die Proben mit einer Methacrylat-Harz infiltriert und anschließend in Harz eingebettet (Technovit 7200, Bio Optica, Mailand). Alle Proben wurden mit einer Polymerisationsmaschine (Exakt 520, Exakt Norderstedt, Deutschland) polymerisiert. Die erhaltenen Blöcke wurden mit einer Sägemaschine mit einer Diamantsäge (Micromet, Remet, Bologna, Italien) geschnitten. Die Schnitte wurden auf Kunststoffobjektträger montiert, indem eine Klebemaschine (Exakt 402, Exakt Norderstedt, Deutschland) und ein Kleberharz (Technovit 7210, Bio Optica, Mailand, Italien) verwendet wurden, und dann auf eine Dicke von 100 µm mit einer Schleifmaschine (LS2 Remet, Bologna, Italien) geschliffen. Zwei repräsentative Längsschnitte für jede Probe wurden gewonnen, mit Toluidinblau und Pyronin-Gelb gefärbt, um die verschiedenen Phasen der Knochenmineralisierung hervorzuheben, und digital bei einer Gesamtvergrößerung von 400× mit einem Hochauflösungsscanner (Nanozoomer S60, Hamamatsu) erfasst.
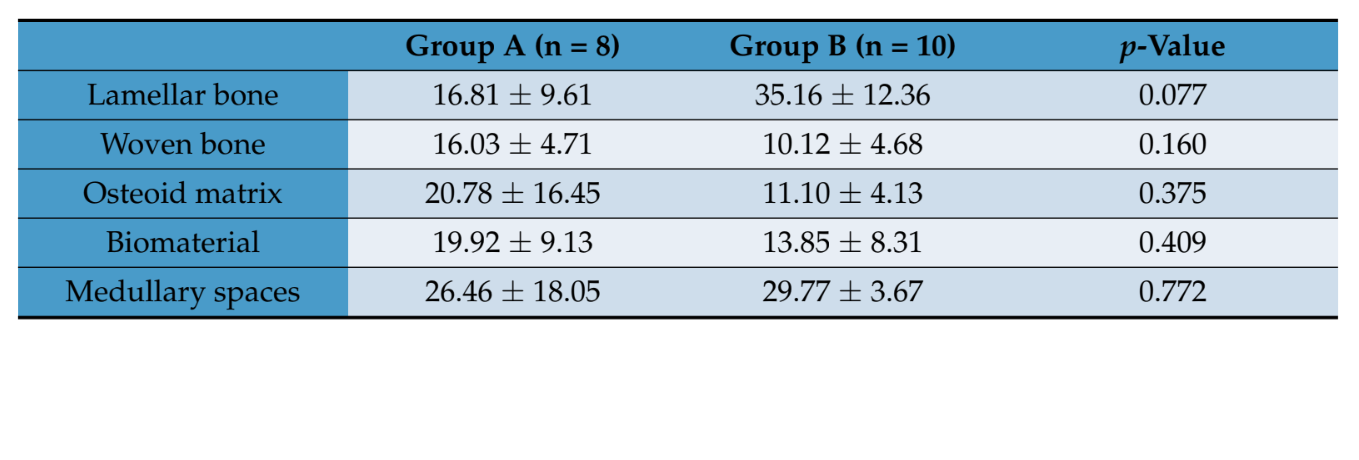
- Die qualitative Bewertung zielte darauf ab, die Menge an entzündlichem, faserigem und fettigem Gewebeinfiltrat sowie eventuelle Nekrosebereiche gemäß den Vorgaben des ISO-Standards 10993 zu erkennen. Die histomorphometrische Bewertung der Gewebevolumenfraktionen wurde mit der stereologischen Methode durchgeführt. Ein digitales Zählgitter wurde auf jedem Schnitt verwendet, um die Schnittpunkte zu berechnen, die auf jede Art von Gewebe (lamellärer Knochen, geflochtener Knochen, osteoide Matrix, Biomaterial und Markräume) fallen, und die Volumenfraktionsprozentsätze wurden durch das Verhältnis zwischen den Schnittpunkten, die auf jeden Gewebetyp fallen, und den gesamten Schnittpunkten des Gitters erhalten.
Statistische Analyse
Es wurde keine Stichprobengröße berechnet. Es wurde beschlossen, 30 Patienten zu rekrutieren, da diese Zahl innerhalb der Kapazitäten der aktuellen Forschungsteams lag. Drei Randomisierungsliste wurden online auf der Website des Random Sequence Generator (https://www.random.org) erstellt. Nur einer der Ermittler (FMC), der nicht an der Auswahl und Behandlung der Patienten beteiligt war, war über die zufällige Reihenfolge informiert und hatte Zugang zu den in einem passwortgeschützten tragbaren Computer gespeicherten Randomisierungsliste. Die Zufallscodes waren in nacheinander nummerierten, identischen, opaken, versiegelten Umschlägen eingeschlossen. Die Umschläge wurden nacheinander geöffnet, nachdem die berechtigten Patienten die informierte Einwilligung unterzeichnet hatten; daher war die Zuteilung der Behandlung für die für die Rekrutierung und Behandlung der Patienten zuständigen Ermittler nicht erkennbar. Aufgrund der Natur der Studie waren die Chirurgen nach der Gruppenzuteilung nicht verblindet. Dennoch wurden die Proben anonymisiert, und das Histologielabor war während der Analysen verblindet.
Alle Datenanalysen wurden gemäß dem vorab festgelegten Analyseplan durchgeführt. Die deskriptive Analyse wurde unter Verwendung des Mittelwerts ± Standardabweichung (SD) mit (Numbers für Mac V. 11.0 [7030.0.94], Apple Inc., Los Altos, Kalifornien, USA) durchgeführt. Dichotome Ergebnisse wurden zwischen den Gruppen verglichen. Vergleiche zwischen kontinuierlichen Variablen wurden unter Verwendung eines unabhängigen t-Tests durchgeführt. Alle statistischen Vergleiche wurden auf dem Signifikanzniveau von 0,05 durchgeführt. Die Patienten wurden als statistische Einheit verwendet.
Ergebnisse
Ein Flussdiagramm der behandelten Patienten ist in Abbildung 9 dargestellt. Die Patienten mussten rekrutiert und mit ähnlichen Verfahren in drei verschiedenen Zentren behandelt werden, und jedes Zentrum sollte 10 Patienten rekrutieren und behandeln. Allerdings rekrutierte nur ein Zentrum alle geplanten Patienten, während die anderen beiden Zentren jeweils vier Patienten rekrutierten. Gründe für den Ausschluss von 12 Patienten waren: häufige Kontrollbesuche (10 Patienten) und eine Ablehnung der geführten Knochenregeneration (zwei Patienten). Schließlich wurden 18 Patienten nacheinander in die Studie aufgenommen, die zu einer Kohorte von 30 Patienten gehörten, die ursprünglich auf Eignung überprüft wurden. Acht Patienten wurden zufällig der Gruppe A zugewiesen, während 10 Patienten zufällig der Gruppe B zugewiesen wurden. Von diesen waren sechs von 18 Patienten männlich.
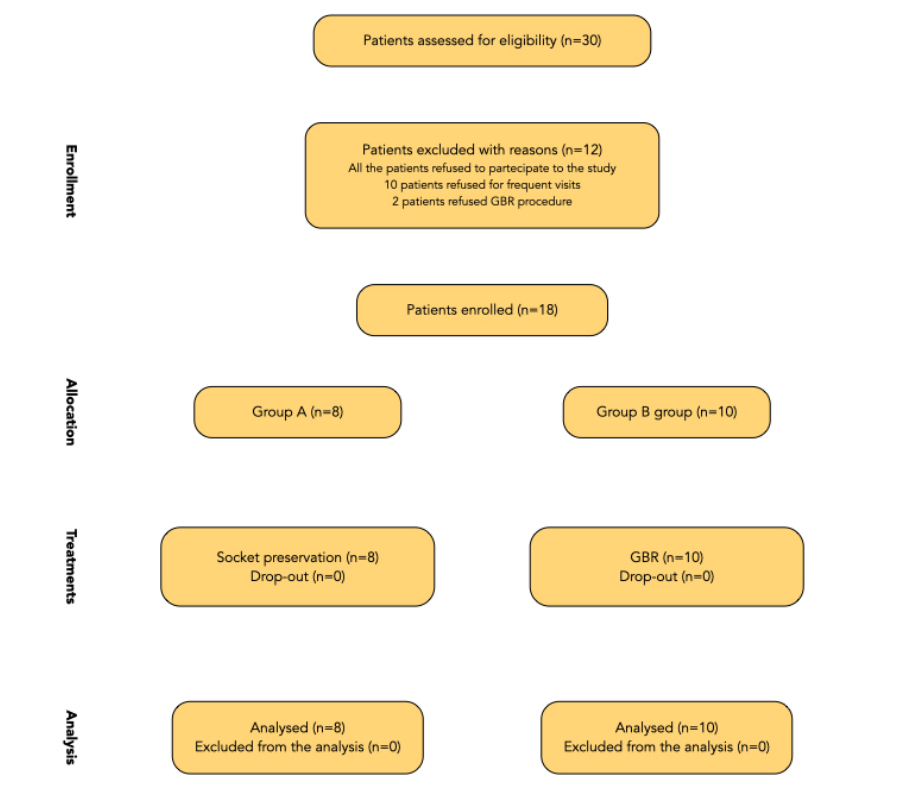
Alle eingeschlossenen Patienten wurden gemäß den zugewiesenen Interventionen behandelt. Der erste Patient wurde im November 2018 behandelt, während die letzte chirurgische Behandlung im September 2020 begonnen wurde. Kein Patient brach die Studie ab, und es traten keine Abweichungen vom ursprünglichen Protokoll auf; daher erhielten alle Patienten die endgültigen Kronen. Die durchschnittliche Nachbeobachtungszeit nach der Prothesenabgabe betrug 6 bis 30 Monate. Das Durchschnittsalter der Patienten lag bei 56,9 ± 11,9, wobei keiner von ihnen Raucher war. Achtzehn Implantate wurden eingesetzt, verteilt auf acht in der Testgruppe (Socket Preservation, Gruppe A) und 10 in der Kontrollgruppe (GBR, Gruppe B). Die Daten aller eingeschlossenen Patienten wurden in den statistischen Analysen ausgewertet. Bei dem Vergleich der getesteten Gruppen gibt es kein Ungleichgewicht zwischen ihnen, einschließlich der Zahnposition und -verteilung (Tabelle 1).
Implantatversagen, Komplikationen und Zufriedenheit der Patienten
Es gab kein Implantatversagen und keine Komplikationen. Darüber hinaus waren alle Patienten mit der Funktion und Ästhetik ihrer implantatgestützten Restauration voll zufrieden, und es wurden keine Unterschiede in ihrer Wahrnehmung der Therapie festgestellt, sodass alle Patienten die gleiche Therapie erneut durchführen würden.
Histomorphometrische Analyse
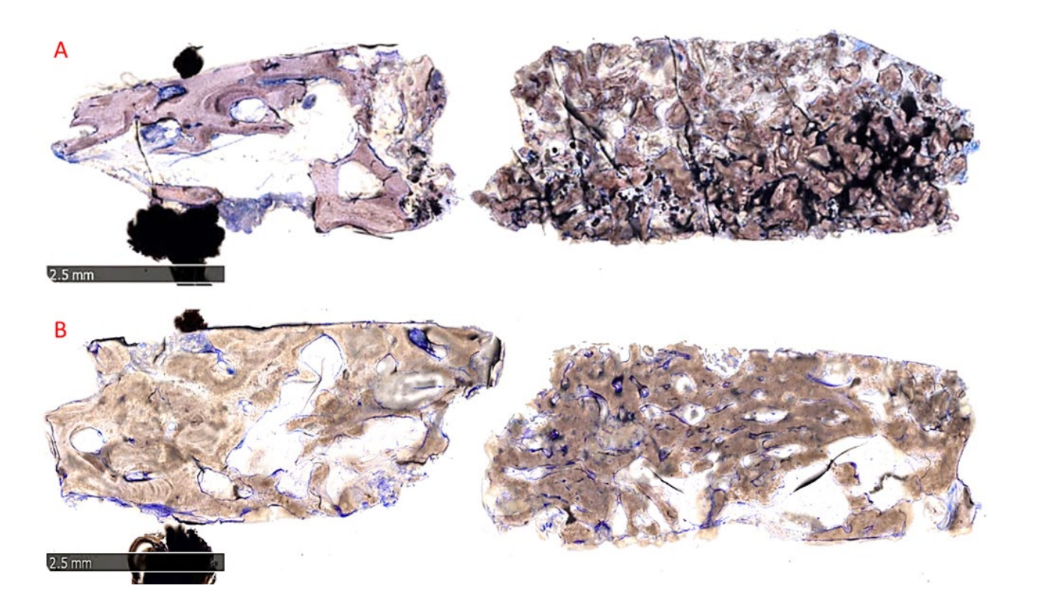
Die morphologische Analyse zeigte keine Anzeichen einer Gewebereaktion, wie Fibrose oder Nekrose. Der regenerierte Knochen war in beiden Gruppen gut mineralisiert, schien jedoch in Gruppe B reifer zu sein als in Gruppe A, wie in Abbildung 10A,B zu sehen ist, die Übersichten repräsentativer Proben zeigt.
In Gruppe A waren die transplantierten Partikel vollständig in die Knochenmatrix eingebettet und schienen einem intensiven Umbauprozess zu unterliegen, mit einem mittleren Grad an Mineralisierung. An der Schnittstelle zwischen den verbleibenden Blöcken und dem neu gebildeten Knochen waren keine Lücken sichtbar (Abbildung 11A). In Gruppe B wies die Knochenmatrix, die die Biomaterialpartikel umgab, ein hohes Maß an Mineralisierung und Osseointegration auf, mit einem Gleichgewicht zwischen Knochenbildung (anaboler Phase) und Knochenabbau (kataboler Phase), was durch das Vorhandensein einiger Fronten des Knochenumbaus und einiger Osteoklasten bestätigt wurde (Abbildung 11B).
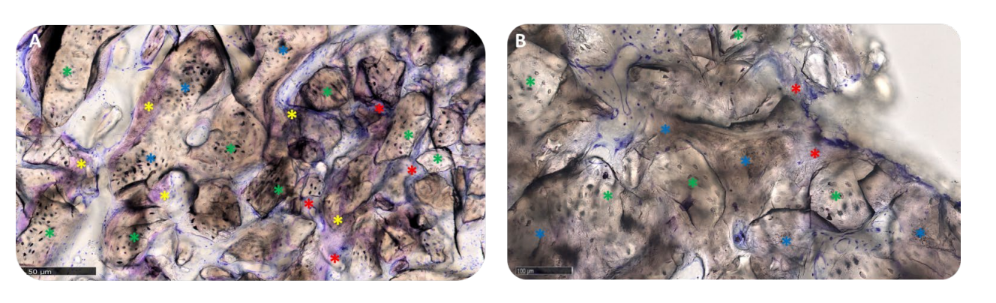
Die Matrix befand sich in der aktiven anabolen Phase: Die Knochenbereiche bestanden aus neu gebildetem lamellärem, mineralisiertem Knochen, mit Osteozyten in der verkalkten Matrix und einer Vorderseite der Remodellierung, die von aktiven Osteoblasten und wenigen Osteoklasten bevölkert war, insbesondere in Gruppe A (Abbildung 12A,B).
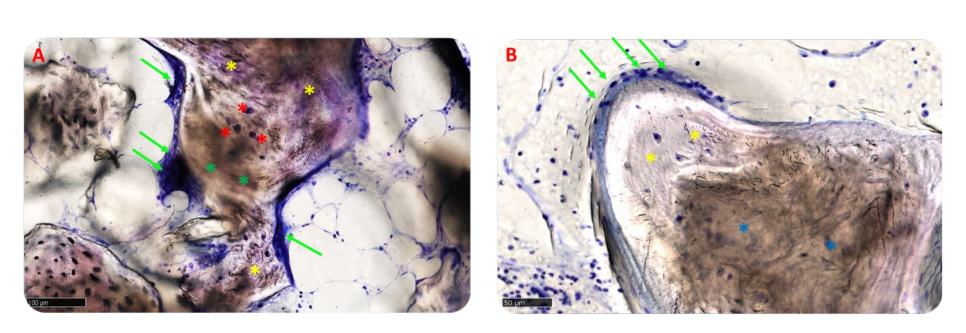
Drei Proben zeigten minimale Lymphozyten, während die verbleibenden Proben beider Gruppen nur einige verstreute entzündliche Zellen aufwiesen (Abbildung 13A,B). Mehrere kleine Blutgefäße besetzten die medullären Räume, wo das Gewebe eine höhere Reife aufwies, was möglicherweise auf eine aktive Gewebeentwicklung hinweist.
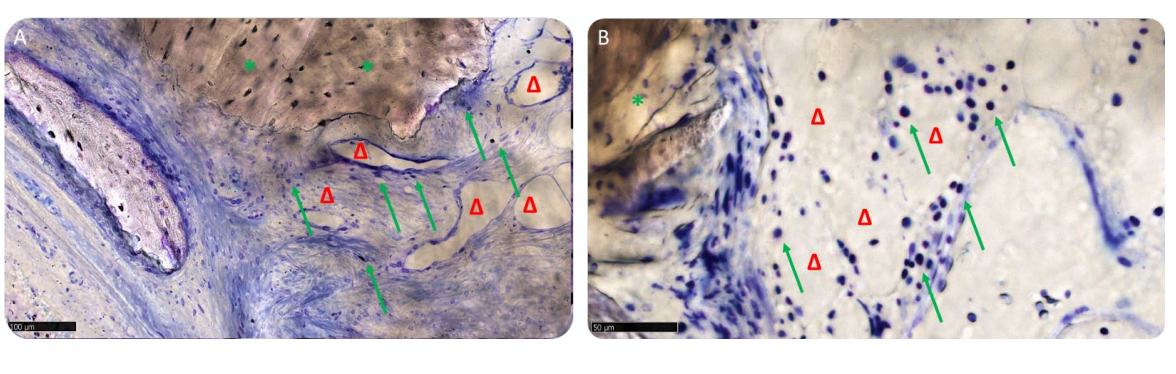
Die histomorphometrische Bewertung zeigte keine statistisch signifikanten Unterschiede in den Gewebevolumenfraktionen zwischen den beiden Patientengruppen (Tabelle 2). In Gruppe B hatte das lamelläre Knochengewebe jedoch einen höheren Mittelwert als der in Gruppe A, wo die neu gebildete Knochenmatrix hauptsächlich durch weniger unreife Matrix, wie Osteoid und geflochtenen Knochen, repräsentiert wurde.
Diskussion
Diese Forschung wurde als randomisierte kontrollierte Studie konzipiert, um die folgende Frage zu beantworten: Was ist die empfohlene Behandlung für die Implantatrehabilitation von Elians Klasse II Restzähnen zwischen einer nicht resorbierbaren, hochdichten Polytetrafluorethylenmembran (d-PTFE), die absichtlich 4 Wochen nach der Zahnextraktion exponiert bleibt, und der Erhaltung des Zahnhalteapparates mit anorganischem Knochenmaterial sowie der Extraktion gefolgt von geführter Knochenregeneration, die zwei Monate später durchgeführt wird? Die Ergebnisse der vorliegenden Forschung konnten keine überlegene Behandlung gegenüber der anderen feststellen, daher wurde die Nullhypothese von keinen statistisch signifikanten Unterschieden zwischen den beiden getesteten Verfahren akzeptiert.
Obwohl die Ergebnisse der vorliegenden Forschung zwischen den Gruppen ähnlich sind, könnte der Hauptvorteil der vorgeschlagenen Technik zur Erhaltung des Zahnhalteapparates mit einer nicht resorbierbaren Membran eine gültige Option darstellen, da sie es ermöglicht, die Gesamtdauer der Behandlung und die Kosten für den Patienten zu reduzieren. Diese Vorteile sind hauptsächlich darauf zurückzuführen, dass sie den Bedarf an anderen regenerativen Techniken verringern kann, ohne die Endergebnisse, die Vorhersagbarkeit der Implantatbehandlung und nicht zuletzt die Patientenzufriedenheit zu beeinträchtigen.
Die intakte buccale Platte (Elian-Klasse-1-Defekt) wurde als Voraussetzung für die Stabilität des Weichgewebes im Bereich um das Implantat und somit für langfristige ästhetische Ergebnisse angesehen, insbesondere bei hohen ästhetischen Anforderungen. Die kontinuierliche Resorption der dünnen buccalen Knochenplatte kann im Laufe der Zeit zu einem hohen Risiko der gingivalen Resorption führen. Die Behandlung von anterioren Defekten erfordert oft eine zweite Operation, die zusätzliche Knochenregenerationsverfahren umfasst, um eine prothetisch geführte Einsetzung der Implantate zu ermöglichen. Diese Verfahren sind jedoch aufgrund ihrer Invasivität und Kosten in der Regel nicht akzeptabler für die Patienten. Die vorgeschlagene Technik, eine nicht resorbierbare Membran vorübergehend zur Reparatur der beschädigten buccalen Wand zu verwenden und absichtlich über dem transplantierten Socket exponiert zu lassen, scheint vielversprechend und unkompliziert zu sein und erfordert weniger chirurgische Eingriffe. In der vorliegenden Forschung wurden keine Unterschiede hinsichtlich der histologischen quantitativen Untersuchung festgestellt. Tatsächlich scheint die Rekonstruktion der buccalen Platte mit einer absichtlich exponierten nicht resorbierbaren Membran ein effektives und einfaches Verfahren zur Regeneration einer resorbierten buccalen Knochenplatte zu sein, das potenziell den Bedarf an geführter Knochenregeneration verringert. Die vorgeschlagene Technik könnte von den Patienten aufgrund ihrer reduzierten Invasivität stark akzeptiert werden.
Der biologische Grund, vier bis sechs Wochen zu warten, bevor die d-PTFE-Membran eingesetzt wird, besteht darin, bis zum Ende der initialen Heilungsphase zu warten, bevor der Knochenumbauprozess beginnt. In diesem Stadium kann man unter der d-PTFE-Membran mit einem vollständigen Weichgewebeschluss rechnen. Die d-PTFE-Membran kann wie ein Gerüst wirken, um die Heilung des neuen Weichgewebes zu leiten und die konvexe Form des alveolären Kamms zu bewahren. Im Gegensatz dazu wird in der GBR-Gruppe ein Zeitraum von acht Wochen empfohlen, bevor das Weichgewebe vollständig wiederhergestellt ist, gemäß Buser und Mitautoren.
Die nicht resorbierbare Membran fungiert als Barriere, die die Trennung des Weichgewebes vom Knochen für 4 bis 6 Wochen ermöglicht, die Zeit, die benötigt wird, um die Stabilisierung des Blutgerinnsels zu erreichen. Die Entfernung der nicht resorbierbaren Membran nach diesem Zeitraum scheint ausreichend Zeit zu geben, um innerhalb der Alveole die Differenzierung von mesenchymalen Zellen zu Osteoblasten zu ermöglichen, während Fibroblasten vom Zahnfleischlappen ausgeschlossen werden, was schließlich zur Bildung und Reifung neuen Knochens führt. Zu diesem Zweck ist es entscheidend, dass der Patient die chirurgische Wunde sauber und desinfiziert hält. Ähnliche Vorschläge wurden jedoch für beide Techniken gemacht. Im Vergleich zur gestuften geführten Knochenregeneration ermöglicht die vorgestellte Technik die Bereitstellung der definitiven Restauration in kürzerer Zeit, was potenziell die Akzeptanz der Patienten verbessert und auch potenziell die Gesamtkosten senkt.
In einer histologischen Studie an Menschen wurde nach 4 Wochen zum Zeitpunkt der Membranentfernung eine Biopsie entnommen. Die Ergebnisse dieser histologischen Forschung zeigten, dass, selbst wenn die nicht resorbierbare d-PTFE-Membran absichtlich exponiert gelassen wurde, kein Epithelgewebe über einer dichten Bindegewebsmatrix gefunden wurde. Dieses Ergebnis könnte darauf hindeuten, dass das neu gebildete Bindegewebe eine gut durchblutete Osteoidmatrix zu sein scheint. Dennoch benötigt es mehr Zeit, um die Reifung abzuschließen und ein mineralisiertes Gewebe zu werden, das die Implantation ermöglicht. Ein Gesamtzeitraum von 3 bis 5 Monaten ist notwendig. Grundsätzlich hängt es von der Art und Größe des Defekts sowie dem Biomaterial ab, das verwendet wird, um die Alveole zu transplantieren. In einer anderen histologischen Studie erhielt die Testgruppe eine Kombination aus 70% mineralisiertem und 30% demineralisiertem kortikalem Allograftmaterial, das verwendet wurde, um eine post-extraktive Alveole zu transplantieren, die mit einer absichtlich exponierten, nicht resorbierbaren d-PTFE-Membran abgedeckt war. Die erhaltenen Ergebnisse wurden standortweise mit einer Kontrollgruppe bewertet, für die nur mineralisiertes Allograftmaterial verwendet wurde. Die Biopsien zeigten eine erhöhte vitale Knochenbildung (36,16%) mit einer entsprechenden Reduktion des verbleibenden Transplantats (18,24%) in der Testgruppe im Vergleich zu den kontrollierten Fällen, bei denen 100% mineralisiertes Knochenallograft verwendet wurde (24,69% und 27,04%, jeweils).
Die Ergebnisse der vorliegenden Studie stimmen mit einer aktuellen Cochrane-Systematikübersicht überein, die zu dem Schluss kam, dass Techniken zur Erhaltung des Alveolarkamms die allgemeinen Veränderungen in der Höhe und Breite des verbleibenden Kamms nach Zahnentfernung minimieren können. Dennoch ist die Evidenz sehr unsicher.
Aufgrund des Fehlens einer Berechnung der Stichprobengröße war die Hauptbeschränkung der vorliegenden Studie die kleinere Stichprobe. Eine weitere Einschränkung, die die interne und externe Validität der Ergebnisse beeinflussen kann, war das Fehlen einer Kalibrierung der Chirurgen. Alle an dieser Forschung beteiligten Chirurgen wurden jedoch geschult, um vor Beginn der Studie zwei erklärende Fälle durchzuführen. Schließlich haben Oberkiefer und Unterkiefer unterschiedliche Knochenschwundraten und -muster, die die Prognose beeinflussen können. Die Randomisierung ermöglichte jedoch die Bildung von zwei ausgewogenen Gruppen, ohne statistische Unterschiede zwischen ihnen. Daher liefern die Ergebnisse des vorliegenden vorläufigen Berichts quantitative histologische Daten über Knochen, der mit einer nicht resorbierbaren d-PTFE-Membran oder geführter Knochenregeneration zur Behandlung von post-extraktiven alveolären Knochendefekten mit implantatgestützten Restaurationen rekonstruiert wurde. Obwohl die vorgeschlagene Technik der offenen Wundheilung mit der klassischen geführten Knochenrekonstruktion verglichen wurde, ermutigen diese vorläufigen Ergebnisse zu diesem Ansatz. Ebenso gibt es Studien, die zelluläre dermale Matrix mit Polytetrafluorethylen (PTFE)-Membran vergleichen und ähnliche vielversprechende Ergebnisse erzielen. Daher sind weitere klinische und radiologische Studien mit längerer Nachbeobachtungszeit erforderlich, um diese vielversprechenden klinischen Ergebnisse zu validieren.
Schlussfolgerungen
Mit der Einschränkung der vorliegenden Pilotstudie scheint die Rekonstruktion der Wangenplatte mit einer absichtlich exponierten nicht resorbierbaren Membran ein effektives und einfaches Verfahren zur Regeneration einer resorbierten Wangenknochenplatte zu sein, wodurch der Bedarf an geführter Knochenregeneration verringert wird. Weitere Studien mit größerer Stichprobengröße sind erforderlich, um dieses vorläufige Ergebnis zu bestätigen.
Roberto Luongo, Marco Tallarico, Elena Canciani, Daniele Graziano, Claudia Dellavia, Marco Gargari, Francesco Mattia Ceruso, Dario Melodia und Luigi Canullo
Literaturverzeichnis
- Marcus, S.; Drury, T.; Brown, L.; Zion, G. Zahnretention und Zahnverlust im bleibenden Gebiss von Erwachsenen: Vereinigte Staaten, 1988–1991. J. Dent. Res. 1996, 75, 684–695.
- Mecall, A.R.; Rosenfeld, A.L. Einfluss von Resorptionsmustern des Restknochens auf die Platzierung von Implantatbefestigungen und Zahnpositionen. Int. J. Periodontics Restor. Dent. 1991, 11, 8–23.
- Van der Weijden, F.; Dell’Acqua, F.; Slot, D.E. Dimensionale Veränderungen des Alveolarknochens von post-extraktionssockets beim Menschen: Eine systematische Übersicht. J. Clin. Periodontol. 2009, 36, 1048–1058.
- Meloni, S.M.; Jovanovic, S.A.; Pisano, M.; De Riu, G.; Baldoni, E.; Tallarico, M. Einphasige horizontale geführte Knochenregeneration mit autologem Knochen, anorganischem Rinderknochen und Kollagenmembranen: Nachverfolgung einer prospektiven Studie 30 Monate nach der Belastung. Eur. J. Oral Implant. 2018, 11, 89–95.
- Kan, J.Y.K.; Rungcharassaeng, K.; Lozada, J.L.; Zimmerman, G. Stabilität des Gesichtsgingivagewebes nach sofortiger Platzierung und Provisorisierung von maxillären anterioren Einzelimplantaten: Eine Nachverfolgung von 2 bis 8 Jahren. Int. J. Oral Maxillofac. Implant. 2011, 26, 179–187.
- Zubillaga, G.; Von Hagen, S.; Simon, B.I.; Deasy, M.J. Veränderungen in der Alveolarknochenhöhe und -breite nach der Augmentation des Restknochens mit einer festen bioabsorbierbaren Membran und demineralisiertem gefriergetrocknetem Knochen-Osteoinduktiv-Transplantat. J. Periodontol. 2003, 74, 965–975.
- Darby, I.; Chen, S.T.; Buser, D. Techniken zur Erhaltung des Knochens für die Implantattherapie. Int. J. Oral Maxillofac. Implant. 2009, 24, 260–271.
- Tallarico, M.; Xhanari, E.; Pisano, M.; Gatti, F.; Meloni, S.M. Molarenersatz mit 7 mm breiten Durchmesserimplantaten: Das Implantat sofort setzen oder 4 Monate nach der Erhaltung des Sockets warten? Ergebnisse 1 Jahr nach der Belastung aus einer randomisierten kontrollierten Studie. Eur. J. Oral Implant. 2017, 10, 169–178.
- Canullo, L.; Marin, G.W.; Tallarico, M.; Canciani, E.; Musto, F.; Dellavia, C. Histologische und histomorphometrische Bewertung von postextraktiven Stellen, die mit Mg-reichem Nano-Hydroxyapatit transplantiert wurden: Eine randomisierte kontrollierte Studie, die 4 gegen 12 Monate Heilung vergleicht. Clin. Implant. Dent. Relat. Res. 2015, 18, 973–983.
- Meloni, S.M.; Tallarico, M.; Lolli, F.M.; Deledda, A.; Pisano, M.; Jovanovic, S.A. Erhaltung des post-extraktionssockets unter Verwendung von epithelialem Bindegewebstransplantat versus porcine Kollagenmatrix. Ergebnisse nach einem Jahr aus einer randomisierten kontrollierten Studie. Eur. J. Oral Implant. 2015, 8, 39–48.
- Papi, P.; Di Murro, B.; Tromba, M.; Passarelli, P.C.; D’Addona, A.; Pompa, G. Die Verwendung einer nicht resorbierbaren Membran als okklusive Barriere zur Erhaltung des Alveolarkamms: Eine einjährige Nachverfolgung einer prospektiven Kohortenstudie. Antibiotika 2020, 9, 110.
- Sun, D.-J.; Lim, H.-C.; Lee, D.-W. Erhaltung des Alveolarkamms unter Verwendung eines offenen Membranansatzes für Sockets mit Knochendefizit: Eine randomisierte kontrollierte klinische Studie. Clin. Implant Dent. Relat. Res. 2018, 21, 175–182.
- Chatzopoulos, G.S.; Koidou, V.P.; Sonnenberger, M.; Johnson, D.; Chu, H.; Wolff, L.F. Erhaltung des Restknochens nach Extraktion unter Verwendung dichter PTFE-Membranen: Eine systematische Übersicht und Metaanalyse. J. Prosthet. Dent. 2022.
- Carbonell, J.M.; Martin, I.S.; Santos, A.; Pujol, A.; Sanz-Moliner, J.D.; Nart, J. Hochdichte Polytetrafluorethylen-Membranen in geführten Knochen- und Gewebe-Regenerationsverfahren: Eine Literaturübersicht. Int. J. Oral Maxillofac. Surg. 2014, 43, 75–84.
- Atieh, M.A.; Alsabeeha, N.H.M.; Payne, A.G.T.; Duncan, W.; Faggion, C.M.; Esposito, M. Interventionen zum Ersatz fehlender Zähne: Techniken zur Erhaltung des Alveolarkamms für die Entwicklung von Implantatstandorten. Cochrane Database Syst. Rev. 2021, CD010176.
- Corbella, S.; Taschieri, S.; Francetti, L.; Weinstein, R.; Del Fabbro, M. Histomorphometrische Ergebnisse nach der Heilung des post-extraktionssockets mit verschiedenen Biomaterialien: Eine systematische Übersicht der Literatur und Metaanalyse. Int. J. Oral Maxillofac. Implant. 2017, 32, 1001–1017.
- Elian, N.; Cho, S.-C.; Froum, S.; Smith, R.B.; Tarnow, D.P. Eine vereinfachte Klassifikation und Reparaturtechnik für Sockets. Pract. Proced. Aesthetic Dent. 2007, 19, 99–104.
- Buser, D.; Chappuis, V.; Belser, U.C.; Chen, S. Implantatplatzierung nach Extraktion in ästhetischen Einzelzahnstandorten: Wann sofort, wann früh, wann spät? Periodontologie 2000 2017, 73, 84–102.
- Canciani, E.; Ragone, V.; Biffi, C.A.; Valenza, F.; D’Ambrosi, R.; Olimpo, M.; Cristofalo, A.; Galliera, E.; Dellavia, C. Das Verständnis der Rolle der Oberflächenmodifikation von randomisierten trabekulären Titanstrukturen in der Regeneration von Knochengewebe: Eine experimentelle Studie. Medicina 2022, 58, 315.
- Kan, J.Y.K.; Rungcharassaeng, K.; Lozada, J.L. Sofortige Platzierung und Provisorisierung von maxillären anterioren Einzelimplantaten: 1-jähriges prospektives Studium. Int. J. Oral Maxillofac. Implant. 2003, 18, 31–39.
- Bambini, F.; Orilisi, G.; Quaranta, A.; Memè, L. Biologisch orientierte sofortige Belastung: Ein neues mathematisches Protokoll für die vertikale Einsetzung von Implantaten, fünfjährige Nachverfolgungsstudie. Materialien 2021, 14, 387.
- Chen, S.T.; Buser, D. Ästhetische Ergebnisse nach sofortiger und früher Implantatplatzierung im anterioren Oberkiefer – Eine systematische Übersicht. Int. J. Oral Maxillofac. Implant. 2014, 29, 186–215.
- Bartee, B.K. Eine vereinfachte Technik zur Erhaltung des Knochens nach Zahnextraktion. Dent. Today 1995, 14, 62–67.
- Laurito, D.; Cugnetto, R.; Lollobrigida, M.; Guerra, F.; Vestri, A.; Gianno, F.; Bosco, S.; Lamazza, L.; De Biase, A. Erhaltung des Sockets mit d-PTFE-Membran: Histologische Analyse der neu gebildeten Matrix bei Membranentfernung. Int. J. Periodontics Restor. Dent. 2016, 36, 877–883.
- Beck, T.M.; Mealey, B.L. Histologische Analyse der Heilung nach Zahnextraktion mit Knochenerhaltung unter Verwendung von mineralisiertem menschlichem Knochenallograft. J. Periodontol. 2010, 81, 1765–1772.
- Borg, T.D.; Mealey, B.L. Histologische Heilung nach Zahnextraktion mit Knochenerhaltung unter Verwendung von mineralisiertem versus kombiniert mineralisiert-demineralisiertem gefriergetrocknetem Knochenallograft: Eine randomisierte kontrollierte klinische Studie. J. Periodontol. 2015, 86, 348–355.
- Krauser, J.T. Hochdichte PTFE-Membranen: Anwendungen mit wurzelformigen Implantaten. Dent. Implant. Update 1996, 7, 65–69.
- Fotek, P.D.; Neiva, R.F.; Wang, H.-L. Vergleich von Dermalmatrix und Polytetrafluorethylen-Membran zur Augmentation des Knochens im Socket: Eine klinische und histologische Studie. J. Periodontol. 2009, 80, 776–785.
