In-vivo-Vergleich der Biokompatibilität zweier Wurzelkanalversiegelungen, die in das subkutane Bindegewebe von Ratten implantiert wurden
Maschinenübersetzung
Der Originalartikel ist in EN Sprache (Link zum Lesen) geschrieben.
Ziel. Die subkutane Biokompatibilität von 2 Wurzelkanalversiegelungen zu bewerten.
Studienaufbau. Die subkutane Implantationstechnik, die von der Fédération Dentaire International (FDI) empfohlen wird, wurde verwendet, um die Wurzelkanalversiegelungen Endométhasone und EndoREZ zu testen. Diese Materialien wurden in Teflonröhren mit einem Durchmesser von 1 mm und einer Länge von 10 mm platziert und in 2 Taschen implantiert, die im Rücken von 40 Calomys callosus Nagetieren, 20 für jedes Material, geschaffen wurden. Gewebeproben wurden entnommen und histologisch 15, 30, 60 und 90 Tage nach dem Implantationsverfahren untersucht. Das allgemeine Niveau der entzündlichen Gewebereaktion wurde an der Versiegelungs- und Bindegewebeoberfläche an den Öffnungsenden der Röhren als keine, leichte, moderate oder schwere Reaktion bewertet. Die Bindegewebeerreaktion entlang der seitlichen Wand außerhalb jeder Röhre diente als negative Kontrolle.
Ergebnisse. Die Gewebereaktion auf das Endométhasone nahm mit der Zeit ab. Der EndoREZ-Versiegeler war während aller experimentellen Phasen hochtoxisch.
Fazit. Der Endométhasone Wurzelkanal-Dichtstoff zeigte Biokompatibilität innerhalb der analysierten Zeiträume, während EndoREZ kein biokompatibles Verhalten aufwies und eine späte Überempfindlichkeitsreaktion verursachte. (Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:e88-e94)
Eine erfolgreiche endodontische Therapie hängt von korrekten Diagnosen, effektiver Reinigung, der Beseitigung von Infektionen und einer angemessenen Füllung der Wurzelkanäle ab. Die Reaktion des periapikalen Gewebes nach der Wurzelkanalbehandlung kann von verschiedenen Faktoren beeinflusst werden, abhängig von der chemischen Natur des endodontischen Dichtstoffs. Aktuell in der klinischen Praxis verwendete Dichtstoffe basieren auf Harz, Zinkoxid-Eugenol, Glasionomer, Silikon und Calciumhydroxid. Harzbasierte Dichtstoffe gewinnen zunehmend an Beliebtheit, aber Studien haben gezeigt, dass einige dieser Dichtstoffe Toxizität und Mutagenität aufweisen. Trotz der großen Vielfalt an verfügbaren Dichtstoffen wurde noch kein Wurzelkanal-Dichtstoff gefunden, der alle wünschenswerten physikalischen und biologischen Eigenschaften besitzt. Biokompatibilität ist eine der wichtigsten Eigenschaften von Wurzelfüllmaterialien8, da die Freisetzung bestimmter Substanzen durch die Dichtstoffe unterschiedliche Reaktionen im periapikalen Gewebe hervorrufen kann. Gewebereaktionen, die durch endodontische Materialien verursacht werden, werden normalerweise durch histologische Studien untersucht, die nach der Implantation des Materials in tierisches Gewebe durchgeführt werden. Endométhasone (Spécialities Septodont, Saint-Maur-des-Fossés, Frankreich) ist ein auf Zinkoxid-Eugenol basierender Dichtstoff, der zuvor in verschiedenen Studien hinsichtlich seiner biologischen Eigenschaften bewertet wurde. Kürzlich wurde ein neuer methacrylatbasierter endodontischer Dichtstoff, EndoREZ (Ultradent Products Inc., South Jordan, UT, USA), eingeführt, dessen biologische Eigenschaften bisher wenig untersucht wurden.
Ziel dieser Studie war es, die Reaktion des subkutanen Bindegewebes auf EndoREZ und Endométhasone Wurzelkanaldichtstoffe gemäß den Empfehlungen der FDI zu bewerten.
Methoden
Das Protokoll für dieses Experiment wurde vom Forschungsethikkomitee der Universität Uberlândia genehmigt, und das Experiment wurde in Übereinstimmung mit der Richtlinie des U.S. Public Health Service über humane Pflege und Nutzung von Labortieren durchgeführt. Vierzig männliche Calomys callosus (Rodentia, Cricetidae) Nagetiere mit einem Gewicht von 150 bis 200 g wurden verwendet. Die Proben wurden in 2 Gruppen von jeweils 20 Tieren für die Wurzelkanaldichtstoffe Endométhasone und EndoREZ unterteilt. Tabelle I zeigt Materialien, Hersteller und Hauptbestandteile.
Alle Materialien wurden gemäß den Empfehlungen der Hersteller für ihre klinische Verwendung vorbereitet und in autoklavierten Teflon-Trägern (Polytetrafluorethylen, Du-Pont, Habia, Knivsta, Schweden) mit einer Länge von 10 mm, einem einzelnen Lumen und einem Innendurchmesser von 1 mm geladen, wobei sichergestellt wurde, dass keine Luft eingeschlossen wurde.
Die Tiere wurden intraperitoneal mit 0,2 ml Ketamin, das Acepromazin im Verhältnis 1:1 enthielt, anesthesiert. Die dorsale Haut wurde rasiert, mit 5%iger Jodtinktur desinfiziert und kleine Einschnitte von etwa 15 mm Länge wurden mit einer Klinge an beiden Seiten des Rückens gemacht. Zwei separate Taschen wurden durch stumpfe Dissektion geschaffen, um die Röhren im subkutanen Gewebe bis zu einer Tiefe von ~15 mm zu implantieren. Die Röhren, die frisch gemischte Dichtstoffe enthielten, wurden dann in die rechten und linken Taschen, die in jedem Tier vorbereitet wurden, eingesetzt. Es wurde darauf geachtet, ein Auslaufen der Materialien in das Gewebe zu verhindern. Nach der Implantation wurden die Wunden genäht.
Die Tiere wurden in Gruppen von jeweils 5 nach 15, 30, 60 und 90 Tagen durch Kohlenstoffdioxid-Erstickung getötet, um ein minimales Unbehagen und Stress zu gewährleisten. Die Röhren wurden zusammen mit der Haut und dem umgebenden Bindegewebe excidiert. Die Proben wurden 24 Stunden lang in 10% Formalin in einer 0,1 mol/L gepufferten Phosphatlösung eingetaucht, in abgestuften Ethanol-Lösungen bei Raumtemperatur dehydratisiert und in Glycolmethacrylat (Historesin; Leica Microsystems, Nussloch GmbH, Deutschland) eingebettet. Für die Querschnittserstellung wurden die Blöcke parallel zur Längsachse der Röhre orientiert. Die Schnitte wurden auf eine Dicke von 3 µm geschnitten und mit 1% Toluidinblau gefärbt. Die histologischen Schnitte wurden unter einem Lichtmikroskop bei verschiedenen Vergrößerungen analysiert, wobei die Gewebereaktionen an der Dichtstoff-Bindegewebe-Schnittstelle an den offenen Enden der Röhren notiert wurden. Die Bindegewebsreaktion entlang der seitlichen Wand außerhalb der Röhren diente als negativer Kontrollwert.
Die Schnittstelle am Öffnung des Bechers zwischen dem Material und dem Knochen wurde untersucht und bewertet hinsichtlich der Intensität der Entzündung. Die Bewertungskriterien der Fédération Dentaire International (FDI) sind ausschließlich qualitativ, und es wurde kein Bewertungsindex verwendet. Daher wurde das allgemeine Niveau der Gewebereaktion als none, slight, moderate oder severe eingestuft, abhängig von der Anwesenheit oder Abwesenheit von neutrophilen Leukozyten, Makrophagen, Lymphozyten, Plasmazellen, riesigen Fremdkörperzellen, dispergiertem Material, Kapsel, neu gebildetem gesundem Knochen, nekrotischem Gewebe und Resorption. Das allgemeine Niveau der entzündlichen Gewebereaktion wurde wie folgt bewertet: 1) none/slight: Dicke der Reaktionszone ähnlich oder nur geringfügig breiter als die Dicke entlang des seitlichen Rohres, mit keinen oder wenigen entzündlichen Zellen; 2) moderate: erhöhte Reaktionszone, in der Makrophagen, Plasmazellen oder beide vorhanden sind; und 3) severe: erhöhte Reaktionszone, in der Makrophagen und Plasmazellen sowie gelegentliche Herde von neutrophilen Granulozyten, Lymphozyten oder beiden vorhanden sind.
Die Interpretationen der Ergebnisse basierten auf den folgenden FDI-Kriterien: keine bis leichte Reaktion sowohl nach 2 als auch nach 12 Wochen ist akzeptabel; keine bis leichte Reaktion nach 2 Wochen, die sich nach 12 Wochen zu einer moderaten oder schweren Reaktion erhöht, ist nicht akzeptabel; moderate Reaktion nach 2 und 12 Wochen ist nicht akzeptabel; moderate Reaktion nach 2 Wochen, die sich nach 12 Wochen verringert, ist akzeptabel; und eine schwere Reaktion zu irgendeinem Zeitpunkt ist inakzeptabel.
Ergebnisse
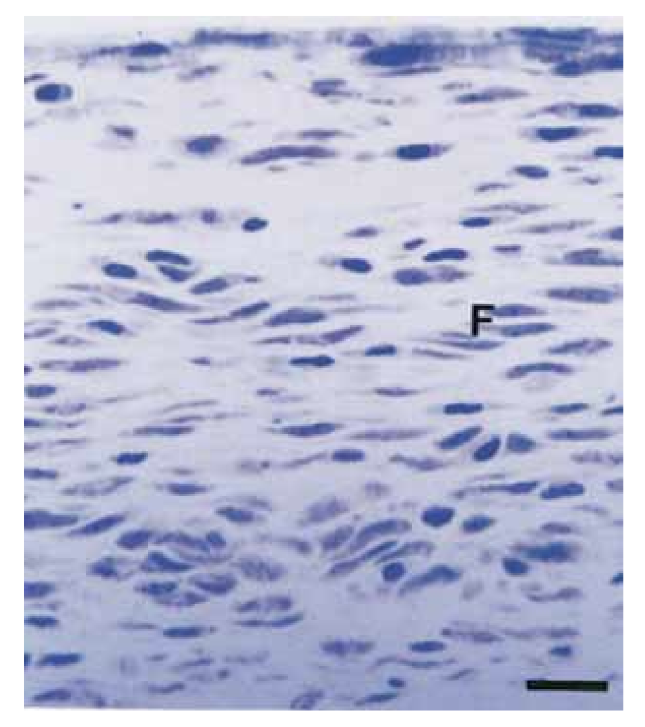
Die Intensität der entzündlichen Reaktion in allen experimentellen Phasen beider Dichtstoffe wurde analysiert. Die Reaktion des Bindegewebes entlang der seitlichen Wand außerhalb der Teflonröhren diente als negativer Kontrollwert für die Technik und zeigte in allen Experimentierphasen keine entzündliche Reaktion (Abb. 1). Die Anzahl der Proben in jeder entzündlichen Kategorie zu den verschiedenen Zeitpunkten für die 2 Arten von Dichtstoffen ist in Tabelle II dargestellt.
Endométhasone
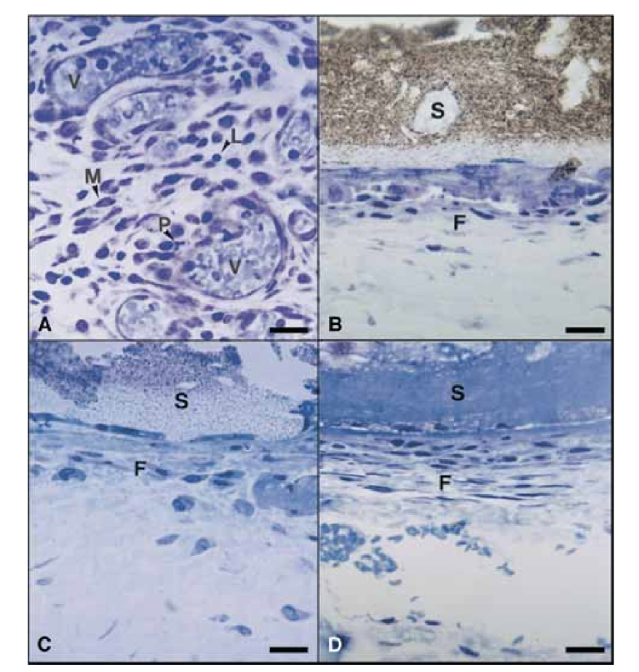
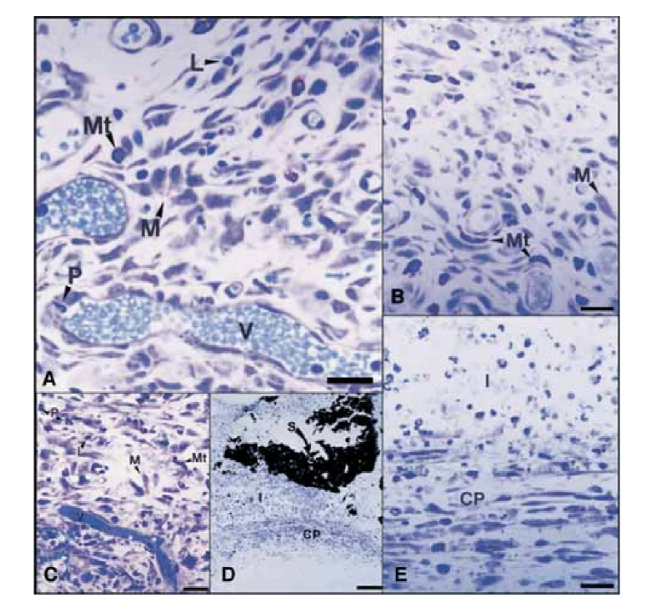
Am 15. Tag wurde eine moderate bis schwere entzündliche Reaktion beobachtet. Das Gewebe war überwiegend mit Makrophagen und Lymphozyten infiltriert. Auch das Vorhandensein von polymorphkernigen Leukozyten, Hyperämie und einer morphologisch veränderten extrazellulären Matrix wurde beobachtet (Abb. 2, A). An den Tagen 30, 60 und 90 zeigte das Bindegewebe keine entzündliche Reaktion (Abb. 2, B, C und D).
EndoREZ
Am 15. Tag wurde eine mäßige bis schwere Entzündungsreaktion beobachtet. Das Gewebe war überwiegend mit Makrophagen, einigen polymorphkernigen Leukozyten und Lymphozyten infiltriert. Es wurde auch eine Gefäßerhyperämie und eine reduzierte sowie morphologisch veränderte extrazelluläre Matrix festgestellt (Abb. 3, A). Ab dem 30. Tag wurde eine schwere Entzündungsreaktion beobachtet, und ein entzündliches Infiltrat, das überwiegend aus polymorphkernigen Leukozyten, Lymphozyten und Makrophagen bestand, schien das Lumen der Teflonröhren zu infiltrieren. Darüber hinaus wurden an der Schnittstelle zwischen Dichtmittel und Bindegewebe Blutgefäße beobachtet, die von Mastzellen umgeben waren (Abb. 3, B). Am 60. Tag persistierte eine schwere Entzündungsreaktion mit Makrophagen, Lymphozyten und polymorphkernigen Leukozyten weiterhin. Am Öffnungsbereich der Teflonröhren wurde das Dichtmittel durch ein entzündliches Infiltrat mit vorherrschenden Makrophagen und Lymphozyten ersetzt. Überfüllte Blutgefäße, die von Mastzellen umgeben waren, wurden beobachtet (Abb. 3, C). Eine konsistente fibroblastenartige Proliferation, die das entzündliche Gewebe umgab, wurde ebenfalls festgestellt. Am 90. Tag wurde ein schweres entzündliches Infiltrat, das aus Makrophagen, Lymphozyten, polymorphkernigen Leukozyten, roten Zellen und toten Zellen bestand und in das Lumen der Teflonröhren invaginiert war, beobachtet, wobei das Dichtmittel ersetzt wurde. Am Öffnungsende der Röhren war das granulomatöse Gewebe durch eine fibröse Kapsel abgegrenzt (Abb. 3, D und E).
Diskussion
Wenn ein neues Material auf den Markt eingeführt wird oder ein bestehendes Material für eine andere Anwendung vorgeschlagen wird, sollten seine Eigenschaften untersucht und die Ergebnisse mit denen anderer Autoren verglichen werden. In den Vereinigten Staaten ist die Food and Drug Administration (FDA) verantwortlich für die Bewertung und Beurteilung der biologischen Wirkungen aller Medikamente, Materialien und Geräte, die beim Menschen verwendet werden, einschließlich der meisten zahnmedizinischen Produkte und Geräte. Die FDA sorgt auch für die Anerkennung von Standards, die von privaten Organisationen, wie der ANSI/ADA, festgelegt wurden. Die Überarbeitung der erstmals veröffentlichten empfohlenen Standardpraktiken für die biologische Bewertung von zahnmedizinischen Materialien wurde verzögert, um die wesentlichen Punkte der Empfehlungen der FDA zu berücksichtigen. Dieses neue Dokument sollte nicht die industrielle Entwicklung neuer und verbesserter zahnmedizinischer Produkte behindern, indem es übermäßige Anforderungen an biologische Tests stellt, sondern in dieser Ära der Besorgnis über chemische Gefahren sollte ein Toxizitätsprofil für alle neuen und verbesserten Materialien entwickelt werden, um relevante Daten zur Sicherheit und Wirksamkeit zu erhalten. Obwohl keine Menge an experimenteller Forschung absolute Sicherheit für irgendeine Substanz garantieren kann, liefern toxikologische Untersuchungen Daten, aus denen vernünftige Projektionen und Vorhersagen über die Bedingungen gemacht werden können, unter denen das Mittel sicher verwendet werden kann.
Obwohl viele Tests, wie Zytotoxizität, Hämolyse, Ames-Test, Styles-Zelltransformation, subkutane und Knochenimplantationen, Sensibilisierung und endodontische Anwendung, für verschiedene Teststufen aufgeführt sind, sind sie nicht alle für jedes Produkt erforderlich. Es muss eine Entscheidung getroffen werden, welche Tests relevant sind. Die anfänglichen Tests sollen ein Profil der Toxizität in einem biologischen System liefern, sodass der Hersteller auf einer Vergleichsbasis eine grobe Einschätzung und Vorstellung davon hat, wo das Produkt steht. Für die FDA fallen regulierte Geräte jedoch in 3 Klassen, und die Mehrheit der zahnmedizinischen Geräte und Hilfsmittel würde nicht der Normsetzung für die Marktzulassung unterliegen. Mit anderen Worten, manchmal sind sogar grundlegende Sicherheitstests nicht erforderlich, bevor Produkte für die klinische Anwendung beworben werden können.
Die Biokompatibilität von zahnmedizinischen Materialien ist ein wichtiges Kriterium, da die toxischen Komponenten in diesen Materialien Reizungen oder sogar Degeneration des umgebenden Gewebes verursachen könnten, insbesondere wenn sie versehentlich in das periradikuläre Gewebe gelangen. Die subkutane Implantation von Bindegewebe bei Tieren ist eine der zuverlässigsten Methoden zur Bewertung der Biokompatibilität von zahnmedizinischen Materialien, da entzündliche Reaktionen ein charakteristisches Merkmal für alle Bindegewebe sind. Der mausähnliche Wildnager Calomys callosus wird häufig verwendet, um experimentelle Infektionen und humorale Immunantworten zu untersuchen, und wurde in der vorliegenden Studie aufgrund seiner Reproduzierbarkeit als etabliertes Modell, das in der Literatur weit akzeptiert ist, verwendet.
Die Proben wurden in Glykolmethacrylat eingebettet, da es im Vergleich zu Paraffin Vorteile bietet, wie z. B. weniger Verzerrung, dünne Schnitte, die eine gute Zelldefinition bieten, die Vorbereitung von Schnitten ohne Entfernung der Röhren und Färbung mit guter Qualität und wenigen technischen Artefakten, was eine genauere Bewertung der entzündlichen Reaktion begünstigt.
In der vorliegenden Studie diente das Bindegewebe entlang der Seitenwand als negativer Kontrollbereich und zeigte keine entzündlichen Reaktionen (Abb. 1), was die Biokompatibilität von Teflon demonstriert und zeigt, dass die entzündliche Reaktion an der Öffnung des Rohres mit dem untersuchten Material in Zusammenhang stand.
Die biologischen Eigenschaften von Endométhasone, einem auf Zinkoxid–Eugenol (ZOE) basierenden Wurzelkanalversiegler, wurden zuvor hinsichtlich antibakterieller Aktivität, Zytotoxizität und Gewebe-Biokompatibilität untersucht. Eugenol (4-Allyl-2-methoxyphenol) ist ein Extrakt aus Nelkenöl, der in der Zahnmedizin häufig als therapeutisches Mittel verwendet wird, am häufigsten als Bestandteil von Zinkoxid–Eugenol-Zement, der als Basis oder temporäre Füllung für Dentin oder als Wurzelkanalversiegler aufgetragen wird. Es wurden mehrere Studien über den histopathologischen Einfluss von ZOE-basierten Wurzelkanalversieglern auf Gewebe berichtet. Eugenol, das aus ZOE-basierten Wurzelkanalversieglern austritt, kann an der Entwicklung von periapikalen Entzündungen oder der Fortsetzung einer bereits bestehenden periapikalen Läsion beteiligt sein.
In der vorliegenden Studie nahmen die subkutanen Gewebeentzündungsreaktionen auf Endométhasone mit der Zeit ab, ähnlich den Ergebnissen von Kaplan et al., wahrscheinlich aufgrund der Neutralisierung des zu Beginn freigesetzten Eugenols und durch die lokale Freisetzung von Kortikoiden wie Dexamethason und Hydrocortison. Viele Forscher haben vorgeschlagen, dass die reizende Fähigkeit von ZOE-basierten Dichtstoffen hauptsächlich auf Eugenol und sekundär auf Zinkionen zurückzuführen sein könnte. Eugenol kann die Makrophagenfunktion hemmen und könnte die Entzündungsreaktionen im periapikalen Gewebe beeinflussen. Es wurde gezeigt, dass Paraformaldehyd allergische Reaktionen und Nekrose des Bindegewebes verursacht. Allerdings wurden trotz der hohen Konzentration von Paraformaldehyd im Endométhasone-Dichtstoff in der vorliegenden Studie solche Befunde nicht beobachtet.
Vor kurzem wurde ein neuer methacrylatbasierter endodontischer Dichtstoff als Wurzelkanaldichtstoff eingeführt. EndoREZ ist ein hydrophiles, 2-Komponenten, chemisch härtendes Material, das Zinkoxid, Bariumsulfat, Harze und Pigmente in einer Matrix aus Urethan-Dimethacrylat-Harz enthält.
Die biologischen Eigenschaften von EndoREZ wurden zuvor hinsichtlich seiner Zytotoxizität und Gewebe-Biokompatibilität untersucht. Studien zur Gewebe-Biokompatibilität von harzbasierten Dichtstoffen haben eine moderate bis schwere Entzündungsreaktion gezeigt. In der vorliegenden Studie verursachte EndoREZ in allen experimentellen Zeiträumen eine schwere Entzündungsreaktion. Da die durchschnittliche Lebensdauer eines Neutrophilen außerhalb des Blutgefäßes 7 Tage beträgt, deutet das Vorhandensein von polymorphkernigen Zellen in allen experimentellen Zeiträumen auf ein toxisches Verhalten dieses Materials hin. An kultivierten Zellen wurde gezeigt, dass EndoREZ mit der Zeit der Exposition zytotoxischer wurde und beim frisch gemischten Material signifikante zytotoxische Risiken aufwies. Die Reaktion des Bindegewebes auf mit EndoREZ gefüllte Silikontuben, die in das subkutane Gewebe von Ratten implantiert wurden, zeigte eine schwere Reaktion, die ihr Profil nach 30 Tagen erheblich veränderte, mit einer moderaten Reaktion nach 3 Monaten und Abwesenheit von Entzündungen nach 4 Monaten. Dennoch wurde auch berichtet, dass bei einigen Tieren die Entzündungsreaktion in allen experimentellen Zeiträumen anhielt. Es wurde angenommen, dass nach der subkutanen Implantation von frischem EndoREZ Komponenten wie Zink und Barium in direktem Kontakt mit dem Gewebe standen und die schwere anfängliche Reaktion verursachten. Im Gegensatz zu den Ergebnissen der vorliegenden Forschung zeigten Zmener et al., dass eine zufriedenstellende Reaktion des Knochengewebes im 60-tägigen Beobachtungszeitraum von EndoREZ, das in die Tibien von Ratten implantiert wurde, auftrat. Der langsame Abbau des EndoREZ-Dichtstoffs, veranschaulicht durch das dispergierte Material, und die anschließende Endozytose durch Makrophagen könnten die Ursache für eine solche anhaltende chronische Entzündung gewesen sein. Außerdem scheint die Wurzelkanalbehandlung mit seitlich kondensierten Guttapercha-Kegeln in Verbindung mit EndoREZ eine gute Gesamterfolgsquote nach 14-24 Monaten Nachuntersuchung aufzuweisen.
Zusätzlich wurde in der vorliegenden Studie die Anwesenheit vieler Mastzellen im Bindegewebe beobachtet, hauptsächlich im umliegenden Bereich der Blutgefäße, an den Tagen 30, 60 und 90, was auf eine späte Überempfindlichkeitsreaktion auf die Komponenten von EndoREZ hindeutet. Obwohl die späte Überempfindlichkeitsreaktion auf endodontische Materialien nicht häufig berichtet wird, sollten diese unerwünschten systemischen Reaktionen, die häufiger auftreten als in der Literatur berichtet, nicht ignoriert werden. Laut Bratel et al. können endodontische Materialien sogar in subtoxischen Konzentrationen eine späte Überempfindlichkeitsreaktion hervorrufen.
Fazit
Nach den FDI-Kriterien erlaubten die in der vorliegenden Studie erzielten Ergebnisse den Schluss, dass der Endométhasone Wurzelkanalverschlussmittel Biokompatibilität innerhalb der analysierten Zeiträume aufwies, während EndoREZ kein biokompatibles Verhalten zeigte und einen Hinweis auf eine späte Überempfindlichkeitsreaktion gab.
Autoren: Edilson José Zafalon, Marco Aurélio Versiani, Cássio José Alves de Souza, Camila Christian Gomes Moura, Paula Dechichi
Referenzen:
- Bernath M, Szabo J. Gewebereaktion, die durch verschiedene Dichtstoffe ausgelöst wird. Int Endod J 2003;36:256-61.
- Bouillaguet S, Wataha JC, Lockwood PE, Galgano C, Golay A, Krejci I. Zytotoxizität und Dichtungs Eigenschaften von vier Klassen endodontischer Dichtstoffe, bewertet durch die Aktivität der Succinatdehydrogenase und konfokale Laserscanning-Mikroskopie. Eur J Oral Sci 2004; 112:182-7.
- Kaplan AE, Ormaechea MF, Picca M, Canzobre MC, Ubios AM. Rheologische Eigenschaften und Biokompatibilität von endodontischen Dichtstoffen. Int Endod J 2003;36:527-32.
- Hauman CH, Love RM. Biokompatibilität von zahnmedizinischen Materialien, die in der zeitgenössischen endodontischen Therapie verwendet werden: eine Übersicht. Teil 2. Wurzelkanalfüllmaterialien. Int Endod J 2003;36:147-60.
- Gençoĝlu N, Turkmen C, Ahiskali R. Ein neuer silikonbasierter Wurzelkanaldichtstoff (Roekoseal-Automix). J Oral Rehabil 2003;30:753-7.
- Zmener O, Banegas G, Pameijer CH. Reaktion des Knochengewebes auf einen methacrylatbasierten endodontischen Dichtstoff: eine histologische und histometrische Studie. J Endod 2005;31:457-9.
- Huang TH, Yang JJ, Li H, Kao CT. Die Biokompatibilitätsbewertung von epoxidharzbasierten Wurzelkanaldichtstoffen in vitro. Biomaterials 2002;23:77-83.
- Ozbas H, Yaltirik M, Bilgic B, Issever H. Reaktionen des Bindegewebes auf Kompomer, Komposit und Amalgam Wurzelspitzenfüllmaterialien. Int Endod J 2003;36:281-7.
- Ho Y-C, Huang F-M, Chang Y-C. Mechanismen der Zytotoxizität von Eugenol in menschlichen osteoblastischen Zellen in vitro. Int Endod J 2006;39:389-93.
- Hauman CH, Love RM. Biokompatibilität von zahnmedizinischen Materialien, die in der zeitgenössischen endodontischen Therapie verwendet werden: eine Übersicht. Teil 1. Intrakanal Medikamente und Substanzen. Int Endod J 2003;36:75-85.
- Sousa CJ, Loyola AM, Versiani MA, Biffi JC, Oliveira RP, Pascon EA. Eine vergleichende histologische Bewertung der Biokompatibilität von Materialien, die in der apikalen Chirurgie verwendet werden. Int Endod J 2004;37:738-48.
- Tepel J, Darwisch el Sawaf M, Hoppe W. Reaktion des entzündeten periapikalen Gewebes auf intrakanal Medikamente und Wurzelkanaldichtstoffe. Endod Dent Traumatol 1994;10:233-8.
- Gerosa R, Menegazzi G, Borin M, Cavalleri G. Bewertung der Zytotoxizität von 6 Wurzelkanaldichtstoffen. J Endod 1995;21:446-8.
- Vajrabhaya L, Sithisarn P. Multilayer- und Monolayer-Zellkulturen in einem Zytotoxizitätstest von Wurzelkanaldichtstoffen. Int Endod J 1997;30:141-4.
- Bratel J, Jontell M, Dahlgren U, Bergenholtz G. Auswirkungen von Wurzelkanaldichtstoffen auf immunokompetente Zellen in vitro und in vivo. Int Endod J 1998;31:178-88.
- Serper A, Ucer O, Onur R, Etikan I. Vergleichende neurotoxische Effekte von Wurzelkanalfüllmaterialien auf den Ischiasnerv von Ratten. J Endod 1998;24:592-4.
- Ersev H, Schmalz G, Bayirli G, Schweikl H. Zytotoxische und mutagene Potenzen verschiedener Wurzelkanalfüllmaterialien in eukaryotischen und prokaryotischen Zellen in vitro. J Endod 1999;25:359-63.
- Telli C, Serper A, Dogan AL, Guc D. Bewertung der Zytotoxizität von calciumphosphathaltigen Wurzelkanaldichtstoffen durch MTT-Test. J Endod 1999;25:811-3.
- Huang FM, Tai KW, Chou MY, Chang YC. Zytotoxizität von harz-, zinkoxid-eugenol- und calciumhydroxidbasierten Wurzelkanaldichtstoffen auf menschliche parodontalen Ligamentzellen und permanente V79-Zellen. Int Endod J 2002;35:153-8.
- Schwarze T, Fiedler I, Leyhausen G, Geurtsen W. Die zelluläre Verträglichkeit von fünf endodontischen Dichtstoffen während der Aushärtezeit. J Endod 2002;28:784-6.
- Schwarze T, Leyhausen G, Geurtsen W. Langzeit-Zytokompatibilität verschiedener endodontischer Dichtstoffe unter Verwendung eines neuen Wurzelkanalmodells. J Endod 2002;28:749-53.
- Gomes BP, Pedroso JA, Jacinto RC, Vianna ME, Ferraz CC, Zaia, AA, et al. In vitro Bewertung der antimikrobiellen Aktivität von 5 Wurzelkanaldichtstoffen. Braz Dent J 2004;15:30-5.
- Perassi FT, Filho IB, Berbert FL, Carlos IZ, de Toledo Leonardo R. Sekretion von Tumornekrosefaktor-alpha durch Mausperitoneal-Makrophagen in Anwesenheit von zahnmedizinischen Dichtstoffen, Sealapex und Endométhasone. J Endod 2004;30:534-7.
- Pizzo G, Giammanco GM, Cumbo E, Nicolosi G, Gallina G. In vitro antibakterielle Aktivität von endodontischen Dichtstoffen. J Dent 2006; 34:35-40.
- Zmener O. Gewebeantwort auf einen neuen methacrylatbasierten Wurzelkanaldichtstoff: vorläufige Beobachtungen im subkutanen Bindegewebe von Ratten. J Endod 2004;30:348-51.
- Zmener O, Pameijer CH. Klinische und radiografische Bewertung eines harzbasierten Wurzelkanaldichtstoffs. Am J Dent 2004;17:19-22.
- Louw NP, Pameijer CH, Norval G. Histopathologische Bewertung eines Wurzelkanaldichtstoffs bei subhumanen Primaten [Abstract]. J Dent Res 2001;80:654.
- Fédération Dentaire International, Kommission für zahnmedizinische Materialien, Instrumente, Geräte und Therapeutika. Empfohlene Standardpraktiken für die biologische Bewertung von zahnmedizinischen Materialien. Int Dent J 1980;30:140-88.
- National Institutes of Health. Richtlinie des Public Health Service zur humanen Pflege und Nutzung von Labortieren, 2006. Verfügbar unter: http://grants.nih.gov/grants/olaw/references/phspol.htm.
- National Institutes of Health. Richtlinie des Public Health Service zur humanen Pflege und Nutzung von Labortieren, Klarstellung zur Verwendung von Kohlendioxid zur Euthanasie kleiner Labortiere, 2006. Verfügbar unter: http://grants.nih.gov/grants/olaw/ Compilation_of_Guidance.doc.
- Stanley HR. Toxizitätstests von zahnmedizinischen Materialien. 1. Auflage. Miami: CRC Press; 1985.
- Sousa CJA, Montes CRM, Pascon EA, Loyola AM, Versiani MA. Vergleich der intraossären Biokompatibilität von AH Plus, Endo-REZ und Epiphany Wurzelkanaldichtstoffen. J Endod 2006;32:656-62.
- Huang FM, Tsai CH, Yang SF, Chang YC. Induktion der Genexpression von Interleukin-6 und Interleukin-8 durch Wurzelkanaldichtstoffe in menschlichen osteoblastischen Zellen. J Endod 2005;31:679-83.
- Olsson B, Sliwkowski A, Langeland K. Subkutane Implantation zur biologischen Bewertung von endodontischen Materialien. J Endod 1981;7:355-67.
- de Oliveira L, Borges MM, Leal RC, Assreuy J, Kloetzel JK. Beteiligung von Stickstoffmonoxid bei experimenteller Trypanosoma cruzi-Infektion in Calomys callosus und Schweizer Mäusen. Parasitol Res 1997;83:762-770.
- Tanisaki M, Ogawa K, Lapa SRC, Da Silva PMC, Watanabe I. Morphometrische und hochauflösende Rasterelektronenmikroskopie-Studie des Calomys callosus major palatinus Nerv. Int J Morphol 2005;23:13-8.
- Dost CK, Saraiva J, Zentgraf U, Monesi N, Engels W, Albuquerque S. Ist Stickstoffmonoxid an der Toleranz von Calomys callosus als Reservoirwirt gegenüber Trypanosoma cruzi-Infektion beteiligt? J Infect 2006;52:49-55.
- Taniwaki NN, Andreoli WK, Calabrese KS, da Silva S, Mortara RA. Zerstörung von Myofibrillenproteinen im Herzmuskel von Calomys callosus, das chronisch mit Trypanosoma cruzi infiziert und mit einem immunsuppressiven Mittel behandelt wurde. Parasitol Res 2005;97:323-31.
- Martinez M, Milton FA, de Oliveira SA, de Lima NF, Segatelli TM, Pinheiro PF, et al. Ultrastrukturelle Veränderungen an der harten Gaumenschleimhaut von Calomys callosus nach 120 Tagen experimenteller chronischer Alkoholismus. J Submicrosc Cytol Pathol 2005;37:59-65.
- Carroll DS, Mills JN, Montgomery JM, Bausch DG, Blair PJ, Burans JP, et al. Hantavirus-Pulmonalsyndrom in Zentralbolivien: Beziehungen zwischen Reservoirwirten, Lebensräumen und viralen Genotypen. Am J Trop Med Hyg 2005;72:42-6.
- Gomes-Filho JE, Gomes BP, Zaia AA, Novaes PD, Souza-Filho FJ. Glycolmethacrylat: eine alternative Methode zur Einbettung subkutaner Implantate. J Endod 2001;27:266-8.
- Pascon EA, Leonardo MR, Safavi K, Langeland K. Gewebeantwort auf endodontische Materialien: Methoden, Kriterien, Bewertung und Beobachtungen. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1991;72:222-37.
- Holland R, Otoboni Filho JA, Bernabé PF, Nery MJ, de Souza V, Berbert A. Einfluss des Wurzelkanalstatus auf die parodontalen Heilung nach chirurgischer Verletzung bei Hunden. Endod Dent Traumatol 1994;10:77-82.
- Hume WR. Einfluss von Eugenol auf Atmung und Teilung in menschlichem Zahnmark, Mausfibroblasten und Leberzellen in vitro. J Dent Res 1984;63:1262-5.
- Gulati N, Chandra S, Aggarwal PK, Jaiswal JN, Singh M. Zytotoxizität von Eugenol in Dichtstoffen, die Zinkoxid enthalten. Endod Dent Traumatol 1991;7:181-5.
- Neff T, Layman D, Jeansonne BG. In vitro Zytotoxizitätsbewertung von endodontischen Dichtstoffen, die vor dem Test Hitze ausgesetzt waren. J Endod 2002;28:811-4.
- Ioannis K, Nikolaos E. In vivo Vergleich der Biokompatibilität von 2 Wurzelkanaldichtstoffen, die in das subkutane Bindegewebe von Ratten implantiert wurden. J Endod 1998;24:82-5.
- Nikolaos E, Ioannis K. Experimentelle Studie zur Biokompatibilität von vier Wurzelkanaldichtstoffen und deren Einfluss auf den Zink- und Calciumgehalt verschiedener Gewebe. J Endod 1995;21:122-7.
- Segura JJ, Jimenez-Rúbio A. Einfluss von Eugenol auf die Makrophagenadhäsion in vivo an Kunststoffoberflächen. Endod Dent Traumatol 1998;14:72-4.
- de Oliveira Mendes ST, Ribeiro Sobrinho AP, de Carvalho AT, de Souza Cortes MI, Vieira LQ. In vitro Bewertung der Zytotoxizität von zwei Wurzelkanaldichtstoffen auf die Makrophagenaktivität. J Endod 2003;29:95-9.
- Di Felice R, Lombardi T. Gingivale und mandibuläre Knochennekrose verursacht durch eine paraformaldehydhaltige Paste. Endod Dent Traumatol 1998;14:196-198.
- Cotran RS, Kumar V, Robbins SL. Pathologischer Basis der Krankheit: Zellereignisse. 5. Auflage. Philadelphia: Saunders; 1994.
- el Sayed F, Seite-Bellezza D, Sans B, Bayle-Lebey P, Marguery MC, Bazex J. Kontakturtikaria durch Formaldehyd in einer Wurzelkanal-Zahnpaste. Contact Dermatitis 1995;33:353.
- Ebner H, Kraft D. Nach dentaler Behandlung induzierte Anaphylaxie durch Formaldehyd? Contact Dermatitis 1991;24:307-9.

/social-network-service/media/default/6758/89a8282e.png)